Мукополисахаридоз ii тип синдром хантера

Синдром Хантера — наследственное заболевание обмена веществ с Х-сцепленным рецессивным типом наследования, характеризующееся дефицитом лизосомального фермента идуронат-2-сульфатазы и накоплением мукополисахаридов в тканях. При синдроме Хантера отмечается задержка роста, макроцефалия, деформация костно-суставного аппарата, поражение кожи, сердечно-сосудистой и дыхательной системы, гепатоспленомегалия, нарушение слуха, умственная отсталость. С целью диагностики синдрома Хантера проводится консультация генетика, определение экскреции гликозаминогликанов, рентгенография костей и суставов. Пациентам с синдромом Хантера показана пожизненная ферментозамещающая терапия препаратом элапраза.
Общие сведения
Синдром Хантера (мукополисахаридоз II типа) — редкое генетическое заболевание, сцепленное с Х-хромосомой, при котором вследствие ферментной недостаточности происходит неполное разрушение и накопление кислых мукополисахаридов (гликозаминогликанов) в различных тканях. Частота рождения детей с синдромом Хантера составляет примерно 1:100000-150000 новорожденных. В настоящее время в мире насчитывается не более 2000 больных синдром Хантера; по России официальная статистика отсутствует. Синдром Хантера относится к группе орфанных заболеваний, лечение которых, согласно действующему законодательству, должно осуществляться за счет средств федерального и регионального бюджета.

Синдром Хантера
Причины синдрома Хантера
Развитие синдрома Хантера связано с мутацией гена идуронатсульфатазы (IDS), кодирующего лизосомный фермент идуронат-2-сульфатазу. Ген IDS картирован в локусе Xq28 на длинном плече Х-хромосомы; в настоящее время известно более 150 различных его мутаций (точечные мутации, мелкие и крупные делеции, вставки, перестройки и пр.).
В силу сцепленности наследования с Х-хромосомой, синдромом Хантера, как правило, страдают исключительно мальчики (XY). Гетерозиготные женщины в подавляющем большинстве случаев являются носителями мукополисахаридоза II типа без клинических проявлений, однако описаны несколько случаев синдрома Хантера у девочек, связанных с новой мутацией или инактивацией второй, нормальной Х-хромосомы.
Мутации в гене IDS сопровождаются дефицитом или отсутствием фермента iduronate-2-sulfatase (I2S), неполным расщеплением и накоплением в лизосомах клеток практически всех тканей и органов гликозаминогликанов (ГАГ) — дерматансульфата и гепарансульфата.
Классификация синдрома Хантера
Степень выраженности клинических проявлений синдрома Хантера (среднетяжелая, тяжелая) зависит от типа мутации в гене IDS. Так, крупные делеции и сложные перестройки, как правило, обусловливают развитие тяжелых форм синдрома Хантера. Для тяжелой степени (мукополисахаридоза типа IIА) характерно ранее развитие клинических симптомов (преимущественно в возрасте 18-36 месяцев), быстро прогрессирующее течение, выраженная умственная отсталость, полиорганное поражение. Пациенты с тяжелой формой синдрома Хантера погибают на втором десятилетии жизни.
Среднетяжелая форма (мукополисахаридоз типа IIВ) составляет примерно 1/3 всех случаев патологии. Клинические проявления синдрома Хантера обычно возникают у детей в 3-8 (иногда 10-13) лет; интеллект обычно сохранен; продолжительность жизни при благоприятных условиях может достигать 50-60 лет. Пациенты с легкой формой синдрома Хантера могут успешно реализовать себя в профессиональной сфере и иметь здоровое потомство.
Симптомы синдрома Хантера
На момент рождения дети с синдромом Хантера выглядят клинически здоровыми. Основная симптоматика развивается в среднем в 2-4 года. До этого возраста проявления заболевания неспецифичны: у детей могут отмечаться повторные риниты, шумное дыхание, пупочные и паховые грыжи, гидроцеле.
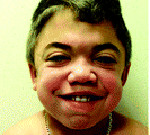
Ранним характерным признаком синдрома Хантера служит постепенное изменение внешности ребенка: черты лица становятся грубыми (гаргоилизм); язык, губы и ноздри – большими; кожа – толстой. Облик больного с синдромом Хантера дополняется низкорослостью, увеличением размеров головы (макроцефалией), короткой шеей, аномалиями зубных рядов (редкими зубами). Дети с синдромом Хантера внешне очень похожи друг на друга и напоминают братьев.
Другие ранние признаки мукополисахаридоза II типа включают хриплый низкий голос, увеличение живота, гепатоспленомегалию. Дети с синдромом Хантера склонны к частой заболеваемости ОРВИ, отитами, ларингитом, трахеитом, пневмониями; нередко у них отмечается обструктивное апноэ сна, хроническая диарея. Следствием отложения гликозаминогликанов и липидов в дерме служит возникновение узелково-папулезных высыпаний на коже плеч, бедер, лопаток. Возможно появление «монгольских пятен» в пояснично-крестцовой области, гипертрихоза.
Уже в дошкольном возрасте у детей с синдромом Хантера появляются признаки поражения опорно-двигательного аппарата, выражающиеся в тугоподвижности суставов, развитии кифосколиоза, деформации кистей по типу «когтистой лапы». Движения становятся затруднительными, походка неуклюжей; к юношескому возрасту больные с синдромом Хантера нередко делаются беспомощными инвалидами, прикованными к постели.
Неврологические нарушения, возникающие при синдроме Хантера, включают синдром гипервозбудимости, судороги, сообщающуюся гидроцефалию, спастическую параплегию, задержку речевого развития, прогрессирующую тугоухость. Со стороны зрительной системы обнаруживается помутнение роговицы, атипичный пигментный ретинит. К наиболее поздним признакам мукополисахаридоза II типа относятся кардиологические нарушения: появление шумов в сердце, приобретенные пороки сердца (чаще митральная недостаточность), кардиомиопатия и др.
У ребенка могут наблюдаться изменения психики: обидчивость, агрессивность. В зависимости от типа синдрома Хантера интеллектуальный дефект может быть небольшим или значительно выраженным. Летальный исход у больных с синдромом Хантера обычно наступает от прогрессирующей сердечной или легочной недостаточности.
Диагностика синдрома Хантера
В практике педиатра синдром Хантера встречается исключительно редко. Тем не менее, мукополисахаридоз II типа может быть заподозрен на основании клинических признаков (внешних изменений, манифестации заболевания на 2-4 году жизни, прогредиентного течения и др.). Для подтверждения диагноза дети нуждаются в консультации генетика, анализе клинико-генеалогических данных, проведении молекулярно-генетических исследований.
Важным биохимическим маркером синдрома Хантера служит повышение экскреции мукополисахаридов (дерматансульфата, гепарансульфата) с мочой, дефицит фермента идуронат-2-сульфатазы. Рентгенологические исследования костей черепа, суставов, трубчатых костей, позвоночника демонстрируют дизостоз, остеоартрит, множественные изменения позвонков.
Для обнаружения морфофункциональных изменений со стороны внутренних органов и ЦНС проводится УЗИ органов брюшной полости, ЭКГ, ЭхоКГ, электроэнцефалография, МРТ головного мозга. Морфологическое исследование тканей, полученных в результате биопсии кожи, печени, миокарда и пр., выявляет однотипные изменения — клетки, заполненные гликолипидами.
В семьях с известным генотипом и высоким риском рождения ребенка с синдромом Хантера может проводиться инвазивная пренатальная диагностика – биопсия ворсин хориона, амниоцентез или кордоцентез с определением активности идуронат-2-сульфатазы в полученном материале.
Дифференциальную диагностику синдрома Хантера следует проводить с другими формами мукополисахаридозов (прежде всего, синдромом Гурлера), а также с другими лизосомными болезнями накопления.
Лечение синдрома Хантера
Детям с синдрома Хантера необходимо пожизненное проведение ферментозаместительной терапии. На сегодняшний день единственным препаратом, зарегистрированным в США, Европе и России для лечения больных с синдромом Хантера, является идурсульфаза. Пациенты с мукополисахаридозом II типа должны получать идурсульфазу еженедельно путем внутривенного капельного введения в дозе 0,5 мг/кг массы тела.
Кроме патогенетического лечения, детям с синдромом Хантера проводятся регулярные медикаментозные курсы симптоматической и корригирующей терапии гепатопротекторами, витаминами, антиоксидантами, цитопротекторами. В комплексную терапию синдрома Хантера целесообразно включать ЛФК, физиотерапию (электрофорез лидазы на суставы, парафиновые аппликации, магнитотерапию, лазеропунктуру), занятия с дефектологом и логопедом.
Прогноз и профилактика синдрома Хантера
Синдром Хантера типа В имеет более благоприятное течение и прогноз; при своевременном и регулярном лечении продолжительность жизни больных может достигать 50-60 лет. При тяжелых формах мукополисахаридоза II типа пациенты обычно погибают до 20 лет от сердечно-сосудистой недостаточности. На сегодняшний день серьезную проблему для больных с синдромом Хантера представляет своевременное получение жизненно необходимого препарата идурсульфазы из-за его высокой стоимости.
Дети с синдромом Хантера нуждаются в наблюдении различных специалистов: детского генетика, педиатра, детского кардиолога, детского невролога, эпилептолога, детского офтальмолога, детского отоларинголога, детского хирурга, детского ортопеда.
Основным методом профилактики синдрома Хантера является медико-генетическое консультирование супружеских пар, имеющих вероятность рождения больного ребенка, а также проведение дородовой диагностики. Следует знать, что у больных с синдромом Хантера рождаются здоровые сыновья, а дочери выступают облигантыми носителями мутантного гена.
Источник
 В статье представлен материал по чрезвычайно актуальной проблеме педиатрии – мукополисахаридозам, генетически детерменированным редким заболеваниям. Обозначены существующие на сегодняшний день проблемы, в числе которых несвоевременная диагностика, обуславливающая позднее начало терапии и прогрессирование болезни, медико-социальные проблемы детей, страдающих мукополисахаридозами. Приведен клинический случай успешной ферментозаместительной терапии у ребёнка с мукополисахаридозом II типа (синдромом Хантера).
В статье представлен материал по чрезвычайно актуальной проблеме педиатрии – мукополисахаридозам, генетически детерменированным редким заболеваниям. Обозначены существующие на сегодняшний день проблемы, в числе которых несвоевременная диагностика, обуславливающая позднее начало терапии и прогрессирование болезни, медико-социальные проблемы детей, страдающих мукополисахаридозами. Приведен клинический случай успешной ферментозаместительной терапии у ребёнка с мукополисахаридозом II типа (синдромом Хантера).
Мукополисахаридозы (МПС) — группа наследственных болезней соединительной ткани, обусловленных нарушением обмена гликозаминогликанов (кислых мукополисахаридов) в результате генетической неполноценности лизосомных ферментов, участвующих в их расщеплении. Вследствие ферментативной недостаточности последние накапливаются в большом количестве в органах и тканях, что даёт основание отнести их к болезням накопления. В педиатрической практике среди всех болезней накопления мукополисахаридозы и среди них мукополисахаридоз II типа или синдром Хантера (СХ) встречаются с наибольшей частотой. Впервые описан Charles A. Hunter в1917году. Это тяжелое, Х-сцепленное рецессивное заболевание, связанное с дефицитом или отсутствием лизосомного фермента идуронат-2-сульфатазы, осуществляющего гидролиз дерматан и гепаран сульфата в соединительной ткани. Болеют в основном мальчики, девочки являются носительницами патологического гена. Частота встречаемости в мире колеблется в пределах 1:70 000 -1:200 000.
Накопление гликозаминогликанов в лизосомах вызывает тяжелые нарушения функций клеток, органов и систем, определяя широкий диапазон клинических проявлений. Клиническая гетерогенность вызвана, в том числе, и многообразием происходящих мутаций патологического гена.
Возможны 2 варианта течения заболевания: с быстрым прогрессированием (раннее появление симптомов, задержка интеллектуального развития, ранняя смерть в первые десять лет жизни) и — медленным, когда первые симптомы болезни появляются в 5-15 лет. При этом интеллектуальный регресс минимален и наступает во взрослом возрасте.
Обычно фенотипический «манифест» наступает в 2-4 года, до этого периода никаких признаков болезни не прослеживается. Первые признаки заболевания проявляются в виде дисморфических черт лица (утолщение губ, ноздрей, широкая переносица, увеличение лобных бугров, густые брови). Затем появляется макроглоссия, аномалии зубов, макроцефалия, скафоцефалия, изменения скелета, короткая шея, низкий рост, толстая кожа с узелками, папулами, гирсутизмом, паховые, пупочные грыжи, тугоподвижность и деформации мелких и средних суставов, увеличенный живот за счёт спленомегалии. Изменения со стороны центральной и периферической нервной систем включают задержку психоречевого развития, нарушение поведения (упрямство, агрессию, гиперактивность), нарушение сна, псевдобульбарный синдром, симптоматическую эпилепсию, спастический тетрапарез, атрофическую гидроцефалию, нейросенсорную тугоухость, поражение зрительных нервов. Со стороны сердечно-сосудистой системы отмечаются аритмии, лёгочная гипертензия, гипертрофическая или рестриктивная кардиомиопатии, поражения клапанного аппарата сердца, вторичная застойная сердечная недостаточность. С раннего возраста отмечается увеличение глоточных и небных миндалин, хроническая ринорея, обструкции верхних дыхательных путей, трахеобронхомаляции, происходит утолщение голосовых связок с изменением тембра голоса. Возможны жизнеугрожающие апноэ. Ребенок часто болеет респираторными инфекциями, отитами, пневмониями.
Поражения глаз представлены атипичным пигментным ретинитом, разрушением сетчатки, атрофией зрительного нерва. Прогрессирующая потеря слуха обуславливает поведенческие нарушения, трудности в обучении. С возрастом эти изменения становятся более выраженными. Молекулярной основой дефекта соединительной ткани является нарушенный обмен гликозамингликанов.
Диагностика СХ основана на совокупности клинических, инструментальных и лабораторных данных. Постановка диагноза СХ базируется на определении активности идуронат-2-сульфотазы в лейкоцитах крови, сыворотке крови, культуре фибробластов кожи, уровня гликозаминогликанов в моче, ДНК-тестировании. Пренатальная диагностика основана на измерении активности фермента I2S в амниотической жидкости, амниоцитах, тканях, ворсинках хориона.
Реальные возможности помощи детям с СХ в нашей стране появились с момента регистрации в РФ в 2008 году рекомбинантной человеческой идуронат-2-сульфатазы, препарата «элапраза» (Idursulfatase), Shire (США), основного патогенетического лекарственного средства в лечении такой категории пациентов. Необходимы еженедельные инфузии препарата в дозе 0,5 мг/кг.
Поскольку в прогрессирующий патологический процесс вовлекаются все органы и системы оказание медицинской помощи пациентам с МПС должно строится с позиций междисциплинарного, комплексного подхода.
Однако, на сегодняшний день, организацию медицинской помощи детям с МПС в целом в РФ нельзя оценивать положительно. Отсутствие опыта и знаний у врачей по данному разделу патологии, стандартов лечения данной болезни диктуют необходимость организации системы мероприятий по информированию «узкопрофильных» специалистов и педиатров общей практики об особенностях дебюта и течения МПС.
Проблемы большинства пациентов с редкими заболеваниями схожи – это поздние сроки диагностики, а следовательно — и начала лечения, трудности в получении дорогостоящих лекарственных препаратов, стоимость которых в год составляет около 400 тысяч евро для одного пациента, В РФ средний возраст начала единственно необходимой ферментозаместительной терапии среди детей с МПС – 6,8 года, когда патологические изменения приобретают уже необратимый характер.
Требуют решения вопросы социальной, юридической, паллиативной помощи, в чём не просто нуждаются, а остро нуждаются эти пациенты и семьи, в которых они воспитываются.
Прогноз: При быстром прогрессировании болезни с вовлечением ЦНС больные обычно погибают в возрасте 10-15 лет, при «мягких» формах МПС 11 типа – продолжительность жизни может составить 50 лет и более при соответствующем лечении [3].
Приводим собственное клиническое наблюдение мальчика П. с синдромом Хантера.
Ребенок родился у молодых здоровых родителей, от 1-ой беременности, протекавшей на фоне анемии легкой степени, гестоза отечной формы. Роды первые, срочные. Масса тела при рождении 3430,0, длина 52 см, окружность груди 34 см. Оценка по шкале Апгар 8/9 баллов, ранняя неонатальная желтуха. Темпы физического и психомоторного развития на первом году жизни соответствовали эпикризным срокам. Профилактические прививки осуществлялись в соответствии с национальным календарём прививок, осложнений не отмечалось. В раннем возрасте переносил частые респираторные инфекции, бронхиты, пневмонию. В 3-х летнем возрасте диагностированы аденоиды III степени. С 3,5 лет появилась тугоподвижность и ограничение объёма движений в суставах, тугоухость, задержка роста, с 5 лет – лицевые дисморфии и другие фенотипические особенности: широкая переносица, толстые губы, редкие зубы, короткие и толстые пальцы, короткая шея, шумное дыхание, увеличение живота за счет гепатоспленомегалии.
В 5 лет выполнена аденотомия, в 5,5 лет — оперативное вмешательство по поводу паховой и пупочной грыжи. При ультразвуковом исследовании выявлена единственная, правая почка.
В 6 лет 4 месяца госпитализирован в кардиоревматологическое отделение ДОКБ г. Орла с жалобами на боли и скованность в лучезапястных, коленных, голеностопных, межфаланговых суставах. По результатам клинико-лабораторно-инструментальных исследований, консультаций специалистов выставлен диагноз: Вторичная артропатия. Двухстворчатый аортальный клапан с недостаточностью 2-3 степени.
Нейросенсорная тугоухость. гиперметропический астигматизм. Мукополисахаридоз VI тип?
При дообследовани в медико-генетическом центре г. Москвы, выявлена повышенная экскреция дерматансульфата и гепарансульфата с мочой, значительное снижение идуронатсульфатазы в плазме, до 3,18 nmol/4h/ml (норма 297-705), что позволило уточнить тип мукополисахаридоза –II тип (синдром Хантера).
В 6 лет 11 месяцев – лечение в психоневротическом отделении НЦЗД г. Москвы с клиническим диагнозом: Мукополисахаридоз II типа (синдром Хантера). Вторичная кардиомиопатия. Темповая задержка психо-речевого развития. Рецидивирующий бронхит. Контрактуры крупных и мелких суставов конечностей 1-2 степени. Гиперметропический астигматизм. Единственная правая почка. Нейросенсорная тугоухость 2 степени.
С сентября 2011 года в возрасте 7 лет 11 месяцев в условиях педиатрического отделения ДОКБ г. Орла ребёнку проводится ферментозаместительная терапии – еженедельные инфузии препаратом «Элапраза» » (Idursulfatase), Shire (США). Пропусков введений не было. Осложнений не отмечалось. На 01.06.2012 года мальчик вырос на 4см (рост 125см), 1,5 кг прибавил в весе (масса 28,5кг), улучшилась переносимость физических нагрузок, сократились размеры печени, селезёнки, увеличился объем движений в суставах.
Таким образом, представленный клинический случай имеет большой практический интерес для врачей-педиатров, генетиков и других специалистов в связи с редкостью данного наследственного заболевания. Заслуживает внимания появление новых возможностей в терапии таких пациентов, а именно, внедрение единственно эффективного патогенетического средства идуронат-2-сульфатазы (элапраза), открывающего новые реалии в прогнозе данного заболевания.
Своевременная диагностика мукополисахаридозов, правильное ведение данного контингента больных, раннее назначение ферментозаместительной терапии, будут способствовать уменьшению тяжести заболевания, снижению инвалидизации детей, более адекватной интеграции их в общество.
Литература:
- Новиков П.В. Проблема редких (орфанных) наследственных болезней у детей в России и пути ее решения // П.В. Новиков// Российский вестник перинатологии и педиатрии. 2012. №2. С. 4-8.
- Баранов А.А.1,2, Л.С. Намазова-Баранова1,2, А.К.Говоркян1, В.М. Краснов1, Л.М. Кузенкова1,2, Г.А. Каркашадзе1, Н.Д. Вашакмадзе1, Т.В. Подклетнова1 // Педиатрическая фармакология. 2011. Т.8, № 5, С.
- Воскобоева Е.Ю. ДНК – диагностика наследственных мукополисахаридов / Е.Ю. Воскобоева // Мед. генетика. 2006. Т. 5, № 10. С. 33 – 37.
Источник
