Морганьи адамса стокса синдром патогенез
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 декабря 2017;
проверки требуют 4 правки.
Синдро́м Морга́ньи — А́дамса — Сто́кса — обморок, вызванный резким снижением сердечного выброса и ишемией мозга вследствие остро возникшего нарушения сердечного ритма (синоатриальная блокада 2 степени или полная атриовентрикулярная блокада, пароксизмальная тахикардия, фибрилляция желудочков, синдром слабости и тупости синусно-предсердного узла и др.). Назван по имени итальянца Джованни Баттиста Морганьи (1682—1771)[1] и ирландцев Роберта Адамса (1791—1875) и Уильяма Стокса (1804-1878).
Этиология и патогенез[править | править код]
Синдром Морганьи — Адамса — Стокса возникает вследствие ишемии головного мозга при внезапном уменьшении сердечного выброса, обусловленном нарушениями ритма сердца или снижением ЧСС. Причиной их могут быть желудочковая тахикардия, фибрилляция желудочков, полная АВ-блокада и преходящая асистолия.
Синдром Морганьи — Адамса — Стокса иногда возникает при синдроме слабости синусового узла, гиперчувствительности каротидного синуса и синдроме обкрадывания головного мозга[источник не указан 3361 день]. Симптомы нарушения сознания появляются через 3—10 секунд после остановки кровообращения
Клиническая картина[править | править код]
Приступы обычно наступают внезапно, редко продолжаются более 1—2 минуты, и, как правило, не влекут за собой неврологических осложнений. Острый инфаркт миокарда или нарушения мозгового кровообращения могут быть как причиной, так и следствием синдрома Морганьи — Адамса — Стокса.
В начале приступа больной внезапно бледнеет и теряет сознание; после восстановления сознания часто появляется выраженная гиперемия кожи. Определить причину приступов нередко позволяет амбулаторный мониторинг.
Лечение[править | править код]
Если причиной синдрома являются тахиаритмии, необходимо назначить соответствующие антиаритмические препараты. Если приступы возникают вследствие брадикардии (чаще всего при полной АВ-блокаде), показана постоянная электрокардиостимуляция. Если обострение синдрома вызвано полной АВ-блокадой с медленным замещающим желудочковым ритмом, для неотложного лечения можно использовать внутривенное введение изопротеренола или адреналина с целью повышения ЧСС. Предпочтительно применять изопротеренол, так как он обладает более выраженным положительным хронотропным действием, реже вызывает желудочковые аритмии и не приводит к чрезмерному подъему АД.
Больным с длительными или повторными брадиаритмиями может потребоваться временная или постоянная электрокардиостимуляция.
Зачастую необходим полный комплекс реанимационных мероприятий, включающий в себя непрямой массаж сердца, болюсное введение 0,1% раствора адреналина , 0,1% атропина, обладающие положительным дроно-, хроно- , батмотропными эффектами. Для восстановления ритма — дефибрилляция. ЭИТ не применяется при брадикардии.
См. также[править | править код]
- Атриовентрикулярная проводимость
- Бета-адреномиметики
- Острый инфаркт миокарда
Примечания[править | править код]
Ссылки[править | править код]
- Синдром Морганьи — Адамса — Стокса
Источник

Синдром Морганьи-Адамса-Стокса – это комплекс симптомов, обусловленных резким снижением сердечного выброса и ишемией головного мозга у больных, страдающих выраженными нарушениями ритма. Проявляется в виде приступов синкопе, судорог, фибрилляции желудочков, асистолии. Диагноз устанавливается по наличию характерной клинической картины, изменениям на электрокардиограмме, результатам суточного мониторирования. Заболевание дифференцируют с эпилепсией, истерическим припадком. Лечение состоит из реанимационных мероприятий в момент развития симптоматики и последующего терапевтического восстановления нормальной работы сердца.
Общие сведения
Впервые синдром Морганьи-Адамса-Стокса был описан итальянским анатомом и врачом Д. Морганьи в 1761 году. В период с 1791 по 1878 г заболевание изучалось ирландскими кардиологами Р. Адамсом и В. Стоксом. С учетом вклада всех специалистов синдром был назван их именами. Патология распространена среди пациентов, страдающих сердечными болезнями, в первую очередь – блокадами внутрисердечной проводимости и синдромом слабости синусового узла. Чаще диагностируется у людей старше 45-55 лет, мужчины составляют около 60% от общего числа больных. Максимальное количество случаев регистрируется в развитых странах, жители которых склонны к гиподинамии и подвержены воздействию кардиотоксических веществ. В государствах «третьего мира» синдром встречается сравнительно редко.
Синдром Морганьи-Адамса-Стокса
Причины
К развитию болезни приводят врожденные органические изменения в строении проводящей системы, а также нарушения, возникающие под влиянием внешних патогенетических факторов. К их числу относят передозировку антиаритмическими средствами (новокаинамид, амиодарон), профессиональную интоксикацию хлорорганическими соединениями (винилхлорид, четыреххлористый углерод), дистрофические и ишемические изменения миокарда, затрагивающие крупные узлы системы автоматизма (синатриальный, атриовентрикулярный). Кроме того, синдром может формироваться в результате возрастной дегенерации АВ-центра. Непосредственно приступ имеет следующие причины:
- Блокады проводимости. Наиболее распространенная этиологическая форма. Развивается при переходе неполной АВ-блокады в полную. При этом возникает диссоциация между предсердиями и желудочками. Первые сокращаются под действием импульсов, исходящих от СА-узла, вторые возбуждаются АВ-центром или эктопическими очагами. Также провоцирующим фактором может послужить частичная атриовентрикулярная блокада на фоне синусового ритма и увеличенного показателя сердечных сокращений.
- Нарушения ритма. Приступ выявляется при чрезмерном подъеме или уменьшении ЧСС. Обычно синкопе отмечается у пациентов с частотой сердечных сокращений более 200 или менее 30 ударов в минуту. При наличии диффузных поражений церебрального сосудистого аппарата потеря сознания наблюдается уже при пульсе 40-45 уд/мин. Патология также может потенцироваться фибрилляцией предсердий, особенно – возникшей впервые. Постоянные формы аритмии редко приводят к появлению симптоматики МАС.
- Утрата сократительной функции. Происходит при вентрикулярной фибрилляции. Мышечные волокна миокарда сокращаются некоординированно, по отдельности, с очень высокой частотой. Это делает выброс крови невозможным, ведет к остановке кровообращения и развитию клинической смерти. Может встречаться при нарушениях электролитного баланса, иметь идеопатическую природу (на фоне полного здоровья), являться результатом воздействия физических факторов.
Патогенез
В основе лежит резкое сокращение сердечного выброса, которое становится причиной замедления кровотока, недостаточного снабжения органов и тканей кровью, кислородом, питательными веществами. Первоначально от гипоксии страдают нервные структуры, в том числе головной мозг. Работа ЦНС нарушается, происходит потеря сознания. Чуть позже возникают судорожные мышечные сокращения, свидетельствующие о выраженном кислородном голодании тканей. Длительные приступы, особенно обусловленные фибрилляцией желудочков, могут привести к постгипоксической энцефалопатии, полиорганной недостаточности. При сохранении минимального кровотока (блокады, аритмии) заболевание протекает легче. Приступы в большинстве случаев не приводят к отсроченным последствиям.
Классификация
Патогенетическая систематизация, учитывающая причины и механизмы формирования приступа, используется при плановом лечении и выборе мер профилактики. При оказании экстренной помощи синдром Морганьи-Адамса-Стокса удобнее классифицировать по виду нарушения коронарного ритма, поскольку это позволяет быстро определить оптимальную тактику лечения. Различают следующие виды патологии:
- Адинамический тип. Наблюдается при отказе синоатриального узла, блокадах III и II степени, когда частота сокращений желудочков снижается до 20-25. Включает асистолию – остановку сердца, возникающую при резком и полном нарушении проводимости внутрисердечного импульса. До момента подключения альтернативных эктопических зон проходит достаточно много времени, что становится причиной прекращения кровообращения.
- Тахиаритмический тип. Определяется при увеличении ЧСС до 200 в минуту и выше. Выявляется при синусовой тахикардии, трепетании, вентрикулярном мерцании, пароксизмальных суправентрикулярных ТК, фибрилляции предсердий с проведением импульса на желудочки по обходным путям при синдроме Вольфа-Паркинсона-Уайта.
- Смешанный тип. Моменты предсердной или желудочковой тахикардии чередуются с эпизодами асистолии. Приступ развивается при быстром уменьшении ЧСС с высоких показателей до брадикардии или временной остановки сердца. Эта форма является наиболее сложной для диагностики и прогностически неблагоприятной.
Симптомы
Классический припадок характеризуется быстрым развитием и определенной последовательностью изменений. В течение 3-5 секунд с момента возникновения аритмии или блокады у пациента формируется предобморочное состояние. Внезапно появляется головокружение, головная боль, дискоординация, дезориентация, бледность. На коже выступает обильный холодный пот. При пальпаторной оценке пульса обнаруживается резко выраженная тахикардия, брадикардия или неровный ритм.
Второй этап длится 10-20 секунд. Больной теряет сознание. Снижается артериальное давление, мышечный тонус. Визуально определяется акроцианоз, развиваются мелкие клонические судороги. При фибрилляции желудочков отмечается симптом Геринга – своеобразное жужжание в области мечевидного отростка грудины. Через 20-40 секунд судороги усиливаются, приобретают эпилептовидную форму, происходит непроизвольное мочеиспускание, дефекация. Если ритм не восстанавливается через 1-5 минут, наблюдается клиническая смерть с исчезновением пульса, дыхания, роговичных рефлексов. Зрачок расширен, АД не определяется, кожа бледная, мраморного оттенка.
Возможно абортивное течение приступа с редукцией симптоматики в течение очень короткого временного промежутка. Кора мозга не успевает подвергнуться выраженной гипоксии. Основными симптомами, наблюдаемыми при этом варианте патологии, являются головокружение, слабость, преходящее нарушение зрения, помрачение сознания. Проявления исчезают за несколько секунд без медицинского вмешательства. Подобные разновидности МАС крайне сложно диагностировать, поскольку аналогичная симптоматика выявляется при множестве других состояний, в т. ч. при цереброваскулярной болезни.
Осложнения
Синдром приводит к ряду осложнений, основным из которых является клиническая смерть. Длительная остановка кровотока – фактор отмирания части клеток коры головного мозга. После успешной реанимации это становится причиной энцефалопатии, соматических нарушений, снижения умственных способностей больного. В число осложнений можно включить изменения психоэмоционального фона пациента, постоянно испытывающего страх перед наступлением нового криза, что негативно отражается на качестве жизни, продуктивности работы и отдыха. Во время утраты сознания и падения на землю больной может получить травмы, которые также относят к патологическим состояниям, ассоциированным со СМАС.
Диагностика
Первичную диагностику осуществляют сотрудники СМП, прибывшие на вызов. Окончательный диагноз устанавливает кардиолог, основываясь на результатах электрокардиографии и холтеровского мониторирования. Дифференциальную диагностику проводят с эпилептическим припадком, истерией. Отличительной особенностью истинной эпилепсии является смена тонических судорог клоническими, гиперемия лица, предшествующая аура. При истерическом происхождении патологии утраты сознания не происходит, присутствует синусовый сердечный ритм. Признаками болезни МАС считаются наличие аритмии того или иного характера, стремительное развитие клинической картины. В процессе диагностического поиска используют следующие методы:
- Физикальное обследование. Отмечаются типичные симптомы, состояние развивается быстро (в течение нескольких десятков секунд). В анамнезе присутствуют заболевания кардиологического профиля, непосредственно перед приступом возможен эпизод психоэмоционального возбуждения, переживаний. АД резко снижено или не измеряется, сердечный ритм неровный. Тип нарушения можно определить только по результатам ЭКГ.
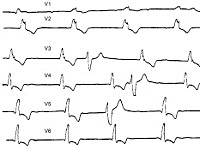
- Инструментальное обследование. Основной метод аппаратной диагностики – электрокардиография. В момент появления симптомов на пленке регистрируются отрицательные расширенные зубцы «T» в отведениях V4-V2. Возможно присутствие деформированных желудочковых комплексов. При блокадах наблюдается диссоциация «P» с «QRS», косонисходящая депрессия сегмента «ST». Фибрилляция проявляется отсутствием нормальной активности на ЭКГ, появлением мелкой или крупной волнистой линии. С помощью суточного мониторирования удается обнаружить преходящую блокаду, на фоне которой наступает приступ.
- Лабораторное обследование. Проводится с целью определения причин болезни и ее последствий. После эпизода клинической смерти выявляется изменение уровня pH в кислую сторону, дефицит электролитов, присутствие в крови миоглобина. При коронарных заболеваниях возможен рост кардиоспецифических маркеров: тропонина, КФК МВ.
Неотложная помощь
Помощь при синдроме МАС включает непосредственное купирование приступа и профилактику рецидивов. При развивающемся припадке спасательные мероприятия производит присутствующий медицинский работник независимо от его профиля и специализации. Осуществляются комбинированные реанимационные мероприятия. Лечение включает:
- Прекращение припадка. Применяется тот же алгоритм, что при остановке сердца. Рекомендовано проведение прекардиального удара, непрямого массажа, при отсутствии дыхания – ИВЛ методом рот в рот или с использованием соответствующей аппаратуры. При ФЖ производится электрическая дефибрилляция. Внутривенно вливается адреналин, атропин, хлористый кальций, инотропные средства. При тахиаритмии показаны антиаритмические препараты: амиодарон, новокаинамид.
- Предотвращение припадка. Если приступы обусловлены пароксизмами ТА, пациенту требуются препараты для стабилизации работы миокарда и выравнивания сердечного ритма. При блокадах медикаментозная терапия неэффективна, необходима имплантация асинхронного или деманд-кардиостимулятора. При реципрокной тахикардии возможно оперативное разрушение одного из проводящих путей АВ-узла.
Прогноз и профилактика
Прогноз благоприятный при быстром купировании приступа и при его абортивном варианте. Нормализация сердечного ритма и кровоснабжения головного мозга в течение 1 минуты с момента формирования клинической картины не сопровождается отсроченными последствиями. Длительный период асистолии или фибрилляции желудочков снижает вероятность благополучного восстановления коронарного ритма и повышает риск ишемического поражения головного мозга. Специфические меры профилактики не разработаны. Общие рекомендации по предотвращению кардиологических болезней включают отказ от курения и алкоголя, исключение гиподинамии, занятия спортом, соблюдение принципов здорового питания. При появлении первых признаков нарушений в работе сердца следует обратиться к врачу для обследования и лечения.
Источник
МОРГАНЬИ-АДАМСА-СТОКСА СИНДРОМ (G. В. Morgagni, итал. врач и анатом, 1682—1771; R. Adams, ирландский врач, 1791 — 1875; W. Stokes, ирландский врач, 1804—1878) — синдром, характеризующийся возникновением припадков, проявляющихся потерей сознания, бледностью, нарушением дыхания и судорогами, возникающих вследствие острой диффузной ишемии мозга при временной остановке сердца, значительном удлинении диастолы или резком снижении сердечного выброса.
Первое описание таких припадков принадлежит Дж. Морганьи (1761); более подробно они описаны Адамсом (1827) и Стоксом (1846).
Этиология и патогенез
Обычно М.—А.— С. с. наблюдается у больных с органическими (воспалительными или склеротическими) поражениями сердца. Причины развития синдрома стали известны при широком распространении электрокардиографических исследований. Чаще всего М.— А.— С. с. наблюдается при нарушениях предсердно-желудочковой проводимости (см. Блокада сердца). Причиной припадка при полной атриовентрикулярной блокаде может быть развитие так наз. блокады выхода импульса из желудочкового очага автоматизма, являющегося основным водителем ритма. При неполной блокаде выхода из этого водителя ритма в желудочки поступает каждый второй, каждый третий и т. д. из образующихся в очаге автоматизма импульсов, при полной блокаде поступление импульсов в желудочки прекращается и возникает асистолия желудочков. Обычно припадки возникают, когда частота сокращений желудочков становится меньше 20 в 1 мин. Припадки могут возникать при переходе неполной атриовентрикулярной блокады в полную, а также при развитии полной атриовентрикулярной блокады у больных с синусовым ритмом и наджелудочковыми аритмиями. В подобных случаях, особенно если полная блокада наступает внезапно, возникает так наз. предавтоматическая пауза, т. е. период асистолии между последним сокращением желудочков, вызванным проведенным из предсердий импульсом, и первым сокращением, вызванным импульсом из желудочкового очага автоматизма. К резкому снижению сердечного выброса, вызывающему припадок, иногда ведет и внезапное развитие неполной атриовентрикулярной блокады высокой степени (с проведением в желудочки каждого третьего, четвертого и т. д. импульса из предсердий) или внезапный переход неполной атриовентрикулярной блокады низкой степени в неполную блокаду более высокой степени. В очень редких случаях предавтоматическая пауза служит причиной припадка у больных с высокой степенью синоатриальной блокады или при прекращении импульсации из синусового узла, т. к. обычно при этом быстро появляются так наз. замещающие ритмы, исходящие из нижележащих автономных центров автоматизма.
Причиной припадков могут быть пароксизмы желудочковой тахикардии, трепетания желудочков (если частота сокращений превышает 250 в 1 мин.), а также транзиторная фибрилляция желудочков, развивающиеся на фоне как синусового ритма или суправентрикулярных тахиаритмий, так и атриовентрикулярной блокады высоких степеней (см. Аритмии сердца). Имеются наблюдения, что припадки могут возникать при трепетании предсердий с высокой атриовентрикулярной проводимостью, а также у больных с синдромом Вольффа — Паркинсона — Уайта и пароксизмами мерцания или трепетания предсердий. В последнем случае тахисистолия желудочков связана с проведением импульсов возбуждения из предсердий в желудочки в обход атриовентрикулярного соединения, по дополнительным проводящим путям (см. Вольффа — Паркинсона — Уайта синдром).
Клиническая картина
Припадок наступает внезапно: у больного возникает головокружение, темные круги перед глазами, он бледнеет и через несколько секунд теряет сознание. Примерно через полминуты начинаются генерализованные эпилептиформные судороги, нередко происходят непроизвольное мочеиспускание и дефекация. Спустя еще примерно полминуты прекращается дыхание (иногда этому предшествует аритмия дыхания) и появляется резкий цианоз. Во время припадка тоны сердца и пульс обычно не определяются, в отдельных случаях выявляются крайне редкие удары сердца. Если припадок вызван желудочковой тахикардией, тоны сердца резко учащены и глухи. АД не определяется. При затяжных припадках расширяются зрачки. С восстановлением пропульсивной деятельности сердца больной быстро приходит в сознание. Характерна ретроградная амнезия. Время появления отдельных симптомов непостоянно. Так, при выраженном атеросклерозе мозговых сосудов все они возникают быстрее. Появление тех или иных симптомов М.— А.— С. с. зависит от продолжительности припадка: если она не превышает 30 сек., судороги, цианоз, непроизвольное мочеиспускание и дефекация отсутствуют. При коротких периодах асистолии или фибрилляции желудочков припадки могут проявляться лишь головокружением, бледностью, потерей ориентировки или кратковременным помрачением сознания.
Диагноз
Диагноз ставят на основании анамнеза, типичных проявлений припадков, регистрации асистолии и других нарушений ритма.
Дифференциальный диагноз чаще всего проводится с эпилепсией (см.), реже с истерией (см.). При эпилепсии в отличие от М.— А.— С. с. имеется аура и прикусывание языка, отмечаются эпилептигенная биоэлектрическая активность на ЭЭГ, отсутствуют изменения на ЭКГ. Во время эпилептического припадка пульс напряжен и учащен, лицо багрово-синюшное; во время припадка при М.— А.— С. с. пульс не определяется или резко урежен, лицо вначале мертвенно-бледное, затем резко цианотичное.
Лечение
Лечебная тактика во время припадка такая же, как при остановке сердца. Поскольку обычно не удается сразу выяснить, вызван припадок асистолией или фибрилляцией желудочков (трепетанием желудочков, желудочковой тахикардией), попытки восстановить работу сердца начинают с резкого удара кулаком, занесенным над грудной клеткой больного на высоту примерно 20 см, по нижней трети грудины. При отсутствии эффекта немедленно начинают непрямой массаж сердца (см.), а после остановки дыхания — искусственное дыхание рот в рот (см. Искусственное дыхание). Эти мероприятия продолжают до окончания припадка или появления признаков биол, смерти. Если есть возможность зарегистрировать ЭКГ и выяснить, каким нарушением ритма сердца или проводимости вызван припадок, применяют более дифференцированное лечение: в случае асистолии внутрисердечно вводят 1 мл 0,1% р-ра адреналина или 1 мл 0,5% р-ра изопропилнорадреналина (изадрин); на фоне продолжающегося массажа сердца и искусственного дыхания осуществляют трансвенозную эндокардиальную стимуляцию сердца. Менее эффективна наружная электрокардиостимуляция (см. Кардиостимуляция). При фибрилляции, трепетании желудочков или желудочковой тахикардии производят электрическую дефибрилляцию (см.). Существует мнение, что при возможности леч. мероприятия вообще нужно начинать с электрической дефибрилляции, поскольку причиной внезапной смерти у кардиологических больных чаще всего является фибрилляция желудочков. Выжидательная тактика недопустима; несмотря на то, что обычно припадок проходит без лечения, никогда нельзя быть заранее уверенным, что он не закончится смертью.
Хирургическое лечение
М.— А.— С. с. при полной поперечной блокаде в связи с необратимыми органическими изменениями сердца является абсолютным показанием к хирургическому лечению. Тип и характер поперечной блокады сердца (полная или неполная, стойкая или перемежающаяся) при этом не играют роли.
Целью оперативного вмешательства является осуществление постоянной электрической стимуляции сердца с помощью полностью вживляемых в организм искусственных водителей сердечного ритма. Среди имплантируемых электрокардиостимуляторов (ЭКС) существуют приборы как с фиксированным, так и с меняющимся ритмом следования импульсов. Из последних наиболее известны деманд-стимуляторы, к-рые автоматически включаются при падении числа сердечных сокращений ниже 60 в 1 мин. Эти аппараты применяются в основном при лечении М.— А.— С. с. при перемежающейся блокаде сердца. При стойкой полной блокаде сердца используют электрокардиостимуляторы с фиксированным ритмом. Из отечественных аппаратов подобного рода наибольшее распространение получил имплантируемый аппарат ЭКС-2 (рассчитан на 2,5 года непрерывной работы). Создан ряд аппаратов ЭКС с источником тока, рассчитанным на более длительные сроки работы (см. Кардиостимуляция).
Имплантируемые электрокардиостимуляторы выпускаются чаще всего в нестерильном виде. Для подготовки к операции их моют в теплой воде с мылом и затем стерилизуют в течение 1 сут. в р-ре диоцида. Непосредственно перед операцией для удаления остатков диоцида аппарат тщательно промывают в стерильном физиол, р-ре. Аналогичным образом стерилизуют миокардиальные электроды. Автоклавирование имплантируемых электрокардиостимулятров не допускается.
Для операции имплантации электрокардиостимулятора применяют как внеплевральные, так и чресплевральные доступы к сердцу. Независимо от доступа операцию проводят под наркозом и при строгом электрокардиографическом контроле. Известны два вида внеплеврального доступа: 1) дугообразный разрез по левому краю грудины и затем параллельно левой реберной дуге с иссечением III, IV и V реберных хрящей и отслойкой плеврального мешка в латеральную сторону; 2) чрезбрюшинный доступ путем верхнесрединной лапаротомии и обнажения сердца через купол диафрагмы. Оба вне плевральных доступа не получили широкого распространения в клин, практике ввиду их травматичности и неудобства для хирургических манипуляций.
Большинство хирургов пользуются левосторонним чресплевральным доступом в пятое межреберье, поскольку он наиболее удобен для обнажения левого желудочка сердца. Миокардиальные концы электродов фиксируют в бессосудистой зоне левого желудочка, к-рая находится вблизи верхушки сердца латеральнее нисходящей ветви левой венечной артерии. Каждую клемму электродов пришивают двумя швами к миокарду, одновременно внедряя выступающий из клеммы конец проволочной спирали в толщу миокарда. Противоположные концы электродов соединяют с генератором импульсов, контролируя по ЭКГ появление искусственного (навязанного электрокардиостимулятором) сердечного ритма. Генератор импульсов располагают за пределами плевральной полости, для того чтобы облегчить его последующую замену. У мужчин аппарат обычно помещают во влагалище левой прямой мышцы живота, а у женщин — в левом ретромаммарном пространстве. Операцию заканчивают установлением обычного дренажа в плевральной полости и глухим ушиванием операционной раны.
Ведение больных в ближайшем послеоперационном периоде не отличается от ведения больных после других сердечных операций. В отдаленном послеоперационном периоде больной должен находиться под диспансерным наблюдением терапевта-кардиолога.
У больных преклонного возраста или страдающих тяжелыми сопутствующими заболеваниями постоянную электростимуляцию по поводу М.— А. — С. с. налаживают без обнажения сердца с помощью специального зонда-электрода. Операцию выполняют под местной анестезией, проводя зонд-электрод через правую наружную вену в полость правого желудочка сердца (эндокардиальная стимуляция). Генератор импульсов после соединения с зондом имплантируют под большую грудную мышцу. Т. о. удается избежать тяжелой внутригрудной операции. Однако при эндокардиальной стимуляции нередко нарушается контакт между электродным концом зонда и эндокардом, поэтому указанный способ коррекции сердечного ритма менее надежен, чем электростимуляция посредством миокардиальных электродов.
Прогноз и Профилактика
Прогноз зависит от причины припадка и его длительности. Если припадок длится более 4—5 мин., развиваются необратимые изменения в головном мозге. Длительные припадки заканчиваются обычно смертью. При очень частых припадках больной впадает в коматозное состояние, обычно также заканчивающееся смертью.
Профилактика припадков зависит от того, каким основным заболеванием, а также какими нарушениями ритма сердца или проводимости они вызваны. Когда причиной припадков являются приступы асистолии или резкого урежения ритма желудочков, необходима имплантация искусственного водителя ритма.
В период, предшествующий операции, проводят лечение атропином в дозах, достаточных для появления постоянной сухости во рту и мидриаза (см.). В начале лечения атропин вводят внутривенно (по 1 мл 0,1% р-ра в 10—20 мл изотонического р-ра хлорида натрия 2—4 раза в сутки), в дальнейшем переходят на прием препарата внутрь (по 8—20 капель 0,1% р-ра 3 раза в день). Улучшению предсердно-желудочковой проводимости или учащению идиовентрикулярного ритма может способствовать адреналин (1 мл 0,1% р-ра подкожно). Более эффективны изадрин и орципреналин (алупент): 1—2 мг изадрина или 10—20 мг орципреналина растворяют в 500 мл изотонического р-ра хлорида натрия или 5% р-ра глюкозы и вводят внутривенно со скоростью 10—30 капель в 1 мин. В дальнейшем назначают препараты изопропилнорадреналина под язык в форме таблеток, содержащих по 5 мг препарата. Лечение эфедрином, салуретиками (гипотиазид) и кортикостероидными гормонами, рекомендовавшееся ранее, малоэффективно. Если припадки вызваны приступами желудочковой тахикардии, трепетания или фибрилляции желудочков, пытаются подобрать лечение противоаритмическими средствами: хинидином (дробно до 2 г в сутки), новокаинамидом (до 4 г в сутки в 4—6 приемов), блокаторами бета-адренергических рецепторов (анаприлин, по 20—40 мг 4—6 раз в сутки), этмозином (до 100 мг в сутей в 4 приема), дифенином (до 600 мг в сутки в 1 прием), карбамазепином (до 800 мг в сутки в 1—2 приема) и др. Считают, что наиболее эффективно применение комбинаций, состоящих из противоаритмических препаратов, различных по механизму действия (напр., хинидин или новокаинамид в сочетании с блокаторами бета-адренергических рецепторов). Во всех случаях при возможности интенсивно проводится лечение основного заболевания (миокардит, коронарит и т. п.).
Библиография: Бредикис Ю.Ю. и Думчюс А. И. Эндокардиальная электростимуляция сердца, Вильнюс, 1979; Григоров С. С. и Власов Г. П. Применение имплантируемых электростимуляторов, управляемых желудочковым потенциалом, при атриовентрикулярной блокаде сердца, Кардиология, т. 10, № 11, с. 145, 1970; Дощицин В. Л. Блокады сердца, М., 1979, библиогр.; Литвин Ю. X. и Киселева Н. В. О применении электрической стимуляции сердца в комплексе реанимационных мероприятий у больного с полной поперечной блокадой, Сов. мед., № И, с. 143, 1973; Томов Л. и Томов Ил. Нарушения ритма сердца, пер. с болг., София, 1976; Чазов Е. И. и Боголюбов В. М. Нарушения ритма сердца, М., 1972, библиогр.; Adams R. Cases of diseases of the heart, accompanied with pathological observations, Dublin Hosp. Rep., v. 4, p. 353, 1827; Morgagni G. B. De sedibus, et causis morborum per anatom en indagatis libri quinque, v. 1—2, Venetiis, 1761; Stokes W. Observations on some cases of permanently slow pulse, Dublin quart. J. med. Sci., v. 2, p. 73, 1846.
В. А. Богословский; В. С. Савельев (кард. хир.).
Источник
