Миокард инфаркта при метаболического синдрома
В структуре кардиоваскулярных заболеваний инфаркт миокарда (ИМ) занимает особое положение, поскольку является ведущей причиной смертности и инвалидности при сердечнососудистых заболеваниях. В настоящее время проведен ряд исследований, продемонстрировавших высокую распространенность метаболического синдрома среди больных инфарктом миокарда, которая варьируется от 37% (Япония) до 50% (США, Франция). Важным явлением с точки зрения социальной значимости является высокая частота встречаемости метаболического синдрома у больных инфарктом миокарда моложе 45 лет. По некоторым данным, распространенность метаболического синдрома среди указанной категории пациентов достигает 66%. Приведенные данные свидетельствуют, что нарушение метаболизма глюкозы и сопутствующая инсулинорезистентность являются характерными состояниями для больных инфарктом миокарда и встречаются у каждого второго пациента.
Согласно литературным данным, показатель летальности в остром периоде инфаркта миокарда в группе больных с метаболическим синдромом в 2 раза выше, чем в группе больных, не имеющих достаточного для диагностики метаболического синдрома сочетания факторов риска. Выявлена большая частота развития сердечной недостаточности (Killip class > II) и кардиогенного шока. При анализе индивидуального влияния каждого из пяти компонентов метаболического синдрома на риск развития осложнений инфаркта миокарда установлено, что гипергликемия является независимым предиктором развития кардиогенного шока, а гипергликемия и низкие значения ХС ЛПВП — острой сердечной недостаточности.
При изучении влияния метаболического синдрома на прогноз инфаркта миокарда установлено, что присутствие метаболического синдрома достоверно увеличивает риск развития смертельного исхода в течение ближайших 3 лет на 29%, а кардиоваскулярных событий — на 23%. В случае наличия сахарного диабета данные показатели увеличиваются до 68% и 47% соответственно. Наличие метаболического синдрома увеличивает риск развития сахарного диабета в 2 раза, причем, с увеличением числа компонентов метаболического синдрома риск значительно возрастает — в сравнении с больными, имеющими 3 компонента метаболического синдрома, на 60% при наличии 4 компонентов и на 273% в случае присутствия 5 признаков метаболического синдрома. Именно со значительно возрастающим риском развития сахарного диабета при наличии метаболического синдрома некоторые авторы связывают увеличение риска сердечной смерти и кардиоваскулярных событий в отдаленном периоде инфаркта миокарда.
Использование различных методов оценки степени миокардиального повреждения при инфаркте миокарда позволило установить, что присутствие метаболического синдрома ассоциировано с увеличением размера инфаркта миокарда и сопровождается закономерным уменьшением значений фракции выброса левого желудочка. Причины и механизмы, лежащие в основе предрасположенности больных инфарктом миокарда с метаболическим синдромом к более масштабному миокардиальному повреждению, недостаточно изучены, но очевидно, что основой этих процессов является комплекс сцепленных на патобиохимическом и патофизиологическом уровне метаболических, гормональных и клинических нарушений, характерных для метаболического синдрома.
Накапливаются данные, позволяющие утверждать о влиянии метаболического синдрома на эффективность реваскуляризации при инфаркте миокарда. Выявлено некоторое снижение эффективности тромболитической терапии и ангиопластики, более частое развитие рестеноза коронарных артерий после стентирования.
Обследовано 96 больных инфарктом миокарда с зубцом Q. Средний возраст пациентов составил 55,75 ± 0,89. Распределение больных по полу было следующим: 19,79% (n = 19) составили женщины, 80,21% (n = 77) — мужчины. СД 2-го типа в анамнезе присутствовал у 14,58% обследованных лиц (n = 14). Диагностика метаболического синдрома осуществлялась с использованием критериев, предложенных Международной диабетической ассоциацией (2005 г.). Исследуемую группу составили 62 больных инфарктом миокарда с метаболическим синдромом, пациенты с инфарктом миокарда, не имеющие необходимого для диагностики метаболического синдрома сочетания факторов риска (n = 34), составили группу сравнения.
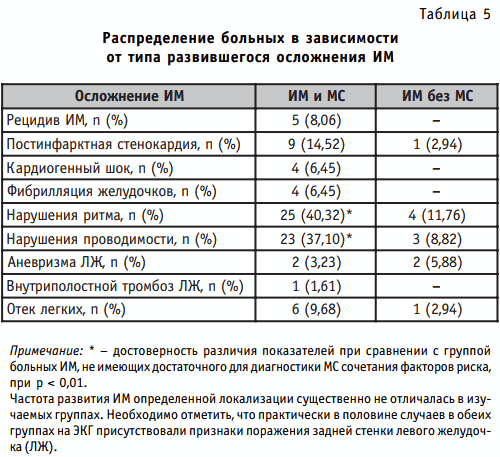
Произведен анализ характера и частоты развития осложнений в остром периоде инфаркта миокарда в исследуемых группах. В группе больных инфарктом миокарда с метаболическим синдромом доля лиц, имеющих осложненное течение инфаркта миокарда, составила 67,74% (n = 42), в группе сравнения — 26,47% (n = 9) (р < 0,001). Распределение больных в изучаемых группах в зависимости от типа развившегося осложнения инфаркта миокарда представлено в табл. 5.

Анализ данных липидограммы позволяет утверждать, что инфаркт миокарда у больных с метаболическим синдромом протекает на фоне прогностически неблагоприятных показателей липидного спектра крови (гипертриглицеролемия, повышение фракции холестерола липопротеидов очень низкой плотности (ХС ЛПОНП), снижение фракции холестерола липопротеидов высокой плотности (ХС ЛПВП)). При проведении корреляционного анализа установлено, что снижение уровня сывороточного ХС ЛПВП сопровождается повышением уровня высокочувствительного С-реактивного белка (СРБ) (r = -0,54; р < 0,05).
Особенности углеводного обмена в группе больных инфарктом миокарда с метаболическим синдромом характеризовались более высокими значениями уровней глюкозы при поступлении в стационар и уровней гликированного гемоглобина (HbA1с). При последующем анализе взаимосвязи показателей лабораторных и инструментальных методов исследования установлено наличие прямой корреляционной взаимосвязи между значениями гликемии при поступлении в стационар и размером левого предсердия по данным эхокардиографического исследования (r = -0,62; р < 0,05); между уровнем гликированного гемоглобина и значениями высокочувствительного С-реактивного белка (r = -0,49; р < 0,05).
В присутствии метаболического синдрома отмечено увеличение содержания Д-димеров и фибриногена плазмы крови. Средние значения Д-димеров составили 0,41 ± 0,09 мкг/мл, в группе сравнения — 0,10 ± 0,01 мкг/мл (р < 0,001). Дальнейший анализ взаимосвязи показателей инструментальных и лабораторных методов исследования продемонстрировал наличие значительной прямой корреляционной связи между значениями фибриногена плазмы крови и размером левого предсердия по данным эхокардиографического исследования (r = 0,74; р < 0,05); средней силы обратной взаимосвязи между значениями фракции выброса левого желудочка (ФВ ЛЖ) и значениями Д-димеров плазмы крови в остром периоде инфаркта миокарда (r = 0,56; р < 0,05).
При оценке скорости клубочковой фильтрации и уровня сывороточного креатинина в исследуемых группах установлено, что инфаркт миокарда при наличии метаболического синдрома протекает на фоне более значительного снижения функции почек. Средние значения уровня мочевины и креатинина в группе больных инфарктом миокарда с метаболическим синдромом составили 9,14 ± 0,65 ммоль/л и 141,78 ± 14,76 мкмоль/л, в группе сравнения -6,54 ± 0,32 и 90,85 ± 3,07 соответственно (р < 0,05).
Структурные и гемодинамические параметры сердца исследовали методом эхокардиографии в трех режимах: М-, В-модальном и цветном доплеровском на аппарате Hewlett-Packard-2000 (США). Исследование проводилось по стандартной методике с использованием ультразвукового датчика с частотой сканирования 3,5 МГц. Полученные среднегрупповые показатели фракции выброса левого желудочка (%) в группе больных инфарктом миокарда с метаболическим синдромом и в группе сравнения составили 51,53 ± 1,42 и 60,27 ± 1,75 соответственно (р < 0,001), размера левого предсердия — 4,10 ± 0,06 и 3,84 ± 0,07 (р < 0,05).
При сравнительном анализе результатов эхокардиографического исследования выявлено преобладание в структуре ремоделирования левого желудочка в группе больных инфарктом миокарда с метаболическим синдромом эксцентрической гипертрофии миокарда.
Анализ данных, полученных в ходе проведения мультиспиральной компьютерной томографии со скринингом коронарного кальция, показал, что показатели кальциевого индекса в бассейне правой коронарной артерии, рассчитанные по стандартной методике AJ-130 и Volume 130, в группе больных с метаболическим синдромом имеют достоверно более высокие значения при сравнении с контрольной группой — 257,57 ± 70,91, 227,60 ± 58,46 и 38,42 ± 14,88, 37,92 ± 16,89 соответственно. Необходимо отметить, что у больных инфарктом миокарда установлена средней силы прямая корреляционная связь между значениями кальциевого индекса (Agatston и Volume-130) и плазменными значениями Д-димеров плазмы крови в остром периоде заболевания (r = 0,57; р < 0,05).
Заключение
- Исследование особенностей течения инфаркта миокарда у больных с метаболическим синдромом позволяет сделать заключение о большей склонности данной категории больных к развитию осложнений в остром периоде заболевания. Так, в исследуемой группе доля лиц, имеющих осложненное течение инфаркта миокарда, составила 67,74% (n = 42), в группе сравнения — 26,47% (n = 9) (р < 0,001). Выявлено статистически значимое более частое развитие нарушений ритма и проводимости, тенденция к рецидивирующему течению, развитию постинфарктной стенокардии, фибрилляции желудочков и кардиогенного шока.
- Инфаркт миокарда у больных с метаболическим синдромом протекает на фоне прогностически неблагоприятных показателей липидного спектра крови и сопровождается более выраженными коагуляционными, провоспалительными изменениями, чаще — нарушениями углеводного обмена.
- У больных с метаболическим синдромом течение инфаркта миокарда характеризуется более значительным снижением функции почек, что находит свое отражение в более низких значениях скорости клубочковой фильтрации, рассчитанной по уровню сывороточного креатинина.
- Результаты инструментальных методов исследования свидетельствуют о кумуляции в группе больных инфарктом миокарда с метаболическим синдромом прогностически неблагоприятных характеристик (более низкие среднегрупповые значения фракции выброса левого желудочка, увеличение размеров левого предсердия по данным эхокардиографического исследования, показатели кальциевого индекса по результатам мультиспиральной компьютерной томографии со скринингом коронарного кальция), которые дают основание утверждать о склонности данной категории больных к худшему прогнозу и высокому риску неблагоприятных исходов ИБС и предъявляют повышенные требования к выполнению лечебных и диагностических протоколов у данной категории пациентов.
Таким образом, присутствие метаболического синдрома сопровождается более ранним развитием атеросклеротического поражения коронарных артерий, обусловливает развитие неблагоприятных маркеров структурно-функционального состояния сердечно-сосудистой системы у женщин с ишемической депрессией сегмента ST и предполагает высокий риск осложнений инфаркта миокарда.
________________
Вы читаете тему:
Метаболический синдром: ранняя диагностика ишемической болезни сердца, особенности безболевой ишемии и инфаркта миокарда (Митьковская Н. П., Григоренко Е. А., Патеюк И. В., Статкевич Т. В. Белорусский государственный медицинский университет. «Медицинская панорама» № 9, октябрь 2009)
- Понятие о метаболическом синдроме и его критерии.
- Раннее выявление коронарного атеросклероза у лиц с метаболическим синдромом.
- Состояние сердечно-сосудистой системы у женщин с депрессией ST и метаболическим синдромом.
- Инфаркт миокарда при метаболическом синдроме.
Источник
— Ишемическая
болезнь сердца (стенокардия, инфаркт
миокарда, атеросклеротический
кардиосклероз и синдром внезапной
сердечной смерти)
-Ишемическая
болезнь мозга – инсульт
— Ишемическая
болезнь конечностей ( облитерирующий
атеросклероз нижних конечностей, который
может привести к гангрене конечности,
синдром Лериша – тромбоз подвздошных
артерий)
— Ишемическая
болезнь кишечника (синдром абдоминальных
болей – «брюшная жаба», инфаркт кишечника)
— Атеросклероз
почечных артерий, который приводит к
первично сморщенной почке и далее к
ХПН.
Атриовентрикулярный (узловой) ритм
Наблюдается в тех
случаях, когда импульсы в синусовом
узле не возникают или генерируются с
меньшей частотой, чем в клетках
атриовентрикулярного соединения.
Частота импульсов составляет 30-60 уд. в.
мин.. Источником импульса может стать
любая часть атриовентрикулярного
соединения. Чем выше расположен пейсмекер,
тем выше частота импульсов. Возможны
следующие варианты:
с одновременным
возбуждением предсердий и желудочковвозбуждение
желудочков предшествует возбуждению
предсердий.
Сердечная недостаточность. Коронарная недостаточность. Ишемическая болезнь сердца. Инфаркт миокарда.
Кровообращение –
один из важнейших физиологических
процессов, поддерживающих гомеостаз и
обеспечивающих непрерывную доставку
всем органам и тканям организма
необходимых для жизни питательных
веществ и кислорода и т.д.
Центральным
органом этой системы является сердце.
Миокард представлен возбудимой тканью
из клеток 2-х видов: проводящей системы
и сократительного миокарда, обладающих
рядом функций – автоматизм, проводимость,
возбудимость, сократимость, тоничность,
рефрактерность и аберрантность.
Благодаря этим
свойствам и реализуется основная функция
сердца – насосная, нарушение которой
приводит к развитию сердечной
недостаточности – состоянию,
характеризующимся неспособностью
сердца
выполнять насосную функцию вследствие
существенного снижения сократительной
способности
миокарда, а также поражения клапанов
сердца или пороков развития системы
кровообращения.
К
основным причинам развития сердечной
недостаточности
относятся: 1) первичное поражение
миокарда, приводящее к нарушению его
сократимости.
Возникает при ИБС (постинфарктный
и атеросклеротический кардиосклероз),
дилатационной
кардиомиопатии, миокардитах,
миокардиодистрофиях;
2) перегрузка давлением в
фазу систолы.
Это нарушение характеризуется
увеличением работы сердца (например,
при артериальной
гипертензии или аортальном стенозе;
3) перегрузка объемом в фазу диастолы,
сопровождающаяся увеличением работы
сердца при аортальной или митральной
недостаточности,
дефекте межжелудочковой перегородки;
4) снижение
наполнения желудочков
(преимущественно
диастолическая недостаточность).
1.Миокардиальную
– обусловленную повреждением
кардиомиоцитов токсическими, инфекционными,
иммунными либо ишемическим факторами.
А) Гипоксический
некроз миокарда,
Б) Электролитно-стероидная
кардиопатия с некрозом.
В) Иммунные
повреждения сердца
Г)Токсические
повреждения
А) ИБС
Б) Инфаркт миокарда
2.Перегрузочную –
возникающую при перегрузке объёмом или
повышением давления крови.
3.Смешанную –
представляющую собой комбинацию
предыдущих.
По
преимущественному поражению
камер сердца
сердечная недостаточность делится
—
на
левожелудочковую,
— правожелудочковую,
—
тотальную,
— острой (ОСН)
—
хронической
(ХСН).
Левожелудочковая
недостаточность встречается
значительно чаще правожелудочковой.
Это связано
с тем, что различные патологические
состояния
чаще приводят к перегрузке левого
желудочка. При острой левожелудочковой
недостаточности
такими состояниями могут быть артериальная
гипертензия (прежде всего гипертонический
криз), инфаркт миокарда и обратимая
ишемия
левого желудочка, отрыв папиллярной
мышцы
с пролапсом митрального клапана и др.
Хроническая
левожелудочковая недостаточность
(ХЛЖН)-
это медленно формирующееся патологическое
состояние, при котором нагрузка
на левый желудочек превышает его
способность
совершать работу. ХЛЖН осложняет течение
только хронических
заболеваний сердца и сосудов.
Правожелудочковая
недостаточность характеризуется
развитием застойных явлений в большом
круге кровообращения. При этом
увеличивается
кровенаполнение печени и, соответственно,
ее размеры, нарушается экскреторная
функция почек, происходит задержка
воды в организме,
и появляются периферические отеки.
Различают
острую
и хроническую правожелудочковую
недостаточность. Наиболее
частой причиной
острой правожелудочковой недостаточности
является распространение крупноочагового
инфаркта
левого желудочка на правые отделы
сердца,
реже — изолированный некроз миокарда
правого
желудочка. Очень часто причиной
правожелудочковой
недостаточности является легочная
гипертензия, которая также может
развиваться
остро и хронически.
К
весьма распространенным проявлениям
перегрузки
правого желудочка относятся легочное
сердце и эмболия легочной артерии.
Понятие
«легочное
сердце» включает
в себя легочную
гипертензию, гипертрофию правого
желудочка,
его дилатацию и сердечную недостаточность.
Так,
длительное повышение
АД в легочных сосудах обычно приводит
к гипертрофии правого желудочка с
последующим
развитием сердечной недостаточности
по большому кругу.
Если легочная
гипертензия быстро прогрессирует,
то гипертрофия правого
желудочка не успевает развиться и
дилатация
непосредственно переходит в
правожелудочковую
недостаточность. Такая ситуация может
иметь
место и при тромбоэмболии легочной
артерии,
пневмотораксе, астматическом статусе
и распространенной
пневмонии, когда АД в малом круге
повышается в
течение
нескольких суток
или
даже часов.
Синдром
эмболии легочной артерии — это
патологическое
состояние, которое развивается
при попадании эмболов в русло легочной
артерии
и характеризуется болями в грудной
клетке,
одышкой, цианозом с одновременным
появлением
тахикардии и признаков коллапса.
Эмболия
легочной артерии особенно опасна тем,
что может вызвать рефлекторную остановку
сердца и внезапную смерть больного.
Наиболее
часто эмболия легочной артерии вызывается
тромбами, мигрирующими из венозной
системы и правых отделов сердца или из
«левого
сердца» при наличии дефектов
межжелудочковой
и межпредсердной перегородок. Наряду
с этим причиной эмболии артерий малого
круга
кровообращения могут стать пузырьки
воздуха
или капли жира, попавшие в венозную
систему
при нарушении процедуры внутривенной
инфузии или при травмах трубчатых
костей.
По
течению хроническая сердечная
недостаточность
делится на три стадии. Первая
стадия —
начальная. На этом этапе общие симптомы
ХСН (одышка,
тахикардия) появляются только во время
физической нагрузки. Местные симптомы
(цианоз) обычно отсутствуют. Во
второй стадии
появляются
не только общие, но и местные симптомы.
Помимо одышки и тахикардии при физической
нагрузке появляются цианоз, признаки
декомпенсации функционального состояния
внутренних органов, асцит и анасарка.
Третья
стадия —
конечная, дистрофическая. В этот период
развивается тотальная застойная
недостаточность,
затрагивающая большой и малый круг
кровообращения. Формируется почечная,
печеночная
и легочная недостаточность. Третья
стадия
является терминальной стадией ХСН.
Здоровый
организм обладает многообразными
механизмами, обеспечивающими своевременную
разгрузку сосудистого русла от избытка
жидкости.
К этим механизмам относятся: активация
выделительной функции почек, депонирование
крови в печени и селезенке, потоотделение,
испарение воды со стенок легочных
альвеол,
компенсаторное изменение артериального
давления,
насосной функции сердца и др.
Механизмы
компенсации гемодинамических
нарушений при острой
сердечной недостаточности
На
начальной стадии систолической
дисфункции
желудочков сердца включаются
интракардиальные факторы компенсации
сердечной недостаточности,
важнейшим из которых является
механизм Франка — Старлинга. Реализацию
его можно представить следующим образом.
Нарушение
сократительной функции сердца влечет
за собой уменьшение ударного объема
крови и
гипоперфузию почек.
Это способствует
активации
ренин-ангиотензин-альдостероновой
системы,
вызывающей задержку воды в организме
и
увеличение объема циркулирующей крови.
В условиях возникшей гиперволемии
происходит усиленный
приток венозной крови к сердцу, увеличение
диастолического кровенаполнения
желудочков,
растяжение миофибрилл миокарда и
компенсаторное повышение силы сокращения
сердечной
мышцы, которое обеспечивает прирост
ударного
объема.
Однако, если конечное диастолическое
давление повышается более чем на 18-20 мм
рт. ст., возникает чрезмерное перерастяжение
миофибрилл. В
этом
случае компенсаторный
механизм Франка — Старлинга перестает
действовать,
а дальнейшее увеличение конечного
диастолического
объема или давления вызывает
уже не подъем, а снижение УО.
Наряду
с внутрисердечными механизмами
компенсации
при острой левожелудочковой недостаточности
запускаются разгрузочные экстракардиалъные
рефлексы, способствующие возникновению
тахикардии и увеличению минутного
объема крови (МОК). Одним из наиболее
важных
сердечно-сосудистых рефлексов,
обеспечивающих
увеличение МОК, является рефлекс
Бейнбриджа
— увеличение частоты сердечных сокращений
в ответ на увеличение объема циркулирующей
крови.
Этот рефлекс реализуется при
раздражении механорецепторов,
локализованных
в устье полых и легочных вен. Данные
механорецепторы
являются афферентными окончаниями
вагуса, и их раздражение передается на
центральные симпатические ядра
продолговатого
мозга, в результате чего происходит
повышение тонической активности
симпатического
звена вегетативной нервной системы и
развивается
рефлекторная тахикардия.
Рефлекс Бейнбриджа
направлен на увеличение минутного
объема
крови.
Синдром слабости синусного узла
Синдром слабости
(дисфункции) синусного узла – клинический
синдром, обусловленный снижением или
прекращением автоматизма синусного
узла (не нарушением регуляции его
деятельности), проявляющийся преимущественно
выраженной синусовой брадикардией и
обычно предсердными тахиаритмиями,
приводящий к ишемии органов.
Дисфункция синусного
узла может быть стойкой или преходящей.
Синдром в некоторых случаях связан с
ишемией в области синусного узла, которая
нередко возникает при: инфаркте
заднедиафрагмальной стенки как преходящее
или стойкое осложнение,
при кардиосклерозе
(атеросклеротическом, постмиокардитическом,
особенно после дифтерии, иногда через
много лет),миокардите,
кардиомиопатиях.
у пожилых,
обусловлен, нарастающими дегенеративными
изменениями в области синусного узла.
В подобных случаях синдром слабости
синусного узла может быть единственным,
изолированным проявлением поражения
сердца. Процесс, обусловивший дисфункцию
синусного узла, иногда распространяется
на предсердия и другие отрезки проводящей
системы, приводя дополнительно к
снижению автоматизма и проводимости
на разных уровнях.
Синдром слабости
синусного узла отражает снижение
собственного автоматизма синусного
узла, непосредственно затронутого
патологическим процессом. В этот синдром
не включаются изменения ритма вследствие
регуляторных (вегетативных, метаболических)
и лекарственных воздействий на синусный
узел. Наиболее постоянное, хотя и
неспецифическое, проявление синдрома
слабости синусного узла – брадикардия,
недостаточное учащение при нагрузке,
после приема атропина, изопротеренола.
Чередование брадикардии с приступами
тахисистолических аритмий и указанные
выше жалобы позволяют заподозрить этот
синдром.
Специфические
электрокардиографические признаки
синдрома отсутствуют, и диагноз, как
правило, не может быть поставлен по
единственной ЭКГ. При повторных
исследованиях или мониторировании ЭКГ
выявляют внезапное исчезновение
синусового ритма и замена его на короткое
время различными аритмиями, которые
чередуются: Специфическим признаком
для синдрома является увеличение до
11/2
с и более непосредственно после тахикардии
первой диастолической паузы.
Замедление и
блокада проведения импульса возбуждения
является следствием функциональных
или органических изменений в проводящей
системе сердца. Возникают в основном
при:
повышении
парасимпатических влияний на сердце
и его холинреактивных свойств. Активация
блуждающего нерва на миокард обуславливает
заметное снижение скорости пробега
волны возбуждения по проводящей системе,
особенно атриовентрикулярного соединения
— отрицательный
дромотропный эффект ацетилхолина.Повреждение клеток
проводящей системы факторами физического,
химического или биологического
характера.Основные виды
локализации блокад проведения
возбуждения:
Синоатриальные
блокады.Внутрипредсердные
блокады.Атриовентрикулярные
и внутрижелудочковые блокады.
Чаще всего
встречаются атриовентрикулярные
блокады.
Источник
