Миелодисплазия код в мкб

Связанные заболевания и их лечение
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Причины
- Прогноз
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Миелодиспластический синдром.
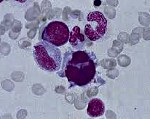
Миелодиспластический синдром
Описание
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. Населения в год и увеличивается с возрастом.
Симптомы
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией.
Одышка. Тромбоцитоз. Увеличение лимфоузлов.
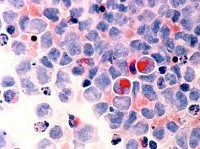
Миелодиспластический синдром
Диагностика
Диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика
Необходимо дифференцировать МДС от железа или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Причины
Первичный (идиоптический) тип — 80-90 % случаев, вторичный(вследствие предшествующей химиотерапии и факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы, топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и ), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
Факторы риска, первичный МДС:
• Контакт с токсинами (бензин, органические растворители, пестициды).
• Радиация.
• Курение.
• Врожденные и наследственные заболевания.
• Пожилой возраст.
Факторы риска, вторичный МДС:
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз ~30 % случаев.
Лечение
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»).
Выбор терапевтической тактики во многом определятся возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС:
• Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных часто получающих гемотрансфузии развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо — хелаторы (десферал, эксиджад).
• Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q- синдромом. Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии.
• Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом.
Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
• Химиотерапия.
• Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии.
Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся. Bowen D считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац. ), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС. Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остается актуальной.
• Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ. Пятилетняя выживаемость составляет около 18 %.
• Гипометилирующие препараты.
Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
- Описание
- Причины
- Симптомы (признаки)
- Диагностика
- Лечение
Краткое описание
Миелодиспластический синдром (МДС) — группа патологических состояний, характеризующихся нарушением гемопоэза во всех ростках, проявляющемся панцитопенией. МДС часто трансформируется в острый лейкоз или апластическую анемию. Частота. Увеличение заболеваемости (1–2 на 100 000) в последние годы может быть связано с более точной диагностикой. Преобладающий возраст — старше 65 лет.
Код по международной классификации болезней МКБ-10:
- D46 Миелодиспластические синдромы
Генетика. При миелолейкозе наблюдают межгенный сплайсинг генов MDS1 и AML1 (*600049, Â). Клинически: синдром миелодисплазии. Лабораторно: ассоциация с транслокацией хромосом t(3; 21)(q26; q22).
Причины
Факторы риска • Эндогенные: хромосомные и генетические нарушения • Экзогенные: длительный контакт с продуктами органической химии, радиация, инсоляция, применение некоторых ЛС (например, хлорамфеникол, цитостатики).
Морфологическая классификация • Рефрактерная анемия — <5% бластов в костном мозге, <1% бластов в крови Синоним: приобретённая идиопатическая сидеробластная анемия • Рефрактерная анемия с избытком бластов — 5–20% бластов в костном мозге, <5% бластов в крови • Рефрактерная анемия с избытком трансформирующихся бластов — или 20–30% бластов в костном мозге, или >5% бластов в крови, или наличие палочек Ауэра (палочковидные цитоплазматические красного цвета [при окраске по Лейшману] включения в моноцитах, миелоцитах и миелобластах) • Хронический миеломоноцитарный лейкоз — 1–20% бластов в костном мозге, <5% бластов в крови, моноцитоз >1´109/л
Симптомы (признаки)
Клиническая картина • Интоксикация — субфебрильная температура тела, усиленное потоотделение, слабость, вялость, понижение аппетита, снижение массы тела • Анемия — бледность кожных покровов и видимых слизистых оболочек, нарушение микроциркуляции • Геморрагический синдром — экхимозно — петехиальная сыпь, кровотечения из слизистых оболочек • Спленомегалия, гепатомегалия (редко) • Кожные инфильтраты • Инфекционные осложнения вследствие лейкопении.
Диагностика
Лабораторные исследования • Периферическая кровь — анемия макроцитарная, возможны ретикулоцитоз, гранулоцитопения (гипогранулярные или агранулярные нейтрофилы со слабо конденсированным хроматином), тромбоцитопения • Биохимический анализ крови — увеличение уровня HbF до 70% • Прямой антиглобулиновый тест Кумбса положителен в некоторых случаях • Миелограмма — незначительное увеличение содержания бластов, гипоплазия эритроидного и миелоидного ростков, ретикулярный фиброз выражен слабо, аномальная локализация незрелых предшественников. Содержание мегакариоцитов снижено. Количество клеток красного костного мозга обычно нормально, у 10% возможно выявление гипоплазии.
Специальные исследования • Цитогенетические • Тест определения функций гранулоцитов — снижение миелопероксидазной активности, фагоцитоза, хемотаксиса и адгезии • Тест определения функций тромбоцитов — нарушение агрегации, адгезии • Иммунофенотипирование — используют неспецифические миелоидные маркёры • Рентгенография органов грудной клетки • УЗИ — увеличение печени и селезёнки • Гепатосцинтиграфия.
Лечение
ЛЕЧЕНИЕ
Режим • Амбулаторный • Показания к стационарному лечению •• Тяжёлое состояние больного, истощение •• Геморрагический синдром •• Присоединение инфекционных осложнений •• Панцитопения, требующая заместительных гемотрансфузий.
Лекарственная терапия — симптоматическая • Антибактериальная терапия (предпочтительнее антибиотики широкого спектра действия), противогрибковые, антивирусные препараты • Гемостатики, ангиопротекторы (например, аминокапроновая кислота, этамзилат) • Общеукрепляющая, дезинтоксикационная терапия (р — р глюкозы, препараты калия, витамины, трифосаденин, кокарбоксилаза, инозин) • Биопрепараты при выраженной лейкопении (например, эшерихия коли, бифидобактерии бифидум) • Трансфузионная терапия по показаниям — см. Анемии апластические (переливания отмытой эритроцитарной массы, тромбоцитарной взвеси) • Даназол или преднизолон — при сопутствующей аутоиммунной тромбоцитопении.
Трансплантация костного мозга показана больным моложе 35 лет.
Ведение больного. Наблюдение 1 р/мес в перерывах между курсами поддерживающей терапии. Необходим контроль периферической крови, миелограммы (для исключения трансформации МДС в острый лейкоз или аплазию).
Прогноз • Средняя продолжительность жизни для больных с рефрактерной анемией, рефрактерной анемией с кольцевыми сидеробластами составляет 5 лет • Средняя продолжительность жизни больных с рефрактерной анемией с избытком бластов, рефрактерной анемией с избытком трансформирующихся бластов и хронической миеломоноцитарной анемией составляет 1 год • Отягощают течение и ухудшают прогноз геморрагический синдром, генерализованные инфекции.
Синонимы • Гемопоэтическая дисплазия • Прелейкоз
Сокращение. МДС — миелодиспластический синдром
МКБ-10 • D46 Миелодиспластические синдромы
Лекарственные средства и Медицинские препараты применяемы для лечения и/или профилактики «Синдром миелодиспластический».
Источник

Многие годы безуспешно боретесь с БОЛЯМИ в СУСТАВАХ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить суставы принимая каждый день средство за 147 рублей…
Читать далее »
Если у женщины обнаружен постменопаузальный остеопороз, лечение нужно начинать без промедления. Этот недуг не представляет угрозы для жизни пациентки. Но если не принять неотложных мер, то могут возникнуть серьезные проблемы со здоровьем, вплоть до ограничения возможности передвигаться.
Остеопороз представляет собой заболевание, которое характеризуется уменьшением костной массы и нарушением структуры ткани, из которой она состоит. Болезнь приводит к ломкости и хрупкости костей. У многих женщин она начинает развиваться после менопаузы, наступившей естественным путем или вызванной операцией.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения суставов наши читатели успешно используют Артрейд. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…

Причины возникновения заболевания
Согласно последнему мировому пересмотру классификации болезней, код по МКБ–10 этого недуга M81.0, что означает «Постменопаузный остеопороз». По частоте диагностирования остеопороз уступает только болезням сердца, легких и онкологии. Им болеет не менее трети населения планеты в возрасте старше пятидесяти лет.
Возникновение заболевания могут спровоцировать такие факторы:
- Уменьшение выработки женских половых гормонов, благодаря которым происходит обновление и восстановление костной ткани. Женские гормоны отвечают за удержание кальция, необходимого для придания костям достаточной прочности.
- Ведение малоподвижного образа жизни. Из-за этого ухудшается обмен веществ, снижается плотность костной ткани как реакция на отсутствие физических нагрузок. Аналогичный результат наблюдается у больных, которые долгое время были прикованы к постели.
- Нерациональное питание. Нередко женщины в большом количестве употребляют полуфабрикаты и консервы, в которых практически отсутствуют нужные для организма вещества, витамины, минералы и белки.
- Плохо продуманная диета, вызвавшая снижение веса. От этого давление на опорно-двигательный аппарат слабеет, в итоге костная ткань истончается, становится хрупкой и непрочной.
- Генетическая предрасположенность. В результате медицинских наблюдений установлено, что остеопороз передается по наследству. Им могут страдать несколько поколений родственников по женской линии.
- Продолжительное лечение болезней почек, сопровождающееся приемом глюкокортикоидов. Эти препараты вытесняют и подавляют деятельность женских половых гормонов.
- Преждевременное наступление менопаузы. После этого события начинается постепенное отторжение эндометрия — слоя клеток, образующих внутренний слой слизистой оболочки матки.
- Злоупотребление курением, алкоголем, крепким кофе и чаем. Эти напитки оказывают негативное влияние на обменные процессы в костной ткани.
- Переломы, которые случались ранее. Последствия могут проявиться через несколько десятков лет после травмы. Остеопороз является одним из осложнений переломов.
- Рождение 3 и более детей, длительный период лактации. Во время процессов беременности и кормления грудью из организма женщины активно удаляются фосфор и кальций.

В группу риска входят спортсменки, престарелые дамы и представительницы европеоидной расы.
Симптомы постменопаузального остеопороза
Это заболевание не характеризуется ярко выраженным проявлением и скоростью развития. Недуг прогрессирует постепенно, заявляя о себе все новыми скудными и едва заметными симптомами.
О появлении постменопаузного остеопороза могут свидетельствовать такие признаки:
-
 Постоянная ноющая боль в позвоночнике. Она концентрируется в районе поясницы, усиливаясь после продолжительных физических нагрузок, поднятия тяжестей, прогулок и пробежек.
Постоянная ноющая боль в позвоночнике. Она концентрируется в районе поясницы, усиливаясь после продолжительных физических нагрузок, поднятия тяжестей, прогулок и пробежек. - Неприятная тяжесть в спине в районе лопаток. Постепенно этот синдром усиливается, распространяясь на весь позвоночник, включая поясничный отдел. Со временем тяжесть распространяется на верхние и нижние конечности.
- Искривление позвоночника, приводящее к нарушению осанки. Сокращение высоты позвонков и сжимание костей приводит к уменьшению роста. В особо тяжелых случаях этот показатель может составлять 2–3 см в год.
- Переломы лодыжек, берцовых и лучевых костей, компрессионные переломы позвоночника. Подобная патология возникает при падении, нагрузке или поднятии тяжестей.

Иногда переломы происходят без какого-либо механического воздействия извне. Это свидетельство того, что костная ткань опорно-двигательного аппарата дошла до состояния крайнего истощения.
Диагностика постменопаузального остеопороза
Поскольку первичные симптомы остеопороза свойственны многим заболеваниям опорно-двигательного аппарата, то для постановки точного диагноза необходима комплексная диагностика. Без этого невозможно назначить действенный курс лечения.
Обследование больного проводится в условиях клиники следующими методами:
- Первичный осмотр у специалиста. С помощью ряда наводящих вопросов врач выясняет возможную причину заболевания, его симптомы и продолжительность. Телесный осмотр позволяет выявить степень патологии опорно-двигательного аппарата визуально.
- Проведение костной денситометрии. Этот метод позволяет определить минеральную плотность костной ткани. По полученным показателям выясняется наличие и степень заболевания.
- Ультразвуковая денситометрия. Это эффективный способ диагностики остеопороза, основанный на показаниях прибора, которые отличаются достаточной точностью.
- Анализ крови на наличие кальция и кальцитонина. Результаты дают представление об объеме полезных веществ, которые вымываются из костной ткани.
- Анализ мочи, по результатам которого определяется процент гидроксипролина, коллагена I типа и сывороточного остеокальцина.

Рентгенография помогает получить картину болезни только в тех случаях, когда потеря костной массы составляет более трети от первоначальной.
Помимо выявления самого остеопороза, пациентке назначается прохождение дифференциальной диагностики. Она необходима для того, чтобы определить причины возникновения заболевания и факторы, которые могут помешать его эффективному лечению. После прохождения консультаций у профильных специалистов женщине назначается курс медикаментов, даются рекомендации по диете и ЛФК.
Лечение постменопаузального остеопороза
Основными целями лечения заболевания являются блокада процессов резорбции костной ткани и активация процессов ремоделирования (формирования) кости.
Чтобы достичь успешного результата, больная должна выполнить такие условия:
-
 по мере возможности избавиться от сопутствующих болезней;
по мере возможности избавиться от сопутствующих болезней; - отказаться от вредных привычек;
- нормализовать рацион, сделав его разнообразным и калорийным;
- вести активный образ жизни, избегая длительного пребывания в неподвижном положении;
- избегать сильных нагрузок на опорно-двигательный аппарат, тряски, ударов и падений.
Пациентка должна выполнять все рекомендации специалистов. Самолечение противопоказано.
Основой лечения постменопаузального остеопороза является системная заместительная гормональная терапия.
В зависимости от возраста, степени поражения костной ткани и особенностей организма пациентке назначаются такие препараты:
- Кальцитонин внутримышечно или подкожно на протяжении 2–3 месяцев;
- Этидроновая кислота в форме инъекций двухнедельными курсами на протяжении 3 месяцев;
- Кальция карбонат в любой форме, принимаемый на протяжении всей жизни;
- Тамоксифен в форме таблеток на протяжении 4–5 лет.
Эти препараты укрепляют скелет, снижая риск переломов. Лекарства практически не имеют побочных эффектов, оказывая эстрогеноподобное действие костную ткань.

В ходе лечения больной нужно придерживаться строгой диеты. В рационе должны постоянно присутствовать продукты, содержащие магний, кальций и минералы. Хороший восстановительный эффект дают студень, творог, морская рыба и злаки. От кофе лучше отказаться, так как этот напиток выводит из организма кальций.
Для снижения риска переломов при физических нагрузках больной рекомендуется ношение ортопедического поддерживающего корсета. Его нужно использовать в повседневной жизни и при выполнении гимнастических упражнений. Целью курса лечебной физкультуры является создание мышечной массы на спине и конечностях. Это поможет снизить давление на кости и избежать переломов. Нагрузка подбирается для каждой пациентки индивидуально.
Антон Игоревич Остапенко
- Карта сайта
- Диагностика
- Кости и суставы
- Невралгия
- Позвоночник
- Препараты
- Связки и мышцы
- Травмы
Миелодисплазия: что это такое, причины, как проявляется и лечится
Миелодисплазия – это собирательный термин, который в себя включает различные варианты врожденных нарушений развития нижнего отдела позвоночника. Обычно патология диагностируется в раннем детстве. Сопровождается различными по тяжести нарушениями периферической чувствительности, функции органов брюшной полости и малого таза, снижением двигательной функции нижних конечностей. Без своевременного лечения приводит к развитию инвалидности пациента.
Содержание статьи:
Причины
Симптомы
Методы лечения
Профилактика
Возможные причины развития

Миелодисплазия пояснично-крестцового отдела позвоночника возникает как следствие следующих патологий:
- спинномозговой грыжи (часть спинного мозга выходит за пределы костного канала из-за дефекта оболочек);
- рахишизиса (врожденной аномалии развития нервной ткани);
- сирингомиелии (появления полости в тканях спинного мозга);
- агенезии дистального отдела позвоночника;
- добро- и злокачественных образований спинного мозга;
- травматических повреждений;
- дегенеративных изменений позвоночника;
- расщепления позвоночника (неполного закрытия нервной трубки в период развития плода).
Миелодисплазия пояснично-крестцового отдела позвоночника у детей часто возникает уже с момента рождения. Она проявляется врожденными пороками развития позвоночника, которые сочетаются с детским церебральным параличом, синдромом Арнольда-Кларка, поражением кожи и сирингомиелией.
 Эти все патологии объединяет то, что они сопровождаются нарушением иннервации на уровне спинномозговых нервов поясничного отдела (L1-L5).
Эти все патологии объединяет то, что они сопровождаются нарушением иннервации на уровне спинномозговых нервов поясничного отдела (L1-L5).
Код болезни миелодисплазия по МКБ-10 – Q06.8
Клиническая картина
Выраженность клинической картины при миелодисплазии зависит от причины заболевания, степени поражения спинного мозга. При сирингомиелии часто наблюдается медленное прогрессирование симптоматики. Начало заболевания обычно при врожденных патологиях совпадает с моментом рождения. Выраженность симптоматики может варьировать с возрастом ребенка.
Обычно отдельно выделяют несколько групп симптомов:
- неврологические дефекты;
- нарушения функционирования опорно-двигательного аппарата;
- ухудшение со стороны органов пищеварительной или мочеполовой систем.
Симптомы миелодисплазии
Неврологические симптомы такой патологии как миелодисплазия включают в себя:
- снижение периферической чувствительности кожи;
-
 развитие парестезии (ощущения жжения, бега мурашек по коже);
развитие парестезии (ощущения жжения, бега мурашек по коже); - снижение физической силы отдельных мышц ног (симметрическое или несимметрическое);
- ноющие боли в поясничной области, которые могут отдавать в ногу и усиливаться при отдельных движениях туловища;
- развитие трофических язв на стопах;
- паралич одной или обеих конечностей.
Также наблюдаются признаки нарушения функции опорно-двигательного аппарата:
- мышечная атрофия нижних конечностей;
- деформация поясничного отдела позвоночника и крестца;
- развитие деформации стоп из-за разницы в тонусе различных мышц;
- хронические артриты тазобедренных или коленных суставов;
- аномалии развития таза.
Со стороны внутренних органов возможны следующие симптомы:
- атония мочевого пузыря, что приводит к недержанию мочи;
- склонность к запорам;
- повышенная продукция газов в кишечнике;
- нарушение репродуктивной функции, сниженное сексуальное влечение;
- повышенный риск развития инфекций мочеполовой системы.
Диагностика
Диагностику пациента с такими нарушениями как миелодисплазия проводит врач-невропатолог. Обычно к нему направляют педиатры или участковые терапевты. Сначала он тщательно собирает жалобы пациента или его родителей, особый акцент делается на нарушения чувствительности и моторики.
Также необходимо уточнить течение беременности у матери, наличие заболеваний в этот период, прием медикаментов, наличие аномалий развития у ближайших родственников. После этого проводится тщательный внешний осмотр пациента, при котором часто уже можно выявить признаки аномалий развития поясничного отдела позвоночника.
Общеклинические исследования играют малозначительную роль в диагностике такого нарушения как миелодисплазия. Акцент делается на инструментальную диагностику:
-
 компьютерную томографию (КТ);
компьютерную томографию (КТ); - магниторезонансную томографию (МРТ);
- ультразвуковую диагностику органов пищеварительной и мочеполовой систем;
- электромиографию.
Использование этих методов позволяет точно установить тип патологи позвоночника (и/или) спинного мозга и верифицировать причину развития миелодисплазии в большинстве случаев.
Большое значение имеет ранняя диагностика врожденных пороков развития в период беременности женщины. Поэтому необходимо несколько раз проводить скрининговое ультразвуковое обследование, которое позволяет выявить наиболее грубые пороки развития позвоночника уже во втором триместре.
Методы лечения
Оперативные вмешательства
Операции проводятся в специализированных нейрохирургических клиниках. Наиболее частые варианты вмешательств – следующие:
- оперативная стабилизация позвоночника – проводится при наличии значительного искривления поясничного отдела (более 30°);
- кифэктомия – пластика кифоза поясничного отдела;
- микрохирургические вмешательства на спинном мозге (удаление опухолей, кист);
- люмбальное шунтирование – при наличии гидроцефалии;
- пластика врожденных пороков развития поясничного отдела – желательно проводить в первые недели после рождения ребенка.
Операция позволяет восстановить нормальную физиологическую структуру позвоночника, ликвидировать компрессию спинномозговых нервов.
Медикаментозное лечение
Терапия лекарственными препаратами позволяет снизить выраженность симптоматики миелодисплазии. Она включает в себя назначение следующих групп медикаментов:
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения суставов наши читатели успешно используют Артрейд. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
-
 нестероидные противовоспалительные средства для снижения локального воспаления и болевого синдрома;
нестероидные противовоспалительные средства для снижения локального воспаления и болевого синдрома; - ингибиторы холинэстеразы (прозерин, неостигмин, физостигмин) – способствуют восстановлению двигательной активности периферических мышц;
- миорелаксанты (толперизон, баклофен, циклобензаприн) – снижают тонус мышц, который часто повышен при парезах нижних конечностей;
- нейропротекторы (церебролизин, цитиколин, гамма-аминомасляная кислота) – способствует восстановлению (поврежденных участков нервной системы);
- витамины группы В – необходимы для регенерации нервной ткани;
- спазмолитики (дротаверин, папаверин) – при спазматических кишечных коликах;
- стимуля
