Мелкоклеточный рак легкого паранеопластический синдром
Заболеваемость и смертность от мелкоклеточного рака легких во всем мире делают эту болезнь заметной проблемой для здравоохранения. Диагноз основывается на результатах гистологии, для подтверждения проводят иммуногистохимические исследования в сложных случаях. Типичными пациентами являются мужчины старше 70 лет, которые были раньше или являются сейчас заядлыми курильщиками и которые имеют сопутствующие заболевания дыхательной и сердечно-сосудистой систем. Симптомы могут начать быстро проявляться из-за локального внутригрудного роста опухоли, внелегочного отдаленного распространения, паранеопластических синдромов или комбинации этих особенностей [2]. Термин МРЛ впервые введен в 1926 году, когда было признано его эпителиальное происхождение [2].
Рак легких является причиной 12 % всех выявленных случаев рака во всем мире и основной причиной смерти от рака в США [4]. МРЛ представляет 13 % всех вновь диагностированных случаев рака легких во всем мире, или более 180 000 случаев в год. В развитых странах распространенность МРЛ снизилась за последние 30 лет, вероятно, из-за антитабачной политики. Ожидается увеличение заболеваемости в странах, где распространенность курения остается высокой [2].
Хотя в 95% случаях мелкоклеточный рак развивается в легких, он также может возникать во внелегочных участках, включая носоглотку, желудочно-кишечный тракт и мочеполовой тракт. 11-13 Мелкоклеточный рак, как легочный, так и внелегочный, имеющие сходное клиническое и биологические течение, склонны к быстрому метастазированию [3].
МРЛ — это злокачественная опухоль, состоящая из мелких эпителиальных клеток с небольшим количеством цитоплазмы, плохо очерченными клеточными границами, мелкозернистым ядерным хроматином и отсутствующими или незаметными ядрышками» (рис. 1). Клетки могут иметь круглую, овальную или веретенообразную формы. Типичный МРЛ включает только небольшие клетки и составляет около 90% всех случаев. Есть случаи, при которых опухоль содержит крупноклеточные компоненты [2,3]. С вероятностью 30 % при вскрытиях у пациентов с МРЛ выявляют участки немелкоклеточной дифференцировки карцином. Это чаще всего выявляется в образцах, полученных от ранее пролеченных пациентов и предполагает, что канцерогенез в легких происходит в плюрипотентных стволовых клетках, способных к дифференцировке по разным путям [3].
.
Рисунок 1. Черты МРЛ при микроскопии
(A) При типичном МРЛ клетки маленькие (обычно меньше, чем размер трех маленьких лимфоцитов) с небольшим количеством цитоплазмы, ядра мелкозернистые, ядрышки отсутствуют (окраска Дифф — Квик, увеличение ×200).
(B) Клетки могут быть круглыми, овальными или веретенообразными, и клеточная стенка видна редко. Группы клеток могут формировать розетки. В опухоли часто определяются некрозы (окраска гематоксилином и эозином, увеличение × 200).
При иммуногистохимии результаты для (C) CK-7, нейроэндокринных маркеров (D) CD56 и (E) синаптофизина; и (F) TTF-1 положительны.
Все фотографии предоставлены с разрешения М. Праета и Л. Фердинанде, Гентский университет, Бельгия.
МРЛ можно заподозрить при наличии определенных симптомов и признаков. Для подтверждения диагноза требуются гистологические и цитопатологические исследования. Образцы из первичной опухоли, лимфатических узлов или других метастатических участков получают с помощью бронхоскопии или тонкоигольной аспирационной пункционной биопсии (ТАПБ). Опухоль растет под слизистой бронхов, и, следовательно, бронхоскопия или исследование мокроты могут не дать результатов. Иммуногистохимические исследования проводятся для подтверждения диагноза в сложных случаях. Тест на нейроэндокринные маркеры, такие как хромогранин, синаптофизин и CD56, также может быть полезным — менее 10 % опухолей МРЛ являются отрицательными для всех нейроэндокринных маркеров. Почти все МРЛ являются иммунореактивными в отношении кератина, антигена эпителиальной мембраны и фактора транскрипции щитовидной железы-1 (TTF-1) [3]. Реакция МРЛ на TTF-1 положительна в 90% случаев. Эпителиальные маркеры, такие как цитокератины, обнаруживаются во многих опухолях МРЛ и помогают отличить их от лимфом и других маленьких круглых опухолей. Но отличить мелкоклеточный от немелкоклеточного с помощью маркеров трудно [2].
Первыми описали отчетливые клинические особенности МРЛ Watson и Berg: центральное расположение на рентгенографии грудной клетки, тенденцию к раннему распространению, высокую чувствительность к химиотерапии и высокую частоту метастазов при вскрытии. Симптомы начинают проявляться, как правило, в течение 8–12 недель. Наиболее частыми симптомами являются кашель, хрипы, одышка, кровохарканье, вызванное локальным внутрипульмональным ростом опухоли; симптомы, обусловленные внутригрудным распространением на стенку грудной клетки, верхней полой веной или пищеводом, боль, усталость, анорексия и неврологические жалобы, вызванные отдаленное распространение и паранеопластические синдромы [2].
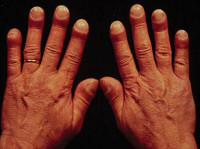
Предпочтительными участками для метастазирования являются мозг, печень, надпочечники, кости и костный мозг. МРЛ является наиболее частой причиной паранеопластических синдромов. Эти синдромы следует активно исключать всякий раз, когда у пациента проявляются какие-либо из их признаков. Наиболее частыми проявлениями синдромов со стороны эндокринной системы являются синдром неадекватного антидиуреза и синдром Кушинга. Известно о субклинических проявлениях обоих. Дерматологические аномалии, специфически связанные с МРЛ, включают приобретенный тилоз, трипальные пальмы и эритему. Редкими проявлениями являются дерматомиозит, гипергликемия, гипогликемия, гиперкальциемия и гинекомастия [2,4].
Классификация
Мелкоклеточный рак легкого входит в группу эпителиальных бронхопульмональных нейроэндокринных (НЭ) опухолей. Все НЭ опухоли легкого являются злокачественными новообразованиями и представлены четырьмя основными подтипами [1]:
1) типичный карциноид (ТК);
2) атипичный карциноид (АК);
3) крупноклеточный НЭ рак (КНЭР);
4) мелкоклеточный рак (МРЛ).
При этом ТК и АК являются высокодифференцированными нейроэндокринными опухолями с низкой степенью злокачественности (G1 и G2), а КНЭР и МРЛ — это низкодифференцированные нейроэндокринные опухоли с высокой степенью злокачественности (G3) [1,4].
Оценка распространенности опухолевого процесса влияет на решение о назначении терапии. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей [1,4].
Классификация, по которой выделяют пациентов с локализованным и распространенным мелкоклеточным раком легкого актуальна [1].
Локализованная стадия — опухоль занимает одну половину грудной клетки с регионарными метастазами в лимфоузлы корней легких с обеих сторон, с метастазами в надключичные узлы и лимфоузлы средостения, а также с выпотом в плевральной полости с этой же стороны.
Распространенная стадия — процесс, выходящий за пределы локализованного. Наличие М1 — это всегда распространенная стадия.
Лечение МРЛ
Распространенная стадия
Первая линия химиотерапии. В течение последних десяти лет комбинации ЕР или ЕС (этопозид + цисплатин / карбоплатин) является стандартом для лечения пациентов с МРЛ. Доказано, что противоопухолевая активность данного лечения при распространенном МРЛ составляет 60–78 % (полный эффект — у 10–20 % больных). Медиана выживаемости — 7,3–11,1 мес. Большинство новых режимов современной химиотерапии основыввется на комбинации ЕР (или ЕС) или путем замены этопозида на другое средство [1].
Вторая линия химиотерапии. Несмотря на высокую чувствительность МРЛ к химио- и лучевой терапии, в большинстве случаев приходится сталкиваться с рецидивом заболевания. В такой ситуации выбор дальнейшей лечебной тактики (химиотерапия второй линии) зависит от ответа пациентов на первую линию лечения, интервала времени, прошедшего после ее окончания, и от расположения метастазов [1,4].
Различают [1]:
• «чувствительный» рецидив — полный или частичный эффект от первой линии химиотерапии и прогрессирование опухолевого процесса не ранее 3 мес. после окончания индукционной терапии)
• «рефрактерный» рецидив, прогрессировавший в процессе индукционной терапии или менее чем через 3 мес. после ее окончания.
У пациентов с рецидивом МРЛ прогноз сомнительный, в особенности при рефрактерном рецидиве. Медиана выживаемости после обнаружения рецидива не превышает 4 месяца. В настоящее время схема CAV стала второй линией лечения МРЛ. Больным с резистентной формой МРЛ назначают химиотерапию второй линии. При этом эффективность отмечается у небольшого процента больных, но применение химиотерапии может стабилизировать болезни и/или замедлить прогрессирование [1].
Третья линия химиотерапии. Эффективность третьей линии химиотерапии распространенного МРЛ остается неизвестной. Больные в третьей линии могут получать таксол, гемцитабин, ифосфамид как в монотерапии, так и в комбинации с цисплатином или карбоплатином. Выживаемость больных с распространенным МРЛ следующая: 1 год после постановки диагноза живут 44 % больных, 1,5 года — 24 %, 2 года — 12 %, 3 года — 6 %, от 3,5 до 5 лет — 4 % больных [1].
Локализованная стадия МРЛ
У 50 % пациентов отмечается полная ремиссия и у них хорошие шансы на полное излечение. Стандартом современного лечения локализованного МРЛ является химиолучевая терапия, которая может проводиться как в одновременном, так и в последовательном режиме. Из всех схем комбинированной химиотерапии для комбинации с облучением наиболее удобной и подходящей оказалась схема этопозид + цисплатин. Лучевая терапия, начинающаяся на первой или второй неделе химиотерапии («ранняя ЛТ»), может проводиться в разовой дозе 1,5–2 Гр и суммарной дозе 45–50 Гр. Эффективность современной терапии при локализованном МРЛ колеблется от 65 до 90 %, с полной регрессией опухоли у 45–60 % больных и медианой выживаемости 18–24 мес [1].
Лучевая терапия МРЛ
Применяется у пациентов с локализованной и распространенной стадиями болезни. В результате отмечается регрессия опухоли в 60–80 % случаях, но отдельно от химиотерапии не увеличивает продолжительность жизни из-за появления отдаленных метастазов. Без облучения локальное прогрессирование болезни встречается у 80 % больных с локализованным МРЛ, получавших только химиотерапию. Лучевая терапия также проводится у больных с распространенной стадией (при метастазах в кости, в мягкие ткани, мозг). При появлении метастазов в мозге ЛТ является основным методом лечения. Химиолучевая терапия улучшает результаты лечения и увеличивает продолжительность жизни [1,4].
Профилактическое облучение мозга
Метастазы в головной мозг появляются у 20–30 % пациентов к моменту установления диагноза МРЛ и часто протекают бессимптомно. Иногда появление метастазов в головном мозге является первым симптомом МРЛ. Профилактическое облучение (ПОМ) показано больным с невыявленными метастазами в мозге, т. к. шансы на появление их в ближайшие 1,5–2 года достигают 70 % [1].
Таргетная терапия МРЛ
Молекулярно-генетические механизмы МРЛ разнообразны и пока недостаточно изучены. Для МРЛ характерны делеция хромосомы 3р, мутации гена р53, экспрессия Bcl-2, активация теломеразы и немутантного c-kit у 75–90 % пациентов. При МРЛ наблюдаются и другие молекулярные нарушения: экспрессия VEGF, потеря гетерозиготности хромосом 9р и 10q у большинства пациентов. Аномалии KRAS и р16 при МРЛ относительно редки. Многие таргетные препараты были изучены при МРЛ, но это не изменило клинические подходы и возможности терапии этого заболевания [1,2].
Хирургическое лечение МРЛ
Хирургическое лечение является доказанным методом выбора только у пациентов с I стадией болезни. Операция возможна у больных МРЛ и со II стадией, но клинических исследований недостаточно. При I стадии МРЛ 5-летняя выживаемость после операции — 48–50 %, а при II стадии — 32–39 %. Хирургическое лечение МРЛ также возможно у пациентов с неуточненным морфологичеким диагнозом и при наличии смешанных форм (с мелкоклеточным и немелкоклеточным компонентами). Во всех случаях через 2–3 нед. после оперативного вмешательства необходимо проведение адъювантной ХТ (4 курса с интервалами 3–4 нед.). Схемы адъювантной ХТ: этопозид + карбоплатин или этопозид + цисплатин [1].
Источники:
1. Бычков М.Б., Горбунова В.А. Клинические рекомендации по диагностике и лечению больных раком легкого // М.: Общероссийский союз общественных объединений ассоциация онкологов России. – 2014.
2. Fennell D. A. et al. Small-cell lung cancer //Lancet (London, England). – 2011. – Т. 378. – №. 9804. – С. 1741-1755.
3. Kalemkerian G. P. et al. Small cell lung cancer //Journal of the National Comprehensive Cancer Network. – 2013. – Т. 11. – №. 1. – С. 78-98.
4. Kalemkerian G. P. et al. NCCN guidelines insights: Small cell lung cancer, Version 2.2018 //Journal of the National Comprehensive Cancer Network. – 2018. – Т. 16. – №. 10. – С. 1171-1182.
Источник
Паранеопластический синдром (ПНС) — клинико-лабораторное проявление злокачественной опухоли, обусловленное не её локальным или метастатическим ростом, а неспецифическими реакциями со стороны различных органов и систем или эктопической продукцией опухолью биологически активных веществ.[1] Паранеопластические синдромы распространены у пациентов среднего и пожилого возраста, и наиболее часто развиваются при раке лёгких, молочной железы, яичников, а также при лимфоме.[2] Иногда симптомы паранеопластического синдрома манифестируют ещё до диагностики злокачественной опухоли.
Классификация[править | править код]
Паранеопластические синдромы разделяются на 4 основные категории — эндокринные, неврологические, кожно-слизистые и гематологические ПНС, а также другие, не включённые в основные категории:
Неврологические ПНС[править | править код]
Наиболее тяжёлая в клиническом отношении группа паранеопластических синдромов — паранеопластические неврологические расстройства.[8] Эти синдромы могут вовлекать как центральную, так и периферическую нервную систему; некоторые из них сопровождаются нейродегенерацией [9], хотя некоторые (например, миастенический синдром Ламберта — Итона) могут клинически улучшаться на фоне лечения. В числе симптомов паранеопластических неврологических расстройств — атаксия, головокружение, нистагм, затруднение глотания, потеря мышечного тонуса, нарушение координации движений, дизартрия, проблемы со зрением, расстройства сна, деменция, потеря кожной чувствительности.
Более распространены паранеопластические неврологические расстройства при раке молочной железы, лёгких, опухолях яичников, однако встречаются и при многих других злокачественных заболеваниях.
Лечение включает в себя:
- Методы, направленные на лечение опухоли (химиотерапия, радиотерапия, хирургия);
- Методы, направленные на уменьшение или замедление нейродегенерации. Быстрая диагностика и лечение очень важны для возможности неврологического восстановления пациента. В связи с редкостью этой патологии лишь немногие специалисты встречались с ними в клинической практике, поэтому консультация таких специалистов необходима при лечении паранеопластических неврологических расстройств.
Примечания[править | править код]
- ↑ Л. И. Дворецкий — Паранеопластические синдромы
- ↑ NINDS Paraneoplastic Syndromes Information Page Архивировано 4 января 2015 года. National Institute of Neurological Disorders and Stroke (англ.)
- ↑ MeSH Paraneoplastic+endocrine+syndromes
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 Table 6-5 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson. Robbins Basic Pathology (неопр.). — Philadelphia: Saunders, 2007. — ISBN 1-4160-2973-7. 8th edition.
- ↑ MeSH Nervous+system+paraneoplastic+syndromes
- ↑ Cohen P.R., Kurzrock R. Mucocutaneous paraneoplastic syndromes (неопр.) // Semin. Oncol.. — 1997. — Т. 24, № 3. — С. 334—359. — PMID 9208889.
- ↑ Staszewski H. Hematological paraneoplastic syndromes (неопр.) // Semin. Oncol.. — 1997. — Т. 24, № 3. — С. 329—333. — PMID 9208888.
- ↑ Rees J.H. Paraneoplastic syndromes: when to suspect, how to confirm, and how to manage (англ.) // J. Neurol. Neurosurg. Psychiatr. (англ.)русск. : journal. — 2004. — Vol. 75 Suppl 2. — P. ii43—50. — doi:10.1136/jnnp.2004.040378. — PMID 15146039.
- ↑ Darnell R.B., Posner J.B. Paraneoplastic syndromes affecting the nervous system (англ.) // Semin Oncol : journal. — 2006. — Vol. 33, no. 3. — P. 270—298. — doi:10.1053/j.seminoncol.2006.03.008. — PMID 16769417.
Ссылки[править | править код]
- Neuroimmunology, The Medical School, Birmingham University (англ.) — Paraneoplastic neurological autoantibodies, Birmingham UK
- https://www.antibodypatterns.com/hu.php (англ.)
- IPA website (англ.)
- Rockefeller University clinical research laboratory (англ.) devoted to the paraneoplastic neurologic disorders
- Паранеопластические синдромы, видеолекция
Источник
Паранеопластический синдром – комплекс клинических и лабораторных признаков онкологического заболевания, не связанных с ростом первичного новообразования и появлением метастазов. Обусловлен неспецифической реакцией организма и выделением опухолью биологически активных соединений. Проявляется эндокринными, дерматологическими, сердечно-сосудистыми, нейромышечными, нефрологическими, гастроэнтерологическими, гематологическими или смешанными расстройствами. Диагностируется на основании анамнеза, симптомов и данных дополнительных исследований. Лечение – удаление либо консервативная терапия первичной опухоли.
Общие сведения
Паранеопластический синдром – неметастатические системные клинико-лабораторные проявления онкологического заболевания. Страдают преимущественно больные пожилого и среднего возраста. Паранеопластический синдром чаще возникает при лимфоме, раке легких, раке яичников и раке молочной железы. Иногда становится первым признаком ранее недиагностированного онкологического поражения. Играет как положительную, так и отрицательную роль в процессе диагностики онкологических заболеваний.
При отсутствии клинических проявлений первичного онкологического процесса становится неспецифическим маркером новообразования. Вместе с тем, одновременное появление паранеопластического синдрома и локальных симптомов злокачественной опухоли может усложнять клиническую картину и затруднять распознавание онкологического заболевания. Лечение осуществляют специалисты в области онкологии, эндокринологии, кардиологии, гастроэнтерологии, дерматологии и врачи других специальностей.

Паранеопластический синдром
Причины паранеопластического синдрома
Основными причинами развития паранеопластического синдрома являются активность злокачественной опухоли и реакции организма на эту активность. Клетки новообразования выделяют биологически активные белки, энзимы, иммуноглобулины, простагландины, цитокины, интерлейкины, факторы роста, активные и неактивные гормоны, влияющие на деятельность различных органов и систем. Контакт нормальных тканей организма с тканью опухоли и выделяемыми ею соединениями провоцирует нормальные иммунные реакции и вызывает развитие аутоиммунных нарушений.
Вероятность возникновения, интенсивность проявлений и характер паранеопластического синдрома зависят от локализации и вида новообразования, способности опухоли выделять различные активные вещества и генетически обусловленной склонности к аутоиммунным нарушениям. Чаще всего паранеопластический синдром развивается при раке легкого. В числе других онкологических заболеваний, часто провоцирующих этот синдром – рак молочной железы, рак яичников, рак почки, лимфомы, лейкозы, гепатоцеллюлярная карцинома, рак желудка, рак поджелудочной железы и опухоли ЦНС.
Характеристика паранеопластических синдромов
Паранеопластические синдромы – обширная группа синдромов, возникающих при злокачественных опухолях. Кроме того, паранеопластические синдромы выявляются при некоторых доброкачественных новообразованиях и заболеваниях неопухолевой природы, в том числе – при ревматических болезнях, хронических неспецифических заболеваниях легких, болезнях сердца, эндокринных заболеваниях и поражении паренхиматозных органов. Возможность вовлечения любых органов и систем, а также разнообразие клинических проявлений паранеопластических синдромов затрудняют создание единой классификации.
Существует несколько вариантов упорядочивания таких синдромов, наиболее распространенным из которых является группировка по органно-системному принципу (с учетом поражения тех или иных органов). Согласно этому варианту, различают эндокринные/метаболические, дерматологические, почечные, нервно-мышечные/неврологические и некоторые другие виды паранеопластических синдромов. Отличительными особенностями всех синдромов являются:
- общие патогенетические механизмы;
- возникновение при онкологических заболеваниях;
- неспецифичность клинической симптоматики и лабораторных показателей;
- возможность развития паранеопластического синдрома до появления локальных признаков опухоли, одновременно с локальными признаками опухоли либо на заключительных стадиях болезни;
- неэффективность терапии, исчезновение синдрома после радикального лечения новообразования и его повторное возникновение во время рецидива.
Развитие паранеопластического синдрома до появления местных признаков опухоли может, как облегчать, так и затруднять диагностику основной патологии. Например, синдром Мари-Бамбергера (оссифицирующий системный периостоз, при котором пальцы приобретают вид барабанных палочек) чаще наблюдается при злокачественных поражениях плевры и легких, но не является их специфическим проявлением, поскольку может обнаруживаться и при других заболеваниях, например, при хроническом обструктивном бронхите, циррозе печени или пороках сердца.
Тем не менее, наличие этого паранеопластического синдрома указывает на высокую вероятность патологии дыхательной системы и позволяет достаточно точно определить перечень необходимых обследований. Другие паранеопластические синдромы, например, лихорадка, тромбофлебит или дерматологические поражения могут трактоваться как самостоятельные заболевания, что ведет к недообследованию, назначению неправильного лечения и запоздалому выявлению онкологических поражений, ставших причиной развития данной патологии. Своевременная диагностика и дифференциальная диагностика этой группы патологических состояний остается актуальной проблемой современной онкологии.
Виды паранеопластических синдромов
Гастроинтестинальные паранеопластические синдромы (потеря аппетита, похудание) – самые распространенные синдромы при онкологических заболеваниях. На определенных этапах злокачественного процесса выявляются практически у всех больных. Основными проявлениями паранеопластического синдрома являются потеря аппетита, изменение вкуса, возникновение отвращения к некоторым пищевым вкусам и запахам. После постановки диагноза, прогрессирования локальной симптоматики и начала химиотерапии гастроинтестинальные расстройства могут усугубляться депрессией, страхом перед тошнотой и рвотой, нарушениями проходимости кишечника и другими обстоятельствами.
Гематогенные паранеопластические синдромы выявляются у большинства онкологических больных. Самой распространенной разновидностью этого паранеопластического синдрома является умеренная или нерезко выраженная нормохромная анемия. В анализе периферической крови нередко обнаруживаются другие признаки основного заболевания: повышение СОЭ, лейкоцитоз и сдвиг лейкоцитарной формулы влево. При В-клеточных лимфоидных новообразованиях паранеопластический синдром может проявляться аутоиммунной гемолитической анемией, при меланоме и лимфоме Ходжкина – гранулоцитозом, при лейкозах – тромбоцитопенией, при раке печени и почек – эритроцитозом.
Эндокринные и метаболические паранеопластические синдромы включают в себя разнообразные гормональные и обменные нарушения. При медуллярном раке щитовидной железы может развиваться гипокальциемия, протекающая бессимптомно или сопровождающаяся повышением нервно-мышечной возбудимости. При мелкоклеточном раке легкого паранеопластический синдром проявляется синдромом Кушинга и водно-электролитными нарушениями. Для феохромоцитом характерно повышение артериального давления, для лимфомы Ходжкина – гипоурикемия, для гематосаркомы и острых лейкозов – гиперурикемия.
Сосудистые паранеопластические синдромы обычно проявляются тромбофлебитами. Могут возникать за несколько месяцев до появления первых признаков онкологического заболевания. Чаще всего выявляются при раке молочной железы, опухолях ЖКТ, раке легких и раке яичников. Половина тробмофлебитов у пациентов в возрасте старше 65 лет связаны с развитием злокачественных новообразований. Сосудистые паранеопластические синдромы плохо поддаются антиагрегантной терапии. После оперативных вмешательств развиваются более чем у половины больных онкологическими заболеваниями. Являются третьей по распространенности причиной летальности в послеоперационном периоде.
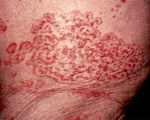
Дерматологические паранеопластические синдромы отличаются большим разнообразием. Включают в себя преходящую эритему, приобретенный ихтиоз, паранеопластическую пузырчатку и другие расстройства. Выявляются при лейкозах, медуллярном раке щитовидной железы и некоторых других онкологических заболеваниях.
Неврологические/нервномышечные паранеопластические синдромы сопровождаются поражением центральной и периферической нервной системы. Могут проявляться энцефалитом, деменцией, психозами, синдромом Ламберта-Итона (слабость мышц конечностей, напоминающая миастению, при сохранении тонуса глазных мышц; обычно возникает при опухолях в области грудной клетке, чаще всего при раке легкого), синдромом Гийена-Барре (периферическая нейропатия, выявляется у некоторых больных лимфомой Ходжкина) и другими периферическими нейропатиями.
Ревматологические паранеопластические синдромы встречаются как при ревматоидных заболеваниях, так и при злокачественных новообразованиях. Системный склероз, полимиалгия и ревматоидный артрит характерны для гемобластозов и опухолей толстого кишечника. Паранеопластический синдром в виде вторичного амилоидоза выявляется при почечно-клеточном раке, лимфомах и миеломе. Гипертрофическая остеопатия может наблюдаться при некоторых разновидностях рака легкого.
Источник
