Лимфопролиферативный синдром по мкб 10
Содержание
- Описание
- Дополнительные факты
- Причины
- Классификация
- Симптомы
- Диагностика
- Лечение
- Прогноз
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Аутоиммунный лимфопролиферативный синдром.

Аутоиммунный лимфопролиферативный синдром
Описание
Аутоиммунный лимфопролиферативный синдром. Группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS — обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Дополнительные факты
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме. Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.
Аутоиммунный лимфопролиферативный синдром
Причины
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки. При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС. Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку. Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A. Вызвана мутацией гена TNFRSF6, расположенного на 10 — й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно — доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В. Обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m Ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2. Вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки — каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3. Мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4. Обусловлена мутацией гена NRAS, также кодирующего белки — передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы
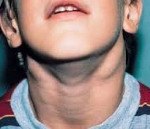
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Увеличение паховых лимфоузлов. Увеличение подмышечных лимфоузлов. Увеличение шейных лимфоузлов. Эозинофилия.
Диагностика
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия. Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие. При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
Рубрика МКБ-10: D47.9
МКБ-10 / C00-D48 КЛАСС II Новообразования / D37-D48 Новообразования неопределенного или неизвестного характера / D47 Другие новообразования неопределенного или неизвестного характера лимфоидной, кроветворной и родственных им тканей
Определение и общие сведения[править]
Аутоиммунный лимфопролиферативный синдром
Синонимы: синдром Канале-Смита (Canale-Smith)
Аутоиммунный лимфопролиферативный синдром является редким наследственным заболеванием, характеризующееся доброкачественной лимфопролиферацией, мультилинейной цитопенией и повышенным прижизненным риском возникновения ходжкинской и неходжкинской лимфом.
Распространенность аутоиммунного лимфопролиферативного синдрома неизвестна. На сегодняшний день было сообщено о более, чем 500 пациентов во всем мире в различных этнических группах.
Наследование может быть аутосомно-доминантным или аутосомно-рецессивным.
Этиология и патогенез[править]
Аутоиммунный лимфопролиферативный синдром вызван нарушением гомеостаза лимфоцитов. Зародышевые мутации генов FAS (10q24.1), FASLG (1q23) или CASP10 (2q33-q34) лежат в основе патологии. 75% случаев заболевания связаны с гетерозиготными мутациями гена FAS, 10% имеют соматические мутации гена FAS, 2-3% — CASP10 и FASLG <1%. Некоторые пациенты не имеют мутации в любом из этих генов (форма ALPS-U). Совсем недавно сообщалось об одном случае АЛС-подобного расстройства из-за мутации гена PRKCD (3p21.31) без повышения уровня клеток DNT.
Клинические проявления[править]
Аутоиммунный лимфопролиферативный синдром клинически гетерогенное заболевание со следующими первичными клиническими признаками: лимфопролиферация, проявляющаяся лимфаденопатией и гепатоспленомегалией с или без гиперспленизма, которая часто улучшается с возрастом; аутоиммунного нарушениями, в основном с участием клеток крови; а также повышенный риск развития лимфом на протяжении всей жизни.
Многие пациенты демонстрируют незлокачественную лимфопролиферацию в течение первых лет жизни. Клинические симтомы аутоиммунной дисфункции в виде гемолитической анемии, тромбоцитопении, нейтропении или аутоиммунного гепатита имеют различную степень выраженности, но часто эти признаки отсутствуют на момент постановки диагноза. Аутоиммунные заболевания, как сообщается, могут потенциально затрагивать практически любой орган, что приводит к увеиту, фиброзу легких, гастриту, колиту, нефриту, крапивнице, артриту или редко к аутоиммунным неврологическим осложнениям.
Течение заболевания варьирует.
Новообразование неопределенного или неизвестного характера лимфоидной, кроветворной и родственных им тканей неуточненное: Диагностика[править]
Диагноз основывается на клинических, лабораторных и генетических данных. Окончательный диагноз формулируется при наличии двух необходимых диагностических критериев: хроническая доброкачествення неинфекционная лимфаденопатия и/или спленомегалия и повышение уровня TCR альфа/бета-двойных-отрицательных Т-клеток (DNTs) на фоне нормального или повышенного уровня лимфоцитов, наряду с одним первичным дополнительным критерием, включая апоптоз лимфоцитов и наличие каузальной мутаций.
Дифференциальный диагноз[править]
Новообразование неопределенного или неизвестного характера лимфоидной, кроветворной и родственных им тканей неуточненное: Лечение[править]
Некоторым пациентам может потребоваться назначание иммуносупрессивной терапии — сиролимус и микофенолата мофетил.
Прогноз
Пациенты с мутацией FAS имеют значительно повышенный риск развития неходжкинской и ходжкинской лимфом, которые могут возникнуть в любом возрасте и реагирует на традиционную химиотерапию.
Профилактика[править]
Прочее[править]
https://www.orpha.net
Источники (ссылки)[править]
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
Определение. Опухоли лимфатической системы,происходящие из Т- и В-лимфоцитов. К ним относятся: хронический лимфолейкоз, волосато клеточный лейкоз, внекостномозговые опухоли (лимфо-цитомы и лимфосаркомы) и некоторые редкие формы. Внекостномозговые опухоли не являются лейкозами, и такие больные лечатся у онколога!
Самым частым видом лимфопролиферативных заболеваний является хронический лимфолейкоз -относительно доброкачественная опухоль, состоящая из морфологически зрелых лимфоцитов.
Статистика.
Хронический лимфолейкоз — самый распространенный вид хронического лейкоза. Болеют преимущественно пожилые люди, пик выявления приходится на 61-70 лет, у лиц моложе 40 лет болезнь является казуистикой, у детей не встречается. Мужчины болеют в 2,2 раза чаще женщин.
Этиология, патогенез. Цитогенетически доказана клоновая природа заболевания и роль в его возникновении хромосомных аберраций. Основной патогенетический механизм — разрастание лимфоидной ткани, что обусловливает основные клинические синдромы: лимфоцитарный лейкоцитоз и лимфаденопа-тию.
Клиника, диагностика. При первом обращении больные жалуются на общую слабость, повышенную потливость, увеличение периферических лимфатических узлов, определяемое самими больными (на шее, в подмышечных и паховых областях). В начальных стадиях жалоб может не быть, и часто у лиц трудоспособного возраста хронический лимфолейкоз выявляется при профилактических осмотрах. В крови лейкоцитоз с лимфоцитозом и клетки лейколиза (клетки Боткина-Гумпрехта). Количество клеток Боткин а-Гумпрехта не служит показателем тяжести процесса. Лимфоцитов при хроническом лимфолейкозе всегда абсолютный (в норме 1380-2800 кл/мкл). Подсчет абсолютного числа лимфоцитов при подозрении на это заболевание обязателен.
Пример 1. У больного лейкоцитов 4,2×10ч/л, лимфоцитов 52%. Процентное содержание лимфоцитов явно выше нормы, но если вычислить 52% от 4200, получится около 2100 кл/мкл, что является нормальным. Вывод: процентное содержание лимфоцитов высокое за счет нейтрофилопении, лимфоцитоз относительный.
Пример 2. У больного лейкоцитов 10,6х10д/л, лимфоцитов 52%. Абсолютное число лимфоцитов около 5300 кл/мкл. Вывод: лимфоцитоз абсолютный.
Классификация. Доброкачественная форма. Очень медленное, практически не прогрессирующее течение. Лейкоцитоз невысокий (до 50х109/л), периферические лимфатические узлы увеличены незначительно. При инфекционных заболеваниях может нарастать лейкоцитоз, но после выздоровления цифры лейкоцитов возвращаются к исходным. Активной терапии не требуется, больные трудоспособны, наблюдение и контроль крови 1 раз в 2-3 мес, стерналь-ная пункция, трепанобиопсия не проводятся.
Классическая форма (смешанная). Разделяется на три стадии. В 1-й стадии лейкоцитоз до 70×109/л с лимфоцитозом до 80%. Величина периферических лимфатических узлов до 3 см. Активной терапии не требует, контроль крови и наблюдение ежемесячно. Чем больше длительность 1-й стадии, тем лучше прогноз. Во 2-й стадии лейкоцитоз превышает 70х 109/л, ухудшается самочувствие, страдает общее состояние, периферические лимфатические узлы более 3 см, может наблюдаться увеличение селезенки. Требуется специфическая терапия. 3-я стадия напоминает бластный криз
у больных хроническим миелолейкозом и развивается редко. Появляются высокая лихорадка, геморрагический синдром, герпетические высыпания.
Эта стадия обусловлена трансформацией относительно доброкачественного зрелоклеточного роста в саркомный, злокачественный. Требует программной терапии.
Преимущественно опухолевая форма. Отличается от предыдущей тем, что при невысоком лейкоцитозе имеется значительное увеличение лимфатических узлов — до 6-8 см. Требует активной терапии.
Селезеночная форма. Редкая и благоприятная форма хронического лимфолейкоза, с невысоким лейкоцитозом, небольшим увеличением периферических лимфатических узлов и значительным увеличением селезенки. Активной терапии, как правило, не требует.
Примеры формулировки клинического диагноза.
• Хронический лимфолейкоз, доброкачественная форма.
• Хронический лимфолейкоз, смешанная форма, 2-я стадия.
• Хронический лимфолейкоз, селезеночная форма.
Дифференциальная диагностика
По симптому «увеличение лимфатических узлов» нужно дифференцировать хронический лимфолейкоз с метастазирующим раком. Для этого проводится скрининг 1-го уровня. Как при хроническом лимфолейкозе, так и при зрелоклеточной лим-фоме врач находит «пакеты» увеличенных лимфатических узлов, но при хроническом лимфолейкозе в пунктате костного мозга отмечается диффузная пролиферация лимфоидных элементов, чего никогда не бывает при лимфомах.
Ведение пациента
Цель лечения: обеспечение удовлетворительного качества жизни больного при отсутствии прогрес-сирования опухолевого процесса.
Задачи:
• раннее выявление, организация жизненного уклада, не провоцирующего опухолевую прогрессию;
• своевременное (не позднее, но ни в коем случае не ранее!) применение цитостатической и глюкокорти ко стероидной терапии;
• борьба с инфекционными осложнениями.
Организация лечения. При первом выявлении болезни:
• при лейкоцитозе не более 70×109/л, величине периферических лимфатических узлов не более 4-5 см, отсутствии лихорадки, тяжелойI анемии пациент направляется на амбулаторную консультацию гематолога и далее лечи- ся амбулаторно, в соответствии с рекоменда- циями специалиста;
• при лейкоцитозе выше 70-100×109/л, величине периферических лимфатических узлов бо лее 5 см, выраженных общих нарушениях, лихорадке, тяжелой анемии — госпитализация в гематологический стационар, после выписки — совместное ведение пациента гематологом и общепрактикующим врачом или участковым терапевтом.
При обострении заболевания (нарастании лей коцитоза, увеличении лимфатических узлов) — срочная консультация гематолога. Чаще всего удается купировать обострение амбулаторно, увеличением доз цитостатиков и глюкокортикостероидов.
Показания к госпитализации. Высокая лихорадка, лейкоцитоз выше 150×109/л, увеличение лимфатических узлов, угрожающее жизни больного (в глотке, гортани, брюшной полости), резистентиость к амбулаторной терапии, осложненное течение болезни (анемический, геморрагический, гемолитический синдром).
Вне обострения:
• контроль крови ежемесячно, осмотр общепрактикующего врача или участкового терапевта ежемесячно, консультация гематолога 1 раз в 2-3 мес, при доброкачественном течении — 1 раз в 6 мес.
Плановая терапия
Информация для пациента и его семьи:
• Пациент должен знать, что болезнь относительно доброкачественная, хроническая.
• Необходимо врачебное наблюдение и контроль крови.
• Пациент должен быть обучен самообследованию на предмет динамики состояния периферических лимфатических узлов.
• Недопустимо знахарское, «народное» лечение,«целительство» опасно для жизни пациента.
Советы пациенту и его семье:
• Жизненный режим, не провоцирующий опухолевую прогрессию: исключить инсоляцию, перегревание, переохлаждение, физиопроцедуры, работу на земельных участках.
• «Щадящий» режим для иммунной системы: диета, богатая белками и витаминами, но с исключением аллергизирующих продуктов; исключение или сведение к минимуму контактов с инфекционными больными, с бытовыми и профессиональными интоксикациями.
• Если пациент в трудоспособном возрасте, он нуждается в трудоустройстве без профвредности.
Медикаментозная терапия
В 1-й стадии заболевания и при доброкачественной форме активная терапия не проводится. Режим обычный для данного пациента, исключаются инсоляция, перегрев, переохлаждение.
Диета общая. У лиц пожилого возраста лечение можно не начинать до увеличения числа лейкоцитов более 100х109/л, поскольку у них выше вероятность стабилизации процесса в 1-й стадии, доброкачественного течения болезни в целом.
Во 2-й стадии:
• при лейкоцитозе 100-150х107л назначается лейкеран 2 мг ежедневно, при лейкоцитозе свыше 150хЮ7л- 4-6 мг ежедневно. При снижении количества лейкоцитов вдвое от исходного доза препарата также уменьшается вдвое;
• при лейкоцитозе 30-50х 109/л назначается поддерживающая терапия — лейкеран 2 мг 1-2 раза в нед. При высоком проценте лимфоцитов (выше 85%) та же доза назначается и при меньшем количестве лейкоцитов;
• при лейкоцитозе менее 20х 109/л лейкеран лучше отменить или назначить 2 мг 1 раз в 10 дней;
• циклофосфан назначается при значительном увеличении лимфатических узлов и наклонности к тромбоцитопении по 200 мг/сут в мышцу,10 инъекций на курс. Возможна индивидуальная непереносимость препарата. Ни в коем случае не следует стремиться к снижению лейкоцитов до нормальных цифр (6,8-8,0х 107л), ибо такое снижение происходит за счет нейтрофилов и грозит тяжелыми инфекционными осложнениями. Оптимальной следует считать цифру, при которой наблюдалось стабильное течение процесса в 1-Й стадии, а если таких данных о больном нет — 30-50х109/л;
• отдельно в ряду препаратов, применяемых при хроническом лимфолейкозе, стоят глюкокортикостероиды, ранее применявшиеся очень широко. Преднизолонотерапия вызывает быстрое уменьшение лимфатических узлов,улучшение общего состояния, нормализацию температуры тела. Однако очень быстро развивается лекарственная зависимость от глюкокортикостероидов, а следовательно, возможно появление гипертензии, язвенных поражений желудочно-кишечного тракта, патологических переломов костей, гипергликемии,гнойных и геморрагических осложнений. По этому преднизолон назначается лишь по жизненным показателям и ненадолго (10-14 дней),с последующей полной отменой препарата;
• в комплекс лечебных мероприятий входят рентгенотерапия при значительном увеличении лимфатических узлов и селезенки.
В 3-й стадии лечение проводят в стационаре по программам острого лимфобластного лейкоза.
Реабилитационная терапия
Поддерживающая терапия при адекватном лабораторном контроле. При доброкачественном течении, стабильности процесса, наличии сопутствующих заболеваний возможно направление на местные курорты в нежаркое время года. Исключается электро-и грязелечение, инъекции витаминов и биостимуляторов, бальнеолечение.
В качестве дополнительного метода лечения иногда используют гомотоксикологические методы. Базисная терапия: Galium-Heel по 10 кап. 3 раза в день либо парентерально по 1,1 мл 1-3 раза в нед.; Mercurius-Heel по 1 табл. под язык 3 раза в день. Симптоматическая терапия: Hepeel (таблетки, ампулы) при поражении печени, Lymphomyosot (капли, ампулы) при увеличении лимфоузлов, Ubichinon compositum (ампулы) для дезинтоксикации.
Критерии эффективности реабилитационной терапии:
• стабильное состояние пациента на фоне поддерживающей терапии;
• срок жизни пациентов при классической форме заболевания не менее 6-8 лет.
Медицинская экспертиза
• Экспертиза временной нетрудоспособности. Больные хроническим лимфолейкозом длительное время сохраняют трудоспособность даже во 2-й стадии заболевания, хотя требуют трудоустройства с ограничениями, оговоренными в разделе «Тромбоцитовазопатии». Весной и осенью, а особенно в период эпидемии гриппа, рекомендуется освобождать таких больных от работы на 10-14 дней, чтобы избежать инфекционных осложнений и продлить срок полноценной жизни больных. При обострении заболевания больные хроническим лимфолейкозом нетрудоспособны.
• Показания к направлению на МСЭК. На МСЭК направляются больные с 2-й и 3-й стадиями заболевания, постоянно получающие цитостатики,глюкокортикостероиды, с лейкоцитозом выше 1 ООх 10д/л на фоне специфической терапии, с выраженным и прогрессирующим увеличением лимфатических узлов и спленомегалией, с осложненным течением (опоясывающий герпес). Устанавливается 2-я, реже 3-я группа инвалидности.
• Военно-врачебная экспертиза, предвари
тельные и периодические медицинские осмотры
— см. раздел «Миелопролиферативные заболевания».
Прогноз. Случаи выздоровления от хронического лимфолейкоза достоверно не документированы. Продолжительность жизни больных колеблется в очень широких пределах — от нескольких месяцев (позднее выявление, тяжелые осложнения) до 2-3 десятилетий, в среднем составляет 6-8 лет.
Еще по теме Лимфопролиферативные заболевания (шифр С 91.1):
- СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ЭПОЭТИНА АЛЬФА И БЕТА ДЛЯ КОРРЕКЦИИ АНЕМИИ У БОЛЬНЫХ ЛИМФОПРОЛИФЕРАТИВНЫМИ ЗАБОЛЕВАНИЯМИ
- ТИМИДИНКИНАЗА-1 (ТК-1), ?2-МИКРОГЛОБУЛИН (?2-МГ) И ЛАКТАТДЕГИДРОГЕНАЗА (ЛДГ) У ПЕРВИЧНЫХ БОЛЬНЫХ ЛИМФОПРОЛИФЕРАТИВНЫМИ ЗАБОЛЕВАНИЯМИ (ЛПЗ)
- Хронические лейкозы. Миелопролиферативные
заболевания (шифр С 92.1) - Лимфопролиферативные процессы
- Вазопатии (шифр Д 69.0)
- Гипотиреоз (шифр ? 03)
- Цистный эхинококкоз (шифр по МКБ10 — B67.0-4)
- Тромбоцитовазопатии
(шифр Д 69.1) - Подагра (шифр ? 10)
- Тиреоидиты (шифр ? 06)
- Пиелонефриты (шифр N11)
- Пневмонии (шифр J 18)
- Плевриты (шифр J 90)
- Хронические гепатиты
(шифр К 73) - Нейроциркуляторная дистония (шифр F 45.3)
- Алкогольная болезнь (шифр F 10.2)
Источник
