Лейкоз лимфобластный код мкб
Связанные заболевания и их лечение
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Причины
- Патогенез
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Острый лимфобластной лейкоз.

Острый лимфобластной лейкоз
Описание
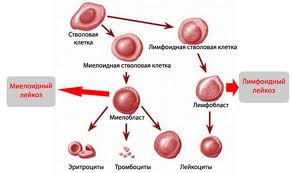
Острый лимфобластный лейкоз — это группа гетерогенных злокачественных новообразований из клеток — лимфоидных предшественников (лимфобласты), имеющих определенные генетические и иммунофенотипические характеристики.
Острые лимфобластные лейкозы самые распространённые лейкозы в детском и юношеском возрасте. Пик заболеваемости приходится на возраст от 1 года до 6 лет. Протекают с поражением костного мозга, лимфатических узлов, селезёнки, вилочковой железы, а также других органов.
Причины
В генетической основе развития острого лимфобластного лейкоза лежат изменения в структуре хромосом, т. Е. Хромосомные аберрации. При лейкозах выделяют специфические или первичные и неспецифические хромомомнве аберрации. К первичным принято относить транслокации, делеции, инверсии, амплификации участков хромосом, содержащих онкогены, гены клеточных рецепторов, гены ростовых факторов. Подобные изменения способны образовывать новые последовательности ДНК и появление новых свойств у клетки, образование специфического клона. Вторичные хромосомные аберрации появляются на стадии опухолевой прогрессии в результате изменений сформировавшегося клона. Причем схожие аберрации могут наблюдаться при различных вариантах лейкозов. Так, филадельфийская хромосома может выявляться как при острых, так и при хронических лейкозах.
Причины развития острого лимфобластного лейкоза у детей до сих пор точно не установлены, однако имеются данные о большом значении инфекционных заболеваний в младенческом возрасте, воздействию различных физических (например, рентгенодиагностика, лучевая терапия, ионизирующая радиация), действие химических мутагенов. При воздействию бензола, среди больных, получавших цитостатические иммунодепрессанты (имуран, циклофосфан, лейкаран, сарколизин, мустарген и ), биологических (вирусных) мутагенов на организм матери во время беременности. Доказана также связь между многими врожденными хромосомными аномалиями и развитием острого лейкоза.
Патогенез
В костном мозге, периферической крови и в других органах обнаруживаются опухолевые клетки типа лимфобластов с ШИК-положительными гранулами в цитоплазме, не дающие реакций на пероксидазу, эстеразы и не содержащие липиды.
В 2/3 случаев в опухолевых клетках обнаруживаются цитогенетические нарушения в виде полиплоидии, филадельфийской хромосомы и реципрокной транслокации между хромосомами.
Цитогенез острого лимфобластного лейкоза связан с предшественниками T- и B-лимфоцитов. На T-клеточные лейкозы в странах Европы приходится 10-15 % наблюдений. Преобладают B-клеточные лейкозы.
Руководствуясь иммунологическими фенотипами опухолевых клеток, выделяют несколько форм лимфобластного лейкоза, что имеет значение для выбора терапии и прогноза. Преобладающие B-лимфобластные лейкозы представлены ранним, промежуточным и поздним вариантами, отличающимися по экспрессии параглобулина CD10, поверхностного иммуноглобулина и активности терминальной диоксинуклеотидтрансферазы. Маркерами T-лимфобластного лейкоза являются антигены CD7 и T-рецепторов.
Симптомы
Различают два типа течения острого лимфобластного лейкоза: В-линейный и Т-линейный, в зависимости от типа клеток — лимфоидных предшественников.
Все лейкоциты в организме человека делятся на 2 типа — гранулоцитарные и агранулоцитарные (зернистые и незернистые), эти две группы, в свою очередь, подразделяются на эозинофилы, базофилы, нейтрофилы (гранулоцитарные), и лимфоциты (В- и Т-типа) и моноциты (агранулоцитарные). В процессе созревания и развития (дифференцировки) все клетки проходят несколько этапов, первым из которых является бластный этап (лимфобласты). Из-за поражения костного мозга опухолью, лимфоциты не успевают достаточно развиться для того, чтобы полноценно исполнять свои защитные функции. По большей части, при остром лимфобластном лейкозе поражаются В-лимфоциты (примерно в 85% случаев), отвечающие за образование антител в организме.
Клинические признаки острого лимфобластного лейкоза.
Синдром интоксикации — слабость, лихорадка, недомогание, потеря веса. Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией (менее 1500 нейтрофилов в 1 мкл).
Гиперпластический синдром — увеличение всех групп периферических лимфоузлов. Инфильтрация печени и селезенки приводит к их увеличению, что может проявляться болями в животе. Могут появиться боль и ломота в костях из-за лейкемической инфильтрации надкостницы и суставной капсулы и опухолевого увеличения объема костного мозга. При этом на рентгенограммах можно обнаружить характерные для лейкемической инфильтрации изменения, особенно в трубчатых костях, возле крупных суставов.
Анемический синдром — бледность, слабость, тахикардия, кровоточивость слизистых полости рта, геморрагический синдром на коже, бледность. Слабость возникает в результате анемии и интоксикации.
Геморрагический синдром связан как с тромбоцитопенией, так и с внутрисосудистым тромбозом (особенно при гиперлейкоцитозе) и приводит к появлению петехий, экхимозов на коже и слизистых, кровоизлияниям, мелене, рвоте с кровью.
У мальчиков может обнаруживаться инициальное увеличение яичек ( 5-30% случаев первичного ОЛЛ). Это безболезненные, плотные, одно- или двусторонние инфильтраты. Особенно часто это бывает при гиперлейкоцитозе и Т-клеточном варианте ОЛЛ.
Дыхательные нарушения, связанные с увеличение лимфоузлов средостения, которые могут привести к дыхательной недостаточности. Этот признак характерен для Т-линейного ОЛЛ.
Могут появиться кровоизлияния в сетчатку глаза, отек зрительного нерва. При офтальмоскопии могут обнаруживаться лейкемические бляшки на глазном дне.
Из-за сильно сниженного иммунитета любое повреждение кожи является очагом инфекции, могут появиться паронихии, панариции, инфицированные укусы насекомых и следы инъекций.
Достаточно редкими осложнениями могут являться поражения почек в результате инфильтрации (клинические проявления могут и отсутствовать) и выпотной перикардит из-за нарушения лимфооттока между эндокардом и эпикардом.
Боль в шейном отделе позвоночника. Высокая температура тела. Вялость. Изменение аппетита. Изменение веса. Истощение. Лейкоцитоз. Лимфоцитоз. Ломота в суставах. Ломота в теле. Нарушение терморегуляции. Общая потливость. Отсутствие аппетита. Потеря веса. Разбитость. Рвота. Слабость. Тошнота. Холодный пот.
Диагностика
Для постановки диагноза острого лимфобластного лейкоза содержание бластных клеток в костном мозге должно быть больше 30%. Если содержание бластных клеток в крови превышает 30%, диагноз может быть поставлен и без исследования костного мозга.
Лечение
Существует несколько различных способов лечения пациентов с взрослым ОЛЛ.
Некоторые способы лечения являются стандартными (применяются в настоящее время), а некоторые новые способы лечения проходят клинические испытание. Клиническое испытание — это исследовательское изучение, целью которого является улучшение стандартного способа лечения или получение информации о результатах новых способов лечения онкобольных. Если клинические испытания показывают, что новый способ лечения лучше, чем стандартный, новый способ лечения может впоследствии стать стандартным способом лечения. Пациенты также могут принимать участие в клинических испытаниях. В некоторых клинических испытаниях могут принимать участия только пациенты, которые не проходили никакого лечения.
Лечение взрослого острого лимфобластного лейкоза обычно проходит в два этапа.
Этапы лечение взрослого острого лимфобластного лейкоза:
Ремиссионо-индукционная терапия. Цель данного этапа лечения – уничтожить лейкозные клетки в крови и костном мозгу и достичь ремиссии.
Постремиссионная терапия. Это второй этап лечения. Начинается сразу, как только удается достичь ремиссии. Цель постремиссионной терапии – уничтожить оставшиеся лейкозные клетки, которые могут быть и не активными, но впоследствии могут начать расти и это приведет к рецидиву. Этот этап называется также продолжением ремиссионнной терапии.
Лечебно-профилактическая терапия центральной нервной системы обычно проводится на каждом этапе лечения. Из-за того, что химиотерапевтические препараты принимаются перорально или делаются инъекции внутривенно, лекарственное вещество часто не может уничтожить лейкозные клетки, попавшие в ЦНС – центральную нервную систему (мозг и спинной мозг). Лейкозные клетки находят «убежище» (прячутся) в центральной нервной системе. Интратекальная химиотерапия и радиационная терапия могут уничтожить лейкозные клетки, попавшие в ЦНС, и тем самым предотвратить рецидив заболевания. Такой вид лечения называется лечебно-профилактическая терапия ЦНС.
На сегодняшний день существует четыре стандартных способа лечения:
Химиотерапия.
Химиотерапия – способ лечения онкологических заболеваний сильнодействующими химиотерапевтическими препаратами. Химиотерапевтические препараты способны остановить и уничтожить рост раковых клеток, предотвратить их отделение и проникновение в другие ткани и органы. При химиотерапии лекарства могут приниматься перорально (в виде таблеток, капсул) или вводятся внутривенные или внутримышечные инъекции. Лекарственное вещество попадает в кровоток, распространяется по организму и поражает раковые клетки (систематическая химиотерапия). Если химиотерапевтические препараты вводятся непосредственно в позвоночник (интратекальная химиотерапия), орган или полость (например, брюшную), лекарственное вещество поражает главным образом раковые клетки в данных участках (региональная химиотерапия). Комбинированная химиотерапия – лечения, при котором используется более одного противоракового химиотерапевтического препарата. Способ применения химиотерапии зависит от вида и стадии онкологического заболевания.
Интратекальная химиотерапия может применяться при лечении взрослого ОЛЛ, который имеет тенденцию к распространению в мозг и спинной мозг. Терапия, применяемая во избежание распространения раковых клеток в организме и их проникновения в мозг или спинной мозг, называется лечебно-профилактическая терапия ЦНС. Интратекальная химиотерапия проводится в сочетании с обычной химиотерапией, при которой лекарственные препараты принимаются перорально или в виде инъекций.
Интратекальная химиотерапия. Противоопухолевые средства вводятся в интратекальную полость позвоночного канала, где находится цереброспинальная жидкость (ЦСЖ показана голубым на рисунке). Существует два разных способа введения химиотерапевтических препаратов. Первый способ, изображен в верхней части рисунка, лекарственный препарат вводиться в резервуаре Оммайя. (Выпуклый контейнер, который вводят в желудочки мозга. Контейнер удерживает основную часть лекарственного препарата, чтобы лекарственное вещество могло медленно поступать в мозг через маленькие трубочки). Другой метод, показан в нижней части рисунка, лекарственный препарат вводится непосредственно в цереброспинальную жидкость в позвоночный столб на уровне поясницы. Процедура проводиться под местным наркозом.
Лучевая терапия.
Лучевая терапия – это способ лечения онкозаболевания, при котором используются жесткое рентгеновское излучение или другие виды радиационных излучений для уничтожения раковых клеток или предотвращения роста раковых клеток. Существует два вида лучевой терапии. Лучевая внешняя терапия – специальный аппарат фокусирует радиационное излучение в области опухоли. Лучевая внутренняя терапия – применение радиоактивных веществ, герметично запакованных в иголки, капсулы, стержни или катетеры, которые размещаются непосредственно в или возле опухоли. Лучевая внешняя терапия может применяться для лечения взрослого ОЛЛ, который имеет тенденцию к распространению в мозг и спинной мозг. Это называется лечебно-профилактическая терапия ЦНС.
Химиотерапия с последующей трансплантацией стволовых клеток.
Перед трансплантацией стволовых клеток проводят химиотерапию. Трансплантация стволовых клеток применятся для замещения аномальных кровообразующих клеток полноценными. Стволовые клетки (незрелые клетки крови) берутся из крови или костного мозга пациента или донора, замораживаются и сохраняются. По завершении курса химиотерапии сохраненные стволовые клетки размораживают и вводят пациенту в виде инфузий стволовых клеток. Пересаженные стволовые клетки приживаются и помогают восстановить клетки костного мозга, продуцирующие клетки крови.
Терапия ингибитором тирозин киназы.
Противораковые лекарственные препараты, называемые ингибиторами тирозин киназы, используются для лечения некоторых видов взрослого ОЛЛ. Препарат блокирует фермент, тирозин киназа, который способствует развитию из стволовых клеток большого количества лейкоцитов (гранулоцитов или бластных клеток). На сегодняшний день применяются два таких препарата Иматиниб (Гливек) (imatinib mesylate) (Gleevec) и Дасатиниб.
Некоторые новые способы лечения проходят клинические испытания.
Этот раздел описывает виды лечения, которые находятся на стадии клинических испытаний. Невозможно рассказать обо всех новых способах лечения, которые изучаются. Информация о клинических испытаниях доступна на сайте NCI.
Биологическая терапия.
Биологическая терапия – это способ лечения, который задействует иммунную систему пациента в борьбе с онкологическим заболеванием. Вещества, которые вырабатываются в организме или которые синтезируются в лаборатории, используются для стимулирования или восстановления природных механизмов защиты и борьбы с онкозаболеваниями. Такой вид лечения онкозаболевания также называется биотерапией или иммунотерапией.
Пациенты также могут принимать участие в клинических испытаниях.
Для некоторых пациентов участие в клинических испытаниях — это наилучший выбор. Клинические испытания являются частью исследовательского процесса. Цель проведения клинических испытаний установить: является ли новый способ лечения безопасным и эффективным или более лучшим, чем стандартный способ лечения.
Многие из нынешних стандартных способов лечения основаны на результатах раннее проведенных клинических испытаний. Пациенты, принимающие участие в клинических испытаниях, могут получать стандартное лечение или проходить курс нового способа лечения.
Пациенты, которые принимают участие в клинических испытаниях, вносят большой вклад в исследования и помогают улучшить способ лечения рака в будущем. Даже, если результаты клинических испытаний не свидетельствуют об эффективности нового способа лечения, но они часто дают ответы на очень важные вопросы и помогают продвигать исследования на шаг вперед.
Пациенты могут участвовать в клинических испытаниях перед, во время и после того, как они начали проходить курс лечения.
В некоторых клинических испытаниях могут принимать участие только пациенты, которые не проходили никакого лечения. Пациенты, у которых заболевание не поддается лечению, также могут участвовать в клинических испытаниях. Существуют также клинические испытания, которые исследуют новые способы предотвращения рецидива или устранения побочных эффектов, возникающих вследствие лечения рака.
Проведение повторного обследования.
Некоторые анализы, которые были сделаны для диагностики рака или стадии или формы заболевания могут быть сделаны повторно. Иногда анализы проводятся повторно, чтобы проследить за эффективностью лечения. Решение о продолжении, изменении или прекращении лечения основывается на результатах этих анализов.
Некоторые анализы необходимо делать время от времени и после окончания лечения. Результаты анализов могут показать изменение состояния пациента или наличие рецидива заболевания. Иногда такие анализы называют контрольными.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
Рубрика МКБ-10: C91.0
МКБ-10 / C00-D48 КЛАСС II Новообразования / C00-C97 Злокачественные новообразования / C81-C96 Злокачественные новообразования лимфоидной, кроветворной и родственных им тканей / C91 Лимфоидный лейкоз лимфолейкоз
Определение и общие сведения[править]
Острые лейкозы (ОЛ) — группа опухолевых заболеваний системы крови (гемобластозов), для которых характерно первичное поражение костного мозга опухолевыми (бластными) кроветворными клетками с вытеснением ими нормальных элементов гемопоэза.
Эпидемиология
Среди гемобластозов ОЛ занимают одно из первых мест по частоте встречаемости. Заболеваемость ОЛ составляет 5-6 случаев на 100 000 населения в год, 6-7% от всех злокачественных новообразований.
У взрослых соотношение миелоидных и лимфоидных лейкозов составляет приблизительно 6:1, в детском возрасте 80-90% всех острых лейкозов приходится на лимфобластные формы, а после 40 лет наблюдают обратное соотношение — у 80% больных острым лейкозом диагностируют миелоидный вариант заболевания.
Лейкозы подразделяют на острые и хронические.
Классификация
В настоящее время наиболее распространена морфологическая классификация острых лейкозов, предложенная франко-американо-британской группой в 1976 г., пересмотренная и дополненная в 1991 г. (классификация FAB). В 2001 г. FAB-классификация стала составной частью классификации ВОЗ, предложенной международной группой экспертов. По классификации ВОЗ острые лейкозы характеризуются в соответствии c морфоцитохимическими реакциями бластных клеток, с учетом их генотипа, иммунофенотипа, возникновения после предшествующей химиорадиотерапии. ОМЛ в этой классификации подразделяется на 4 категории:
1. ОМЛ, ассоциированный со стабильно выявляемыми транслокациями;
2. ОМЛ с мультилинейной дисплазией;
3. ОМЛ после предшествующей химиотерапии;
4. Другие формы ОМЛ.
Острые лимфобластные лейкозы (ОЛЛ) в новой классификации ВОЗ рассматривают в разделе опухолей из предшественников Т- и В-лимфоцитов. По классификации ВОЗ в разделе лимфатических опухолей из ранних предшественников представлены:
• лимфобластный лейкоз/лимфома из В-предшественников (синоним «острый лимфобластный лейкоз из предшественников В-клеток»);
• лимфобластный лейкоз/лимфома из Т-предшественников (синоним «острый лимфобластный лейкоз из предшественников Т-клеток»).
Третья форма ОЛЛ по FAB-классификации в современной классификации отнесена в большой раздел опухолей из фенотипически зрелых В-клеток как беркиттоподобный лейкоз/лимфома.
Основные варианты острых лейкозов:
• острый миелобластный недифференцированный лейкоз (М0 по FAB);
• острый миелобластный лейкоз без созревания (М1 по FAB);
• острый миелобластный лейкоз с созреванием (М2 по FAB);
• острый промиелоцитарный лейкоз (М3 по FAB);
• острый миеломонобластный лейкоз (М4 по FAB);
• острый монобластный лейкоз (М5 по FAB);
• острый эритробластный лейкоз (М6 по FAB).
Вследствие мутации в генетическом материале клоногенной кроветворной клетки при отсутствии дифференцировки возникает бесконтрольная пролиферация и накопление патологических клеток. Обнаружение различных хромосомных аберраций при ряде врожденных заболеваний [синдром Эллиса-Ван-Кревельда, анемия Фанкони, синдром Вискотта-Олдрича, синдром Клайн-фелтера, нейрофиброматоз (болезнь Реклингхаузена) и т.д.] подтверждает, что патогенез острых лейкозов связан с генетическими поломками.
Прямое доказательство вирусного происхождения острых лейкозов у взрослых получено лишь для Т-клеточного лейкоза/лимфомы взрослых, вызванного вирусом HTLV-1. Доказана взаимосвязь между дозой ионизирующей радиациии и использованием химио/радиотерапии по поводу других опухолей и возникновением острых лейкозов.
Этиология и патогенез[править]
Клинические проявления[править]
В течении острых лейкозов выделяют:
• первый острый период (дебют или манифестация);
• ремиссии;
• рецидивы.
Клиническая картина при различных формах острых лейкозов схожа, в основном ее проявления связаны с замещением нормальной гемопоэтической ткани опухолевыми клетками, инфильтрацией ими различных органов. Дебют острого лейкоза может быть острым с высокой лихорадкой, резкой слабостью, интоксикацией, кровоточивостью, присоединением тяжелых инфекций. Часто диагноз устанавливают случайно, пожилых пациентов нередко госпитализируют в связи с возникновением или усугублением стенокардии, нарушений ритма сердца на фоне дебюта острого лейкоза. В клинической картине обнаруживается лимфаденопатия, гепатоспленомегалия, гиперплазия десен, геморрагический синдром различной степени тяжести, оссалгии и артралгии, возможны неврологическая и менингеальная симптоматика, лейкозная инфильтрация периферических нервов с разнообразными двигательными и чувствительными нарушениями. При глубокой гранулоцитопении возникают язвенно-некротические поражения слизистой оболочки полости рта, пищевода, кишечника, признаки общей интоксикации. К экстрамедуллярным поражениям при острых лейкозах относят поражения сетчатки, яичек, яичников, кожи (лейкемиды), мягких тканей (миелоидная или гранулоцитарная саркома), легких, сердечной мышцы.
В анализах крови изменения варьируют от трехростковой цитопении до форм с гиперлейкоцитозом и тотальной бластемией.
Острый лимфобластный лейкоз
Самая распространенная опухоль кроветворной ткани у детей. При формах с гиперлейкоцитозом, которые не сопровождаются, в отличие от ОМЛ, церебральной и легочной недостаточностью, выявляется значительная лимфаденопатия и гепатоспленомегалия. Характерны высокий уровень ЛДГ, гиперурикемия, гиперфосфатемия, гиперкальциемия, часта нейролейкемия.
Острый лимфобластный лейкоз: Диагностика[править]
Диагностика острых лейкозов базируется на оценке морфологических особенностей клеток костного мозга и периферической крови (обнаружение бластных клеток). Для установления варианта острого лейкоза и определения прогностических групп выполняются цитохимическое исследование, ИФТ, цитогенетическое и молекулярно-биологическое исследования.
ИФТ острых лейкозов позволяет определять линейную принадлежность бластных клеток и этап дифференцировки. Обнаружение на клетке одномоментной экспрессии антигенов, в норме вместе не встречающихся, указывает на ее аберрантный (лейкемический) иммунофенотип. Выделение при ИФТ по меньшей мере 6 подтипов ОЛЛ привело к разработке дифференцированных программ лечения ОЛЛ и позволило добиться значительных успехов в лечении. К антигенам, определяемым на клетках лимфоидной принадлежности, относят CD1-5, CD7-10, CD19-20, CD22, CD23, CD56, CD57, CD79а; миелоидной — CD11, CD13, CD14, CD15, CD33, CD36, CD41, CD42, CD65, HLA-DR; антигеном ранних клеток-предшественниц считают CD34.
Цитогенетическая характеристика острых лейкозов
Практически у 90% больных острыми лейкозами находят цитогенетические аномалии (транслокации, делеции, инверсии, гиперплоидию, исчезновение одной из пары хромосом и т.д.), что позволило классифицировать острые лейкозы и выделить их отдельные формы. Определение цитогенетических маркёров заболевания принципиально важно как для терапии, так и для прогноза течения острого лейкоза.
Целый ряд транслокаций при ОМЛ [t(8;21), t(15;17), inv16] составляют группы благоприятного прогноза, для которых созданы программы дифференцированного лечения, позволяющие достигать длительной безрецидивной выживаемости. При ОЛЛ к неблагоприятным в прогностическом отношении аномалиям ка-риотипа относятся t(9;22), t(4;11).
Дифференциальный диагноз[править]
Проведение дифференциальной диагностики необходимо при метастазировании в костный мозг лимфосарком, некоторых солидных опухолей. В любом случае диагноз устанавливают только на основании комплексного анализа (морфология, цитохимия, ИФТ, цитогенетика) бластных клеток.
Острый лимфобластный лейкоз: Лечение[править]
Основная цель лечения острых лейкозов — эрадикация лейкемического клона и восстановление нормального кроветворения. Основополагающие принципы химиотерапии (ХТ) острых лейкозов:
• принцип дозоинтенсивности, т.е. использование адекватных доз цитостатических препаратов в сочетании с четким соблюдением временных межкурсовых интервалов;
• использование сочетания цитостатических средств с целью получения наилучшего эффекта;
• принцип этапности терапии. Основные этапы терапии острых лейкозов:
• индукция ремиссии;
• консолидация;
• поддерживающая терапия;
• профилактика нейролейкемии (для некоторых вариантов ОЛ).
Цель индукции ремиссии (период начального лечения) — максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии. В настоящее время консолидация — наиболее агрессивный этап лечения острых лейкозов, задачей которого является полная эрадикация лейкемического клона. Длительность и интенсивность поддерживающей терапии при разных вариантах ОЛ варьирует, но принцип ее одинаков для всех видов ОЛ — продолжение цитостатического воздействия на возможно остающийся опухолевый клон. Профилактика нейролейкемии — принципиальный этап в лечении лимфобластных, миеломоно- и монобластных вариантов ОЛ, промиелоцитарного ОЛ, для форм ОЛ, протекающих c гиперлейкоцитозом и большой средостенной опухолью в дебюте заболевания. Профилактику нейролейкемии распределяют на все периоды программного лечения: индукцию ремиссии, консолидацию и поддерживающее лечение.
Методы нейропрофилактики и терапии нейролейкемии:
• интратекальное введение химиопрепаратов;
• лучевая терапия;
• системное использование высоких доз метотрексата и цита-рабина.
Основной метод нейропрофилактики — интратекальное введение трех препаратов (метотрексата, цитарабина, дексаметазона). Лечение нейролейкемии осуществляют по общим законам как для ОЛЛ, так и для ОНЛЛ. На 1-м этапе — спинномозговые пункции 1 раз в 2-3 дня до нормализации показателей цереброспинальной жидкости и получения как минимум трех нормальных люмбальных пунктатов. Затем пункции в течение 3 мес проводятся с частотой 1 раз в 2 нед. При специфическом поражении оболочек и/или вещества головного мозга интратекальное введение препаратов дополняют в ряде случаев краниоспинальным облучением в дозе 18-24 Гр. Альтернативная схема профилактики нейролейкемии — системное введение цитарабина в высоких дозах (1-3 г/м2).
Общепризнанной программой полихимиотерапии при острых нелимфобластных лейкозах является сочетание цитарабина и даунорубицина по схеме «7 + 3» (ежедневное в течение 7 дней введение цитарабина по 100 мг/м2 2 раза в сутки и даунорубицина по 45 мг/м2 в течение первых трех дней). Большинство авторов для консолидации и поддерживающей терапии используют те же курсы, что и для индукционной терапии. Однако применение курса «НАМ» (высокие дозы цитарабина и митоксантрон) в качестве консолидации позволяет значительно улучшить результаты лечения. При этом «НАМ» (цитарабин 3000 мг/м2 каждые 12 ч в первые 1-3 дня курса, митоксантрон 10 мг/м2 в 3-5-й дни курса) используют как 2-ю индукцию, если ремиссия не была достигнута после 1-го курса индукции по программе «7 + 3». После курса «НАМ» выполняют консолидацию высокодозным цитарабином (цитарабин 3000 мг/м2 каждые 12 ч в 1-й, 3-й, 5-й дни курса). Терапия ОЛ, протекающих с гиперлейкоцитозом, проводится по программам, предусмотренным для конкретного варианта лейкоза, в соответствии с возрастом больного и иммунофенотипом/генотипом опухолевых клеток. Обязательно применение аллопуринола, гидратации. Циторедуктивную предфазу проводят в зависимости от конкретного варианта ОЛ. При лейкоцитозе выше (70-100)х109/л до подтверждения варианта ОЛ рекомендован гидроксикарбамид в дозе 100 мг/кг в сутки. При появлении на фоне гиперлейкоцитоза синдрома лейкостазов (нарушение сознания, одышка, поражение легких, ОПН) наряду с приемом гидроксикарбамида и гидратацией используют лейкаферез. ХТ начинают не откладывая, если после лейкафереза лейкоцитоз уменьшился и улучшилась клиническая симптоматика. Параллельно с проведением полихимиотерапии рекомендованы плазмаферезы, особенно при развитии синдрома лизиса опухоли.
Основополагающее правило при лечении ОПЛ состоит в сочетанном применении полного изомера трансретиноевой кислоты (ATRA) — весаноида — и антрациклиновых антибиотиков с цитарабином или без него. ATRA назначают всегда при малейшем клиническом подозрении на ОПЛ (морфология бластных клеток, геморрагический синдром, низкие показатели протромбина и фибриногена). Индукция ремиссии требует массивной заместительной гемотрансфузионной терапии (тромбоцитные концентраты, свежезамороженная плазма). Всем больным ОПЛ может быть рекомендована программа AIDA. Включение цитарабина в схему лечения ОПЛ может быть показано для больных с исходным лейкоцитозом >10 x 109/л. Всем больным независимо от исходного лейкоцитоза курс ХТ должен быть начат не позднее 3-го дня от начала приема ATRA. Больным с числом лейкоцитов >10 χ 109/л курс химиотерапии с цитостатическими препаратами начинают одномоментно с назначением ATRA. При исходном гиперлейкоцитозе (особенно если число лейкоцитов >50 χ 109/л) на фоне проведения полихимиотерапии целесообразно выполнение плазмообмена, позволяющего профилактировать синдром лизиса опухоли и корригировать коагуляционные расстройства. При малейшем подозрении на развитие ретиноидного синдрома (одышка, фебрильная лихорадка, отечный синдром, почечно-печеночная недостаточность) назначают дексаметазон 10 мг/м22 2 раза в сутки в течение 3 дней, при этом отмены ATRA обычно не требуется. Однозначных рекомендаций по выполнению аутологичной трансплантации гемопоэтических стволовых кроветворных клеток (ГСКК) больным ОНЛЛ нет. Ее можно рассматривать в качестве высокодозной альтернативы для больных в 1-й ремиссии. На основании анализа результатов применения аллогенной трансплантации ГСКК даны четкие рекомендации по целесообразности ее выполнения больным в 1-й ремиссии.
Единого мнения о терапии рецидивов и резистентных форм ОНЛЛ не выработано. Большинство программ ХТ основаны на использовании цитарабина в дозах, превышающих стандартные (500-3000 мг/м2), в сочетании с антрациклинами (митоксантрон 10-12 мг/м2 в сутки 3 дня; идарубицин 12 мг/м2 в сутки 3 дня). Всех больных с достигнутой 2-й полной ремиссией следует рассматривать как потенциальных кандидатов на выполнение трансплантации аллогенных ГСКК. Для лечения рецидива ОНЛЛ, развившегося после аллогенной трансплантации ГСКК, применяют переливание лимфоцитов донора с целью индукции эффекта «трансплантат против лейкоза».
Лечение острого лимфобластного лейкоза
Общие принципы терапии ОЛЛ:
• использование сочетания 5 или более цитостатических средств;
• профилактика нейролейкемии;
• высокодозная консолидация;
• длительная поддерживающая терапия.
Факторы, определяющие принадлежность больного к группе высокого риска:
• лейкоцитоз в дебюте заболевания для В-клеточного ОЛЛ >30х109/л;
• лейкоцитоз в дебюте заболевания для Т-клеточного ОЛЛ >100х109/л;
• достижение ремиссии более чем за 4 нед;
• иммунофенотип — ранний пре-В- и ранний Т-вариант;
• цитогенетические/молекулярные маркёры — t(9;22), или транскрипт bcr/abl; t(4;11), или транскрипт MLL-AF4; множественные хромосомные аберрации.
В большинстве клиник при лечении ОЛЛ за основу принимается немецкий протокол. После 7-дневной предфазы преднизолоном в дозе 60мг/м2 следует 8-недельная двухфазная индукция, включающая несколько цитостатических препаратов (винкристин, даунорубицин, аспарагиназу, глюкокортикоидные гормоны, циклофосфамид, меркаптопурин, цитарабин). Курсы консолидации проводят в соответствии с факторами риска, для ряда больных предусмотрена высокодозная консолидация по программе RACOP. Реиндукционная терапия продолжительностью 6 нед включает ХТ-препараты, использующиеся в курсе индукции. Поддерживающая терапия проводится в течение 2 лет, включает ротирующие курсы RACOP, COMP, COAP.
Долгосрочные результаты лечения Ph-позитивных ОЛЛ остаются крайне неудовлетворительными. Добавление иматиниба значительно улучшило результаты лечения, и в настоящее время комбинированную (полихимиотерапия + иматиниб) терапию следует рассматривать как этап подготовки к аллогенной (родственной и неродственной) трансплантации ГСК.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Онкология [Электронный ресурс] : Национальное руководство. Краткое издание / под ред. В.И. Чиссова, М.И. Давыдова — М. : ГЭОТАР-Медиа, 2014. — https://www.rosmedlib.ru/book/ISBN9785970431535.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
- Аспарагиназа
- Блинатумомаб
- Винкристин
- Дазатиниб
- Даунорубицин
- Доксорубицин
- Идарубицин
- Иматиниб
- Инотузумаб озогамицин
- Клофарабин
- Меркаптопурин
- Метотрексат
- Неларабин
- Пэгаспаргаза
- Циклофосфамид
- Цитарабин
Источник
