Легочная гипертензия и синдром дауна
Синдром Дауна (трисомия 21) — наиболее типичная врожденная аномалия, с частотой 1,6 на 1000 родов. Анестезия и операции сопровождаются более высокой летальностью, чем в общей популяции населения.
В дополнение к характерным внешним чертам и нарушениям общего развития, синдром Дауна сопровождается нарушениями работы многих органов и систем:
- Врожденные пороки сердца (до 40%) — в основном дефекты эндокарда и межжелудочковой перегородки.
- Синдром Эйзенменгера (легочная гипертензия в сочетании с право-левым шунтом) может осложнять периоперационное ведение детей старшего возраста, особенно при сочетании с обструктивным апноэ во сне.
- Рецидивирующие инфекции дыхательных путей вследствие относительного иммунодефицита и той или иной степени обструкции верхних дыхательных путей (тонзиллярная/аденоидная гипертрофия).
- Атлантоаксиальная нестабильность (до 30% пациентов) — тенденция к подвывиху/дислокации вследствие аномальности костей атланта и аксиса и слабости поперечной связки атланта.
- Эпилепсия (до 10% пациентов).
- Ожирение и потенциально затрудненный венозный доступ.
- Тщательная оценка потенциально трудных поддержания проходимости верхних дыхательных путей и интубации (относительно большой язык, плотные и увеличенные структуры передней части лица, высокая и узкая арка неба, микрогнатия, короткая толстая шея).
- Кардиореспираторное обследование на наличие признаков и симптомов врожденных пороков сердца, легочной гипертензии и инфекций дыхательных путей.
- Симптомы атлантоаксиальной нестабильности (ненормальная походка, неуклюжесть, гиперрефлексия, клонус, геми/тетрапарезы, нейрогенный мочевой пузырь, атаксия, и потеря чувствительности). Следует иметь в виду, что атлантоаксиальная нестабильность часто бессимптомна.
Пациенты обычно уже бывают подробно обследованы педиатрами:
- Клинический анализ крови (случаи полицитемии и лейкемии в 20 раз чаще, чем в популяции населения в целом). Мочевина, электролиты и функциональные тесты щитовидной железы (гипотиреоидизм — до 40%).
Предоперационные исследования в зависимости от клинических находок и планируемой операции:
- ЭКГ — как правило.
- Рентгенография грудной клетки — при наличии кардиореспираторных проблем
- Эхокардиография — при наличии признаков и симптомов, заставляющих думать о пороке сердца.
- Рентгенография шейного отдела позвоночника в боковой проекции показана только при наличии неврологических признаков и симптомов, не позволяющих считать рутинный скрининг достаточным.
- Оптимизируют функцию сердца и легких.
- Порог показаний для планирования места в ОРИТ снижен вследствие высокой частоты послеоперационных осложнений.
- Пациенты часто малоконтактны, и для предотвращения борьбы во время индукции часто полезна седативная премедикация, например, мидазолам орально (0,5 мг/кг) или темазепам (0,5 мг/кг) в более старшей возрастной группе. Дополнительная осторожность при наличии обструктивных проблем верхних дыхательных путей.
- Устанавливают контакт с родителями или опекунами.
- Если планируется внутривенная индукция — применяют EMLA/крем аметоп.
- Полезна ингаляционная индукция севофлюраном/галотаном, особенно у малоконтактных пациентов с затрудненным венозным доступом. Один из методов выбора — кетамин в/м (5-10 мг/кг).
- Подсушивающие препараты могут быть полезны при проблематичной гиперсаливации. Необходима осторожность при применении атропина, так как есть сообщения об усилении чувствительности как к мидриазу, так и к воздействию на сердце. Следует уменьшить дозу или применить альтернативный препарат, например, гликопирролат.
- Часто встречается желудочно-пищеводный рефлюкс. При наличии соответствующих симптомов назначают рефлюкс-профилактику (ранитидин).
- Потенциально трудны интубация и поддержание проходимости дыхательных путей.
- Следует избегать избыточных движений шеей, особенно во время ларингоскопии или укладке пациента для операции.
- У детей с синдромом Дауна чаще обычного встречаются стенозы подсвязочного пространства — нередко нужна трахеальная трубка размером меньше рассчитанного по возрасту.
- Каких-либо извращенных реакций на анестетики до настоящего времени не выявлено.
- Склонны к гиповентиляции, поэтому ИВЛ предпочтительнее спонтанного дыхания.
- Профилактику антибиотиками пороков сердца следует выполнять при прогнозируемой бактериемии.
- Строгая асептика связана с относительным иммунодефицитом и повышенной чувствительностью к инфекциям.
- Общая настороженность — часты случаи гепатита В и С.
- Послеоперационное обезболивание может быть проблематичным. Предпочтительны региональные методики, у адекватных пациентов возможно применение АКП.
- Пациентов с тяжелым течением после больших операций следует вести в условиях ОРИТ.
- Родители/опекуны в комнате пробуждения незаменимы, так как пациенты с синдромом Дауна часто после операции возбуждены и вести их трудно.
- Сопутствующая гипотония (до 75%) может изменять способность поддерживать проходимость дыхательных путей после анестезии — за пациентом необходимо тщательно наблюдать.
- Пациенты предрасположены к ателектазированию и инфекциям дыхательных путей, особенно после абдоминальных и торакальных операций — необходимы увлажненный кислород, регулярная физиотерапия, адекватная анальгезия и пристальный мониторинг.
- Длительность ИВЛ после операции, пребывания в ОРИТ и в госпитале обычно длиннее, чем у основной популяции населения.
Синдром Дауна и другие заболевания
В течение первых месяцев жизни, некоторые из расстройств и нарушений могут быть выявлены сразу. Например, врожденный гипотиреоз — заболевание щитовидной железы, характеризуется сниженным метаболизмом, нарушениями в нервной системе человека, часто имеется у детей с синдромом Дауна. Для выявления этого заболевания врачи берут анализы крови у новорожденного ребенка.
Также могут присутствовать некоторые из таких нарушений, как потеря слуха и зрения, врожденные патологии сердца.
По данным исследований выяснилось, что у 66-89% детей больных синдромом Дауна наблюдается потеря слуха на 15-20 децибел, по крайней мере, на одно ухо, из-за того, что внешнее ухо и косточки среднего уха развиваются по-разному у детей с синдромом Дауна. Многие проблемы, связанные со слухом можно корректировать. Кроме проблем со слухом, у детей также может наблюдаться различные нарушения зрения. Катаракта возникает примерно в 3 % случаев у детей с синдромом Дауна, но она может вылечена хирургическими методами.
Примерно у половины детей с синдромом Дауна наблюдаются врожденные пороки сердца, легочная гипертензия (высокое давление в легких). Врач назначает проведение эхокардиографии, чтобы выявить наличие врожденной патологии сердца.
Эпилептические припадки, менее распространены у детей с синдромом Дауна, все же 5-13% детей и взрослых подвержены этому, у них в 10 раз риск выше, чем у здорового населения. Большая вероятность конвульсий у детей младше одного года. Однако такие приступы можно лечить при помощи антиэпилептических препаратов.
У детей с синдромом Дауна часто наблюдается возникновение мышечной гипотонии или слабого мышечного тонуса. Т.к. у таких детей сниженный мышечный тонус, вытянутый большой язык, то, как правило, кормление такого ребенка затягивается и происходит сложнее, чем у обычных детей. Матерям, у которых ребенок болен синдромом Дауна, и которые кормят грудью, следует обратиться к врачу, чтобы убедиться, что ребенок получает достаточное количество питательных веществ.
Гипотония влияет не только на мышечный тонус, но и на пищеварительную систему, поэтому у ребенка может возникнуть запор. Также у некоторых детей с синдромом Дауна может быть нестабильность первых шейных позвонков, из-за этого на позвоночник может быть излишнее давление.
Младенцы и дети дошкольного возраста
Медицинский уход и забота за детьми больными синдромом Дауна должны быть такими же, как и за нормальными детьми в первые годы жизни. Если врач обнаружил некоторые заболевания, например, врожденную патологию сердца, нарушение пищеварения, то следует контролировать эти проблемами в дальнейшем.
В течение первых лет жизни у детей с синдромом Дауна в 10-15 раз больше вероятность заболеть лейкемией — смертельным заболеванием. Таким детям требуется лечение рака, например, химиотерапия.
По сравнению с общими показателями для населения, у детей с синдромом Дауна в 10 раз чаще случаются смертельные исходы от инфекционных заболеваний, если вовремя не обнаружить и не начать лечение этих заболеваний.
У детей с синдромом Дауна наблюдается задержка развития. У таких детей замедленная реакция на все стимулы. Это возникает из-за того, что у ребенка слабый мышечный тонус, он не может правильно стоять или смотреть. Также наблюдается очень большие задержки в развитии речи. Однако у детей с синдромом Дауна вырабатываются определенные коммуникативные навыки, которые им помогают в общении.
Родителям детей с синдромом Дауна следует знать, что у их детей есть способности и таланты, которые развиваются по своему, определенному темпу. Развитие у таких детей определенных способностей — лишь вопрос времени. Родителям не следует сравнивать способности своего ребенка больного синдромом Дауна с его сверстниками или другими детьми, которые больны синдромом Дауна.
Ранее вмешательство и образование
Оценка проведения ранних терапевтических программ для детей с синдромом Дауна является сложным процессом, из-за широкого спектра экспериментальных методов, которые применяются для проведения различных видов терапий, ограниченного числа мер, огромных различий в процессе развития ребенка и других медицинских факторов. Проводилось множество исследований для оценки эффектов раннего вмешательства, но все еще недостаточно информации для оценки результатов лечения.
Существуют федеральные законы, согласно которым определяется, что дети с ограниченными возможностями имеют доступ к бесплатному получению образования и другим услугам для удовлетворения своих потребностей. Решение, какую школу должен посещать ребенок — это важное решение, и это решение должно быть принято родителями и согласовано с другими экспертами. Родители должны решить, в какую школу пойдет их ребенок: в ту, где большинство детей здоровы, или отправить ребенка в специальную школу для больных детей. В последние годы, все чаще принимается первое решение: ребенка отправляют в обычную школу, где учатся здоровые дети.
Раздел 2 Педиатрия
астма, атопический дерматит) — 101 пациент (47,6%). Большая часть патологии в п/гр.2 — психосоматические — 55,6%, и нервно-психические (28,7%) заболевания; в п/гр.1 — ОРИ, о. бронхит, пневмония — 77,5%. В ГН чаще встречались аритмии, обусловленные нарушением автоматизма синусового узла (НАСУ) — у 72,2%: нестабильный синусовый ритм (НСР) у 58,8%, синусовая тахи- (20,9%) и брадикардия (12,4%), нестабильный правопредсердный (НППР) — 4,6%, миграция источника ритма в пределах предсердий у 12,4% детей. СРРЖ 23,1%, блокады 27,4% (в/желудочковые
— 89,7%, а-вентрикулярные — 19%), экстрасистолия
— 4,2% (суправентрикулярная — 77,8%), укороченный PQ — 2,4%, синдром WPW 0,5%. Выявленные тенденции сохранялись у детей с LQTS+МАРС. В ГК НСРП выявлены у 12,5%: обусловленные НАСУ у 60% детей: НСР 60%, НППР 20%. СРРЖ — 20%, укороченный PQ — 5%, неполная блокада правой ножки п. Гиса
— 60%. УЗИ сердца проведено 28,8% детей ГН: проявления ДСТС обнаружены у 85,2%. Ср. число проявлений ДСТ на 1 ребенка -1,53. У детей с LQTS+ДСТС, преобладали МАРС — 96,2%: ДХЛЖ — 78% (56,4%
— изолированные); ПМК — у 24%; ФОО 16%. ВПС у 5,8% (ДМПП); ВПС+МАРС — у 6,4%.
Выводы: У детей с LQTS часто встречается ДСТС (чаще МАРС, из них чаще — ДХЛЖ). НРСП у детей с LQTS встречаются чаще, чем у здоровых детей (с преобладанием аритмий обусловленных НАСУ; СРРЖ, в/ желудочковых блокад). Не получено подтверждения о наличии положительной взаимосвязи между LQTS, степенью и характером нарушения ритма сердца и особенностями МАРС.
ЭХО-КАРДИОГРАФИЧЕСКИЕ ПОКАЗАТЕЛИ ПРАВЫХ ОТДЕЛОВ СЕРДЦА ПРИ ЛЕГОЧНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ НА ФОНЕ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА У ДЕТЕЙ
Цель. Изучить клинические и ЭХО-кардиографические проявления вторичной легочной артериальной гипертензии для определения ведущих клинико-функциональных показателей при наблюдении детей с врожденными пороками сердца. Материалы и методы: Клинические проявления вторичной легочной артериальной гипертензии П-ГУ функционального класса оценивались у 32 пациентов в возрасте от 3 до 18 лет с врожденными пороками сердца. ЭХО-кардиографические показатели включали параметры левых и правых отделов сердца, в том числе скоростные показатели транстрикуспидального кровотока, пиковую систолическую скорость движе-
ния трикуспидального кольца, индекс Тея. Функциональный класс заболевания определялся по результатам теста с 6-минутной ходьбой. Степень легочной гипертензии подтверждалась измерением легочного сосудистого сопротивления при зондировании полостей сердца. Статистическая обработка проводилась с помощью программы Статистика 6, данные представлены в виде медианы, значений 25-го и 75-го перцен-тилей. Достоверность различий показателей между группами определялась методом Манна-Уитни. Результаты. Клинические проявления у детей с тяжелой ЛАГ выражались диффузным цианозом кожи и слизистых, ортопноэ, одышкой в покое, болями за грудиной, изменением концевых фаланг пальцев, отеками на ногах. ЭХО-кардиографические проявления у пациентов с тяжелой ЛАГ проявились расширением правых отделов сердца — индекс ПП 23,16 (20;32) мл/м2, индекс ПЖ в м-режиме 21,48(17.4;27,13) мл/ м2, что значительно превысило показатели здоровых детей (р=0,00), и достоверно отличалось от пациентов с умеренной легочной гипертензией (р=0,004 и 0,019 соответственно). Функциональные показатели правых отделов сердца у пациентов с тяжелой ЛАГ выявили снижение ФИП ПЖ до 53% (в контрольной группе ФИП ПЖ = 64%, р=0,00), Е/А=1,00 (0,78;1,24) — значительно снижено по сравнению с контролем — 1,79 (1,7;1,9) (р=0,00). Многие показатели правых отделов сердца у пациентов с умеренной легочной гипертен-зией значимо не отличались от контроля, р 0,05). Обсуждение. У пациентов с выраженной легочной артериальной гипертензией имеются яркие клинические проявления заболевания, снижена толерантность к физической нагрузке, что коррелирует со статистически значимыми нарушениями со стороны правых отделов сердца, отражающих расширение правых камер, нарушение функциональных показателей по рестриктивно-му типу. У пациентов с II функциональным классом нарушение правых отделов сердца носит избирательный характер, а выраженность их отражает умеренный характер легочной гипертензии. Показатели левых отделов сердца не отражают тяжесть состояния пациентов с ЛАГ на фоне врожденных пороков сердца. Выводы. Структурные и функциональные показатели правых отделов сердца характеризуют ремоделирование миокарда у пациентов с легочной артериальной гипер-тензией, по выраженности отклонений этих показателей можно судить о прогрессировании легочной гипертен-зии у пациентов с врожденными пороками сердца.
КЛИНИКО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ВТОРИЧНОЙ ЛЕГОЧНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ НА ФОНЕ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА У ДЕТЕЙ С СИНДРОМОМ ДАУНА
Емельянчик Е.Ю., Салмина А.Б., Вольф Н.Г.
РОССИЙСКИЙ ВЕСТНИКПЕРИНАТОЛОГИИ И ПЕДИАТРИИ, 4, 2015
ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ В ПЕДИАТРИИ И ДЕТСКОЙ ХИРУРГИИ
Введение. Около половины детей с синдромом Дауна имеют врожденные пороки сердца. При отсутствии своевременной оперативной коррекции врожденного порока сердца с перегрузкой малого круга кровообращения развивается высокая легочная артериальная гипертензия. Изучение особенностей течения легочной артериальной гипертензией у детей с синдромом Дауна позволит улучшить их качество жизни. Цель исследования. Изучить клинико-лабораторные и функциональные проявления легочной артериальной гипертензии при врожденных пороках сердца у детей с синдромом Дауна.
Источник
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
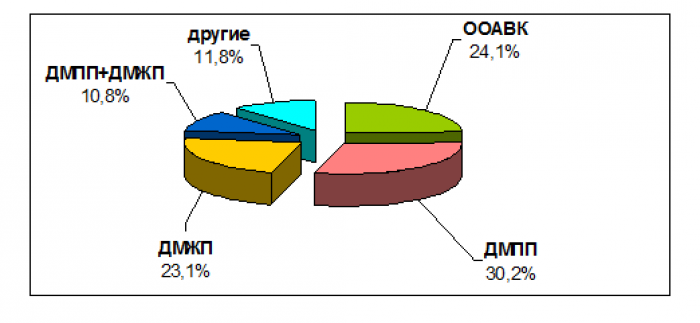
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
