Лечение синдрома диабетической стопы pdf
1. 2015 Клинические рекомендации «Синдром диабетической стопы» (Общественная организация Российская ассоциация эндокринологов (РАЭ), Московская ассоциация хирургов).
Жалобы и анамнез
- При сборе анамнеза рекомендуется обратить внимание на длительность течения сахарного диабета (СД), наличие других поздних осложнений этого заболевания.
Класс рекомендаций I (уровень доказанности А)
Комментарии:
Необходимо помнить, что СД 2 типа – скрытое, малосимптомное заболевание, которое часто диагностируется при обследовании пациента с уже развившимся тяжелым гнойно-некротическим поражением стопы. Также при сборе анамнеза необходимо обратить внимание на наличие сопутствующих, непосредственно не связанных с СД заболеваний, которые могут влиять на скорость заживления раневых дефектов (сердечная и дыхательная недостаточность, онкологические заболевания, алиментарная недостаточность, терапия глюкокортикоидами и иммуносупрессантами).
Физикальное обследование
- Рекомендуется использовать для первичного диагностического поиска, особенно в условиях амбулаторной практики, простейший метод определения диабетической макроангиопатии – пальпаторную оценку пульсации тыльной артерии стопы (передней большеберцовой) и задней большеберцовой артерии.
Класс рекомендаций II (уровень доказанности В)
Комментарии:
Пальпаторная оценка пульсации артерий может быть затруднена или невозможна у больных с выраженными периферическими отеками или значимой деформацией стопы.
- Для диагностики нарушения периферической иннервации у пациента с синдромом диабетической стопы рекомендуется оценивать следующие клинические признаки:
- Жалобы пациента на боли и другие симптомы (парестезии, онемение, жжение в стопах), характерные для диабетической полинейропатии
- Безболезненность или малоболезненность язвенного дефекта.
Класс рекомендаций I (уровень доказанности А)
Нейропатическая форма | Ишемическая форма |
Сухая кожа, участки гиперкератоза в областях избыточного нагрузочного давления на стопах | Кожа бледная или цианотичная, атрофичная и/или рубеоз кожи в сочетании с мелкоточечными петехиями и/или атрофия подкожной жировой ткани и/или побледнение конечности в приподнятом положении и/или замедленное заполнение вен при предварительном приподнятом положении конечности |
Теплая на ощупь стопа | Холодная на ощупь стопа |
Специфичная для СД деформация стоп, пальцев, голеностопных суставов | Деформация стопы носит неспецифичный характер |
Пульсация на артериях стоп сохранена с обе их сторон | Отсутствие/снижение пульса на артериях стоп и голеней |
Язвенные дефекты в зонах избыточного нагрузочного давления, безболезненные или малоболезненные | Наличие акральных некрозов, ишемических ран, резко болезненных и/или гангрена пальца или части стопы и/или наличие некротических поражений по краям и на дне раны/язвы, расширение зоны поражения, несмотря на проводимое местное лечение |
Раневая инфекция
- Рекомендуется в диагностике раневой инфекции использовать не только клинические, но и лабораторные данные.
Класс рекомендаций I (уровень доказанности А)
Комментарии:
Местными признаками раневой инфекции являются гнойное отделяемое, гиперемия, гипертермия, отек (уплотнение тканей) и боли в ране (или болезненность при пальпации). Диагноз раневой инфекции устанавливается при наличии 2 и более из указанных признаков при отсутствии других возможных причин воспалительной реакции (травма, подагра, диабетическая остеоартропатия, и др.).
К системным признакам инфекции относят лихорадку, лейкоцитоз, а также угнетение функций ЦНС (заторможенность), нарастание почечной недостаточности, декомпенсацию углеводного обмена, кетоацидоз. Однако, ввиду частой гипореактивности иммунной системы при СД (особенно у пожилых пациентов), лихорадка и лейкоцитоз могут отсутствовать даже при тяжелой раневой инфекции.
Лабораторная диагностика
- Рекомендуется проводить оценку состояния углеводного и липидного обмена у всех пациентов с синдромом диабетической стопы. Для этого необходимо исследование таких параметров как уровень гликированного гемоглобина А1с (HbA1c), уровень пре- и постпрандиальной гликемии, общего холестерина, холестерина ЛПНП сыворотки крови.
Класс рекомендаций I (уровень доказанности A)
Комментарии:
Индивидуальные целевые показатели гликированного гемоглобина для больных СД представлены в таблице 4.
Таблица № 4. Индивидуальные целевые показатели для больных СД
Возраст | ||
Молодой | Средний | Пожилой и/или ожидаемая продолжительность жизни |
Нет тяжелых осложнений и/или риска тяжелой гипогликемии | ||
Есть тяжелые осложнения и/или риск тяжелой гипогликемии | ||
- Рекомендуется проведение всем пациентам с синдромом диабетической стопы бактериологического исследования тканей раны для определения микрофлоры и ее чувствительности к антибактериальным препаратам, что позволит выбрать оптимальный метод борьбы с раневой инфекцией и избежать необоснованного назначения антибиотиков.
Класс рекомендаций I (уровень доказанности А)
Комментарии:
Для анализа необходимо брать образцы тканей из разных участков, так как микрофлора может различаться в разных областях дефекта. У пациентов с нейро-ишемической и ишемической формой СДС необходимо выявлять не только аэробные, но и анаэробные микроорганизмы и определять их чувствительность к современным антибактериальным препаратам. Клинически значимым считается содержание бактериальных тел выше 1х106 на грамм ткани или обнаружение β-гемолитического стрептококка (уровень доказанности 1В). Идентификация возбудителя раневой инфекции проводится путем бактериологического исследования материала из раны. Материал для исследования может быть получен при биопсии или кюретаже дна раны. Менее информативно исследование раневого экссудата или мазка с предварительно очищенного и промытого стерильным физиологическим раствором дна раны.
Инструментальная диагностика
Выявление диабетической полинейропатии
- Рекомендуется использовать для верификации диабетической нейропатии у больных с синдромом диабетической стопы тест с 10 г монофиламентом.
Класс рекомендаций 1 (уровень доказанности А)
Комментарии:
Достоверность полученных результатов повышается при дополнительной оценке других видов чувствительности (вибрационной с помощью градуированного камертона 128 Гц или Биотезиометра, болевой, температурной) и/или сухожильных рефлексов. Наиболее информативным методом диагностики поражения периферических нервов является электронейромиография, но ее проведение у пациента с хроническим раневым дефектом стопы нецелесообразно, т.к значительно усложняет обследование, а ее результат не повлияет на выработку плана лечебных мероприятий.
Выявление нарушений артериального кровотока (макроангиопатия нижних конечностей)
- Рекомендовано проводить диагностику ишемии конечности с помощью ультразвуковой допплерографии (УЗДГ) с определением лодыжечно-плечевого индекса (ЛПИ), который в норме превышает 0,9. ЛПИ> 1,3 свидетельствует о ригидности артериальной стенки.
Класс рекомендаций I (уровень доказанности А)
- Рекомендовано подтверждать состояние артериального кровотока у пациентов с ЛПИ> 1,2 измерением артериального давления в пальцевой артерии (величиной пальце-плечевого индекса, ППИ) или данными транскутанной оксиметрии (ТсрО2> 40 мм рт. ст.).
Класс рекомендаций I (уровень доказанности А)
- Рекомендуется использовать транскутанную оксиметрию для объективизации тяжести ишемии конечности у больных СД.
Класс рекомендаций I (уровень доказанности В)
Комментарии:
Транскутанная оксиметрия позволяет провести оценку тяжести ишемии конечности у пациентов с клиническими симптомами ЗАНК, прогноза заживления язв, эффективности консервативного лечения и исходов реваскуляризации, определение уровня ампутации конечности. Ультразвуковое дуплексное сканирование артерий подтверждает артериальную окклюзию, выявляет ее анатомическую локализацию и протяженность.
- Рекомендуется диагностировать критическую ишемию нижних конечностей на основании хотя бы одного из нижеперечисленных признаков:
1) постоянная ишемическая боль в покое, требующая регулярного обезболивания в течение более чем двух недель;
2) наличие язвы или гангрены пальцев или стопы на фоне систолического давления в тибиальных артериях ≤ 50 мм.рт.ст. или пальцевого давления ≤ 30 мм.рт.ст.
Класс рекомендаций I (уровень доказанности А)
Диагностика поражения костных структур
- Рекомендовано проведение рентгенографии стоп и голеностопных суставов в двух проекциях всем больным с синдромом диабетической стопы.
Класс рекомендаций I (уровень доказанности В)
Комментарии:
Рентгенография остается основным методом оценки состояния костей и суставов, позволяющим с высокой достоверностью определять очаги остеолиза (остеомиелит).
- Рекомендовано проведение МСКТ стоп и голеностопных суставов пациентам с наличием длительно незаживающих раневых дефектов и диабетической остеоартропатией.
Класс рекомендаций I (уровень доказанности В)
Комментарии:
Мультиспиральная компьютерная томография позволяет уточнить локализацию и размеры остеомиелитического очага при планировании объема оперативного вмешательства.
Иная диагностика
- В качестве дополнительных методов оценки состояния мягких тканей стопы могут быть рекомендованы измерение перфузионного давления кожи — кровяного давления, необходимого для восстановления капиллярного кровотока после индуцированной окклюзии.
Класс рекомендаций II (уровень доказанности В)
Источник
 Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Распространенность и экономические аспекты
В XXI в. сахарный диабет (СД) стал ведущим неинфекционным заболеванием. Каждые 10 с в мире становится на 2 больных СД больше – это 7 млн в год. По мнению экспертов Всемирной организации здравоохранения, СД занимает 1-е место среди заболеваний, приводящих к инвалидности, и 3-е – по смертности [1–4].
Согласно исследованиям Эндокринологического научного центра (ЭНЦ), в России распространенность СД достигает 10–12 млн человек (7–8% населения страны). Наиболее высокая распространенность СД среди взрослого населения крупных городов. При этом соотношение мужчин и женщин – 1:3. В половине случаев СД 2-го типа выявляется на 5–7-м году от начала заболевания, и у 20–30% выявляются специфические осложнения: катаракта, ретинопатия, нефропатия, нейропатия, синдром диабетической стопы (СДС), ишемическая болезнь сердца, артериальная гипертония и др. [5–8].
СДС приводит к гнойно-некротическим поражениям стоп с последующей потерей нижних конечностей – к самой высокой инвалидизации. Окончательные цифры распространенности СДС в настоящее время неизвестны. Тем не менее установлено, что у 15% больных СД развиваются патологические изменения в стопах или голеностопном суставе [9–13].
В последние годы широко обсуждаются не только клинические, но и экономические, социальные аспекты профилактики и лечения СДС, методы клинико-экономического анализа и, прежде всего, учет всех затрат, связанных с лечением СДС [1, 14].
На 18-м конгрессе Международной федерации диабета (МФД) были представлены, в частности, данные о распространенности язвенных дефектов при СДС в странах Балканского региона – 7,5%. Диагноз СД впервые ставится во время хирургического вмешательства у 15–19% больных, подвергающихся ампутации. Специалисты МФД считают, что вероятная частота ампутаций при СД составляет 5–24 на 100 000 населения в год, или 6–8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах достигает 24 на 1000 больных в год. В России, согласно данным государственного регистра, эти показатели колеблются от 0,76 до 18,2 и в среднем составляют 6,4 случая на 1000 больных [3, 4, 11, 15].
Расходы на лечение СДС в развитых странах составляют около 12–15% от всех затрат на лечение СД, в развивающихся странах они могут составлять до 40% от общего объема финансовых ресурсов, выделяемых на СД. Подсчитано, что на проведение одной ампутации в зарубежных странах тратится более 10 000 долл. Общие затраты на лечение СДС в среднем составляют 13 179 долл. и меняются в зависимости от степени тяжести по классификации Wagner в пределах от 1892 долл. при I степени до 27 721 долл. при IV–V степени тяжести. Лечение СДС на фоне хронической артериальной недостаточности нижних конечностей обходится в 4,5 раза дороже, чем при сохранном периферическом кровотоке. Ежегодная стоимость лечения язвенных поражений стоп при СДС в США составляет 5 млрд долл. прямых медицинских затрат и 400 млн долл. косвенных медицинских затрат. Кроме того, в США зафиксировали, что 77% людей старше 75 лет после ампутации не способны вернуться в собственный дом и им нужна дополнительная помощь и поддержка социальных групп [8, 16–18].
Анализ работы отделения диабетической стопы ЭНЦ показал, что при своевременно начатой адекватной терапии СДС понижается риск хирургических вмешательств и тяжелых осложнений: у 98% больных с нейропатической инфицированной формой СДС можно избежать хирургического вмешательства; у 60% с нейроишемической формой – проведения ампутаций на уровне голени и бедра; у 25% с критической ишемией – предотвратить высокие ампутации на уровне бедра; на 50% уменьшить частоту образования язв стоп в группе высокого риска [4, 5, 13].
Летальность среди больных СД, перенесших высокую ампутацию конечности по поводу гангрены, в течение последующих 5 лет достигает 68%, в ближайшие 3 нед. – 22%, в течение года – 11–41%, через 3 года – 20–50%, через 5 лет – от 39–68%. Частота ипсилатеральных ампутаций через год после первой ампутации – до 24%, через 2 года – 30%, через 5 лет – 49% и контралатеральных ампутаций через год после первой ампутации – до 12%, через 2 года – 23%, через 5 лет – 28-51%. Рецидивы язв на стопах через 1, 3, 5 лет составили 44, 61, 70% соответственно. Рецидивирующие деструктивные поражения ухудшают проблемы лечения, реабилитации, социальной помощи, увеличивая экономические затраты [19–23].
Если распространенность СД, а соответственно и СДС будет увеличиваться с той же скоростью, что и сейчас, то к 2025 г. экономический ущерб составит от 213 до 396 млрд долл. в год. 75% прироста заболевания придутся на развивающиеся страны. По данным немецких исследователей, общая стоимость лечения больных СД в Германии составляет приблизительно 5 млрд. евро, а средняя стоимость лечения 1 пациента – 5000 евро в год. Ежегодные общие затраты в России на лечение нейроишемической формы СДС составляют 56,2 млн долл., при этом затраты на ампутации достигают 14,4 млн долл. [2, 5, 17].
По оценке главного экономиста Morgan Stanley Эльги Бартш, сочетание двух факторов – СД и ожирения – снизит среднегодовые темпы роста валового внутреннего продукта (ВВП) в странах Организации экономического сотрудничества и развития (ОЭСР) в 2015–2035 гг. с 2,3 до 1,8%, в странах БРИКС (Бразилия, Россия, Индия, Китай, Южно-Африканская Республика) – с 4,5 до 4,2%. Согласно прогнозам ОЭСР, среднегодовые темпы роста ВВП России составят 2,8%. При сохранении нынешнего уровня потребления сахара гражданами страны этот показатель снизится до 2%. Согласно результатам исследования, проведенного фармацевтической компанией «Ново Нордиск», «Инвестиции в лечение сахарного диабета в России», ежегодные прямые затраты, связанные с СД в России, составляют 12,5 млрд долл. США. При этом 42% объема этих средств расходуется на лечение осложнений, которые выявляются у 40–50% людей в момент постановки диагноза. Соответственно диагностика заболевания на ранних стадиях позволит российскому обществу сэкономить более 1,5 млрд долл. США из средств, выделяемых на здравоохранение [13].
Принципы терапии
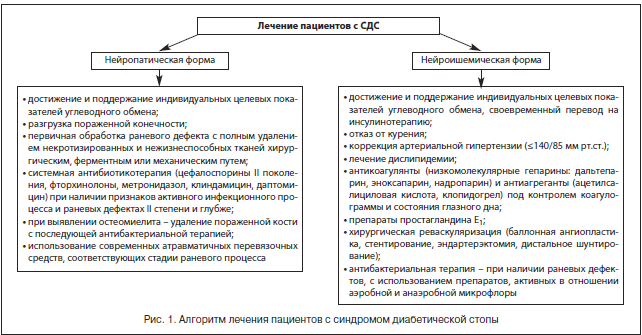
По мнению большинства авторов, в лечении пациентов с синдромом диабетической стопы должны участвовать квалифицированные эндокринолог, гнойный хирург, сосудистый хирург, ортопед, специально обученный средний медицинский персонал, а комплексное лечение должно включать общие и местные методы (рис. 1) [24–26].
Тактика комплексного лечения зависит от формы заболевания [14, 15, 18, 19, 21, 27]. Мы, как и ряд специалистов, выделяем следующие клинические формы СДС.

1. Нейропатическая форма:
– без остеоартропатии;
– с остеоартропатией – «сустав Шарко».
2. Нейроишемическая форма с учетом других характеристик.
К общим принципам терапии пациентов с СДС относятся коррекция факторов риска, компенсация углеводного обмена и поддержание целевых показателей углеводного обмена, компенсация сопутствующих заболеваний, системная антибактериальная, антитромботическая, вазопротекторная терапия в сочетании с адекватным обезболиванием.
К местным принципам лечения относятся: обеспечение полной разгрузки пораженной области с помощью разгрузочного полубашмака, индивидуальной разгрузочной повязки, костыля, сложной ортопедической обуви, кресла-каталки; контроль раневой инфекции, заключающийся в первичной обработке раны и местном лечении раны с правильным выбором повязки в зависимости от фазы течения раневого процесса; хирургическое лечение гнойно-некротического очага стопы с закрытием ран и/или формированием культи пораженной стопы при помощи реконструктивных и пластических операций; восстановление магистрального артериального кровотока в сосудах нижних конечностей.
Перспективным является применение L-лизина эсцината в комплексном лечении язвенных и гнойно-некротических поражений при СДС. Эффективность препарата объясняется его противоотечным действием, связанным со снижением проницаемости сосудистой стенки и улучшением венозного оттока. L-лизина эсцинат обладает стабилизирующим действием на мембраны клеток, снижает активность лизосомальных ферментов, принимающих непосредственное участие в воспалительном процессе. Кроме того, препарат блокирует эффекты фосфолипазы А2, которая является ключевым веществом в развитии воспалительной реакции, связанной с повреждением мембран клеток различными факторами при ишемии, инфекции и травме. Стабилизация фосфолипазы А2 способствует снижению активности простагландинов, что также приводит к уменьшению воспалительного ответа. Доказано также влияние L-лизина эсцината на такие медиаторы воспаления, как гистамин, серотонин, которые выделяются из тромбоцитов, тучных клеток и создают основу для классической воспалительной реакции. Комплексный эффект препарата L-лизина эсцината апробирован в нейрохирургической, неврологической, травматологической практике, ангиологии и флебологии [26–31].
Мы регулярно применяем L-лизина эсцинат по 10 мл в разведении на 50 мл физиологического (0,9%) раствора внутривенно капельно в течение 10 дней у пациентов с нейропатической формой СДС в послеоперационном периоде, с трофическими язвами на фоне нейропатических отеков и у больных с язвами на фоне венозной недостаточности (СЕАР 2-3). Отмечаем благоприятное течение послеоперационного периода, более раннее уменьшение отеков, снижение болевого синдрома, нейропатических болей, заживление язв. Рекомендуем применение L-лизина эсцината для лечения язвенных и гнойно-некротических поражений при СДС в амбулаторной и стационарной практике.
Заключение
СД является серьезным заболеванием, способным привести к тяжелым социально-экономическим и демографическим последствиям. Вопрос о влиянии СДС на качество жизни остается малоизученным. Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. Кроме того, неучтенными остаются непрямые затраты вследствие утраты человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Опыт других стран, например США, показал, что мультидисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49–85% и существенно уменьшить расходы государства. Использование программ по профилактике осложнений и обучению больных СД приводит к уменьшению количества ампутаций почти в 2 раза, а экономический эффект от внедрения программ обучения составил 10 млн долл. [2, 5, 9, 11, 13, 21].
Учитывая вышеизложенное, 20 апреля 2015 г. в Кремле Президент РФ Владимир Путин подписал Закон о ратификации соглашения о сотрудничестве стран СНГ в борьбе с ростом заболеваемости сахарным диабетом [18], что в сочетании с грамотным ведением пациентов с СДС может улучшить прогноз как для этих пациентов, так и для больных СД в целом.
Источник
