Компартмент синдром в абдоминальной хирургии
Абдоминальный компартмент-синдром – это комплекс патологических изменений, которые возникают на фоне стойкого повышения внутрибрюшного давления (ВБД) и вызывают развитие полиорганной недостаточности. Наблюдается после операций, при тяжелых повреждениях и заболеваниях органов брюшной полости, забрюшинного пространства, реже – при экстраабдоминальной патологии. Проявляется сердечной, почечной, дыхательной недостаточностью, нарушениями работы печени и ЖКТ. Основу ранней диагностики составляют повторные измерения ВБД, дополнительно используются данные инструментальных и лабораторных исследований. Лечение – срочная оперативная декомпрессия, инфузионная терапия, ИВЛ.
Общие сведения
Абдоминальный компартмент-синдром (АКС) – грозное осложнение, встречающееся при тяжелых заболеваниях, травматических повреждениях и хирургических вмешательствах. Первые сообщения об отрицательном влиянии увеличенного интраабдоминального давления на состояние больных появились в конце XIX века, но патогенез АКС и значение синдрома как причины смертности были установлены только в 80-х годах прошлого века.
По разным данным, патология диагностируется у 2-30% больных, прооперированных по поводу травм живота. Среди пациентов, находящихся на момент поступления в критическом состоянии и нуждающихся в проведении реанимационных мероприятий, значимое повышение внутрибрюшного давления обнаруживается более чем в 50% случаев, клинические признаки АКС выявляются примерно в 4% случаев. Без лечения летальность составляет 100%.
Абдоминальный компартмент-синдром
Причины
Брюшная полость представляет собой замкнутое пространство, ограниченное костными и мягкотканными структурами. В норме давление в ней близко к нулю. При ожирении и в период беременности данный показатель повышается, однако из-за медленного развития изменений организм больного постепенно приспосабливается к этому состоянию. При быстром увеличении ВБД организм пациента не успевает адаптироваться к изменениям, что влечет за собой нарушения деятельности различных органов. Вероятность формирования АКС возрастает при наличии следующих факторов:
- Уменьшение растяжимости брюшной стенки. Обнаруживается при обширных грубых рубцах, интенсивных абдоминальных болях, мышечном спазме, после пластики крупных грыж, при плевропневмонии, в период проведения ИВЛ, особенно – на фоне некорректных настроек параметров искусственного дыхания.
- Увеличение объема содержимого брюшной полости. Отмечается при крупных новообразованиях, кишечной непроходимости, больших гематомах в области забрюшинной клетчатки, аневризмах брюшной аорты.
- Скопление жидкости либо газа. Причиной скопления жидкости может стать перитонит, гемоперитонеум при травмах, асцит при опухолях, циррозе печени и других заболеваниях. Значимый пневмоперитонеум обычно возникает при торакоабдоминальных повреждениях с нарушением целостности легкого и диафрагмы. Определенную роль может играть нагнетание воздуха в брюшную полость при эндоскопических вмешательствах.
- Синдром капиллярной утечки. Характеризуется повышением проницаемости капилляров и выходом жидкости в ткани из сосудистого русла. Наблюдается при сепсисе, обширных ожогах, ацидозе, коагулопатии, переохлаждении, массивном переливании крови и кровезаменителей, растворов для внутривенных инфузий.
Разнородность провоцирующих факторов является причиной возникновения компартмент-синдрома при широком круге заболеваний и состояний, в том числе, не связанных с абдоминальной патологией. Наиболее частыми причинами АКС становятся тяжелые травмы живота, внутрибрюшные кровотечения различного генеза, пересадка печени, перитонит, острый деструктивный панкреатит, множественные переломы тазовых костей, обширные ожоги, инфузионная терапия шоковых состояний. Реже синдром наблюдается при кишечной непроходимости, после пластики грыжи, при проведении перитонеального диализа.
Патогенез
При повышении интраабдоминального давления нарушается кровоток в брюшной полости, это провоцирует повреждение слизистой желудка и кишечника вплоть до формирования участков некроза, прободения полого органа и развития перитонита. Расстройства кровообращения в сосудах печени становятся причиной омертвения более чем 10% гепатоцитов и соответствующих изменений печеночных проб.
Страдает барьерная функция кишечника, что проявляется контактным, лимфогенным и гематогенным распространением бактериальных агентов. Увеличивается вероятность возникновения инфекционных осложнений. Сдавление прооперированных органов потенцирует несостоятельность анастомозов.
Диафрагма смещается кверху, это вызывает повышение давления в плевральной полости и расстройства воздухообмена. Возникает дыхательный, а в последующем – метаболический ацидоз. Формируется респираторный дистресс-синдром. Нарушается снабжение миокарда кислородом. Из-за сдавления крупных венозных стволов повышается центральное венозное давление, уменьшается венозный возврат к сердцу, развивается внутричерепная гипертензия, обусловленная затруднением оттока крови из головного мозга.
Вследствие сдавления почек ухудшается кровообращение в почечной паренхиме, нарушается клубочковая фильтрация, образуются очаги некроза. Поражение почечной ткани провоцирует повышение содержания гормонов, участвующих в регуляции функции почек. У части больных наблюдается острая почечная недостаточность с олигурией или анурией.
Классификация
Устойчивое повышение ВБД носит название интрабрюшной гипертензии. Для определения тактики лечения используют классификацию Берча с соавторами, в которой выделяется четыре степени этого состояния: 12-15, 16-20, 21-25 и более 25 мм рт. ст. АКС ассоциируется с интраабдоминальным давлением, составляющим 20 мм рт. ст. или более, точные показатели, при которых наступают жизнеугрожающие изменения, пока не установлены. С учетом этиологического фактора различают три варианта абдоминального компартмент-синдрома:
- Первичный. Провоцируется патологическими процессами в полости живота и забрюшинном пространстве. Обнаруживается при травмах, перитоните, панкреатите, разрыве аневризмы брюшной аорты, обширных абдоминальных операциях, крупных гематомах забрюшинной клетчатки.
- Вторичный. Формируется при экстраабдоминальных патологических процессах. Диагностируется при тяжелых ожогах, сепсисе, массивных инфузиях.
- Третичный. Характеризуется повторным возникновением симптоматики у больных, перенесших первичный либо вторичный варианты синдрома. Причиной обычно становится изменение факторов, влияющих на ВБД, например, ушивание лапаростомы. Показатели смертности выше, чем при других формах.
Симптомы АКС
Клинические проявления патологии неспецифичны, включают нарушения со стороны разных органов и систем, свидетельствующие о развитии и прогрессировании полиорганной недостаточности. Данные о первых симптомах разнятся. Одни исследователи указывают, что синдром манифестирует напряжением брюшных мышц, увеличением объема живота, которые сочетаются с дыхательными расстройствами, уменьшением диуреза. Другие специалисты полагают, что дыхательные нарушения и олигурия опережают абдоминальную симптоматику.
Дыхание частое, поверхностное. Олигурия сменяется анурией. Отмечается учащение сердцебиения, снижение артериального давления при неизмененном либо повышенном ЦВД. Явления дыхательной, сердечной и почечной недостаточности быстро нарастают, при самостоятельном дыхании возникает необходимость перевода пациента на ИВЛ, требуется стимуляция диуреза, но использование диуретиков нередко не обеспечивает желаемого результата. При отсутствии декомпрессии наступает смерть от прогрессирующего нарушения деятельности жизненно важных органов.
Осложнения
Характерными осложнениями компартмент-синдрома, возникшего после хирургических вмешательств, являются несостоятельность швов и анастомозов, нагноение ран. Возрастает вероятность образования внутрибрюшных абсцессов, перитонита, сепсиса. После проведения декомпрессионной лапаротомии у 90% больных формируются грыжи и кишечные свищи, у 22% образуются множественные лигатурные свищи.
Из-за нарушения функции легких повышается риск пневмонии. У некоторых пациентов с явлениями ОПН в отдаленном периоде развивается хроническая почечная недостаточность. Увеличивается продолжительность лечения основных заболеваний, отмечаются худшие функциональные исходы при травмах.
Диагностика
Из-за неспецифичности проявлений и других возможных причин полиорганной недостаточности диагностика данного состояния на основании клинических симптомов вызывает существенные затруднения. С учетом тяжести патологии и ее угрозы для жизни больного оптимальным вариантом считается периодическое профилактическое измерение ВБД у лиц с риском развития компартмент-синдрома.
В случае наличия лапоростомы, дренирования брюшной полости, выполнения перитонеального диализа либо лапароскопии возможны прямые измерения показателя, но из-за сложности и инвазивности эти методы применяются редко. Обычно используются следующие диагностические процедуры:
- Измерение давления в мочевом пузыре. Является наиболее распространенным исследованием. Производится путем катетеризации после выведения мочи и введения 20-25 мл теплого раствора.
- Другие варианты измерения ВБД. Для оценки показателя используется желудок (через назогастральный зонд) и нижняя полая вена. Показатели измерений могут несколько расходиться с реальным ВБД, однако корректно проведенные повторные процедуры позволяют получить достаточно точную картину изменения внутрибрюшного давления.
- Лабораторные исследования. При анализе газов артериальной крови определяется острый дыхательный алкалоз. В крови обнаруживается повышение уровня лактата, мочевины, креатинина, аланинаминотрансферазы, щелочной фосфатазы, снижение pH крови. В анализах мочи выявляется протеинурия, эритроцитурия, цилиндрурия.
- Рентгенография грудной клетки. На рентгенограммах отмечается подъем куполов диафрагмы.
Лечение абдоминального компартмент-синдрома
Основным методом лечения АКС считается хирургическая декомпрессия, но показания к вмешательству пока точно не определены. В клинической практике часто используется алгоритм, согласно которому при 1 и 2 степени интраабдоминальной гипертензии рекомендуется наблюдение и коррекция инфузионной терапии, при 3 – декомпрессивная лапаротомия на фоне интенсивной терапии, при 4 – неотложная оперативная декомпрессия и реанимационные мероприятия.
При наличии асцита на начальном этапе возможно проведение пункции брюшной полости, лапароцентеза либо лапароскопии с последующим дренированием. Хирургическую декомпрессию выполняют в условиях операционной или отделения интенсивной терапии. Применяют поперечный или срединный разрез. В дальнейшем осуществляют ведение методом «открытого живота». При нормализации ВБД, отсутствии отека внутренних органов и окружающих тканей рану ушивают на 1-8 сутки. В остальных случаях производят отсроченное закрытие лапаростомы. Для снижения риска развития грыж устанавливают сетчатые трансплантаты.
Оперативные мероприятия осуществляют на фоне контроля жизненных показателей, ИВЛ, стимуляции диуреза, коррекции обменных расстройств, предупреждения сердечно-сосудистого коллапса вследствие снижения периферического сосудистого сопротивления, профилактики сердечных нарушений, обусловленных поступлением лактата и калия в кровоток после устранения ишемии.
Прогноз и профилактика
Прогноз при абдоминальном компартмент-синдроме определяется своевременностью проведения лечебных мероприятий. При оперативной декомпрессии в течение первых 6 часов после появления признаков АКС (до формирования развернутой картины полиорганной недостаточности) выживаемость составляет 80%. При поздних вмешательствах погибает 43-65% пациентов. При отсутствии мероприятий по декомпрессии летальность достигает 100%.
Профилактика включает врачебную настороженность при поступлении больных с риском формирования АКС, регулярное измерение ВГД, адекватную респираторную поддержку, корректную инфузионную терапию. Некоторые авторы предлагают не накладывать швы на апоневроз при тяжелых травмах живота и других патологиях, провоцирующих АКС, однако эта мера не всегда оказывается эффективной.
Источник

Интраабдоминальная гипертензия (ИАГ) (Intra-abdominal Hypertension (IAH)) и абдоминальный компартмент-синдром (АКС) (Abdominal Compartment Syndrome (ACS)) являются тяжелыми осложнениями заболеваний, как у хирургических, так и у нехирургических больных. Однако эти два сопутствующих явления, при своей высокой распространенности, часто остаются непризнанными или не диагностированными. ИАГ воздействует на региональную и общую перфузии, что может привести к полиорганной недостаточности и летальному исходу.
Наиболее ранним проявлением, даже при относительно низком уровне ИАГ, является олигурия и острое повреждение почек (ОПП). Профилактика ИАГ путем раннего выявления и мониторинга пациентов группы риска может полностью исключить развитие АКС. Понимание этиологии и патофизиологии ИАГ и AКС имеет важное значение для выявления патологии и может быть использовано в качестве руководства при его профилактике и осуществлении соответствующей терапии.
Определение и руководящие принципы ИАГ и АКС установлены Всемирным обществом абдоминального компартмент-синдрома (WSACS).
Интраабдоминальное давление (ИАД) — давление внутри брюшной полости.
В среднем у взрослого человека нормальный уровень ИАД находится в пределах 0–5 мм рт.ст., в то время как у тяжелобольных взрослых он обычно составляет 5–7 мм рт. ст.
Интраабдоминальная гипертензия (ИАГ) — постоянное или рецидивирующее патологическое повышение ИАД больше ≥ 12 мм рт.
Абдоминальный компартмент синдром (АКС) — устойчивая ИАГ (более 20 мм рт.ст.), при абдоминальном перфузионном давлении (АПД) < 60 мм рт. ст., связанная с новой дисфункцией/недостаточностью органов.
Абдоминальное перфузионное давление — это разница между средним артериальным давлением (САД) и ИАГ.
АПД является индикатором висцеральной перфузии, понятие которой уподобляется церебральному перфузионному давлению. WSACS определил нормальное АПД на уровне 60 мм рт.ст. или выше.
АПД менее 60 мм рт. ст. — надежный индикатор необходимости хирургической декомпрессии, что делает его полезным как в диагностике, так и в лечении.
Система классификации была разработана WSACS для ИАГ. Классификация ИАГ по степеням выглядит следующим образом:
- I степень: ИАД 12–15 мм рт. ст.;
- II степень: ИАД 16–20 мм рт. ст.;
- III степень: ИАД 21–25 мм рт. ст.;
- IV степень: ИАД > 25 мм рт.
С другой стороны, АКС дополнительно классифицируется в зависимости от причины и продолжительности ИАГ на первичную, вторичную и рецидивирующую.
- Первичный АКС — это состояние, ассоциированное с травмой или заболеванием в области брюшной полости, которое часто требует раннего хирургического или интервенционного рентгенологического вмешательства.
- Вторичный АКС относится к состояниям, которые не исходят из брюшной полости. Рецидивирующий АКС относится к состоянию, возникшему после предыдущего хирургического или медицинского лечения первичного или вторичного АКС.
Эти системы классификационных групп, разработанные WSACS, облегчают последующее управление ИАГ и АКС в рамках организации поэтапного подхода к ведению больных.
Наиболее распространенные факторы риска развития ИАГ и/или АКС в соответствии WSACS:
- снижение эластичности брюшной стенки;
- увеличение содержимого внутри просвета кишечника;
- увеличение внепросветного/внутрибрюшного содержимого;
- синдром капиллярной утечки и агрессивная инфузионная терапия.
Примечание. Некоторые из этих факторов риска далеки от патофизиологического обоснования и клинического суждения.
Развитие ИАГ у пациентов, которым проводится интенсивная терапия, связано с ухудшением клинического исхода, и это может наблюдаться у пациентов с тяжелым острым панкреатитом, распространенность интраабдоминальной гипертензии у этого типа пациентов составляет около 40–50 %, что обычно является осложнением ранней и агрессивной инфузионной терапии.
Помимо серьезных ожогов и сепсиса, которые являются одними из причин вторичного ИАГ/АКС, травмы и хирургические манипуляции в области живота являются предрасполагающими условиями, влияющими на развитие первичного ИАГ/АКС и, следовательно, послеоперационной почечной недостаточности. В проспективном наблюдательном исследовании, которое включало 263 пациента, ИАГ (определяемая как ИАП, превышающая или равная 18 мм рт.ст.) была независимой причиной нарушения функции почек после абдоминальной операции.
Чтобы понять основные принципы ИАГ и АКС, мы можем сравнить его в целом с компартмент-синдромом, когда повышение давления ухудшает капиллярный кровоток, в конечном итоге уменьшая приток в артериолы и уменьшая венозный отток. В дальнейшем это вызывает клеточную гипоксию, которая, в свою очередь, предшествует анаэробному дыханию и молочнокислому ацидозу.
Человеческое тело можно рассматривать как сочетания различных анатомических отделов, взаимодействующие друг с другом, по этой причине патофизиология внутриполостной гипертензии и компартмент-синдрома является многофакторной и может наблюдаться почти во всех системах органов.
ИАГ, очевидно, не только вызывает снижение перфузии во всех органах брюшной полости, но и оказывает влияние на внебрюшинные органы, а в некоторых случаях даже оказывает влияние на внутричерепное давление. Проще говоря, когда внутрибрюшное давление повышается, многие органы постепенно начинают отказывать. Было установлено, что ИАГ вызывает ряд патофизиологических изменений, начиная с региональных нарушений кровотока и заканчивая явной недостаточностью систем органов и развитием АКС.
Помимо уровня ИАД и этиологии ИАГ у пациента, схожую по значимости роль играет коморбидность, которую следует принимать во внимание, поскольку это снижает порог ИАД, вызывающий клинические проявления (изображение 1).
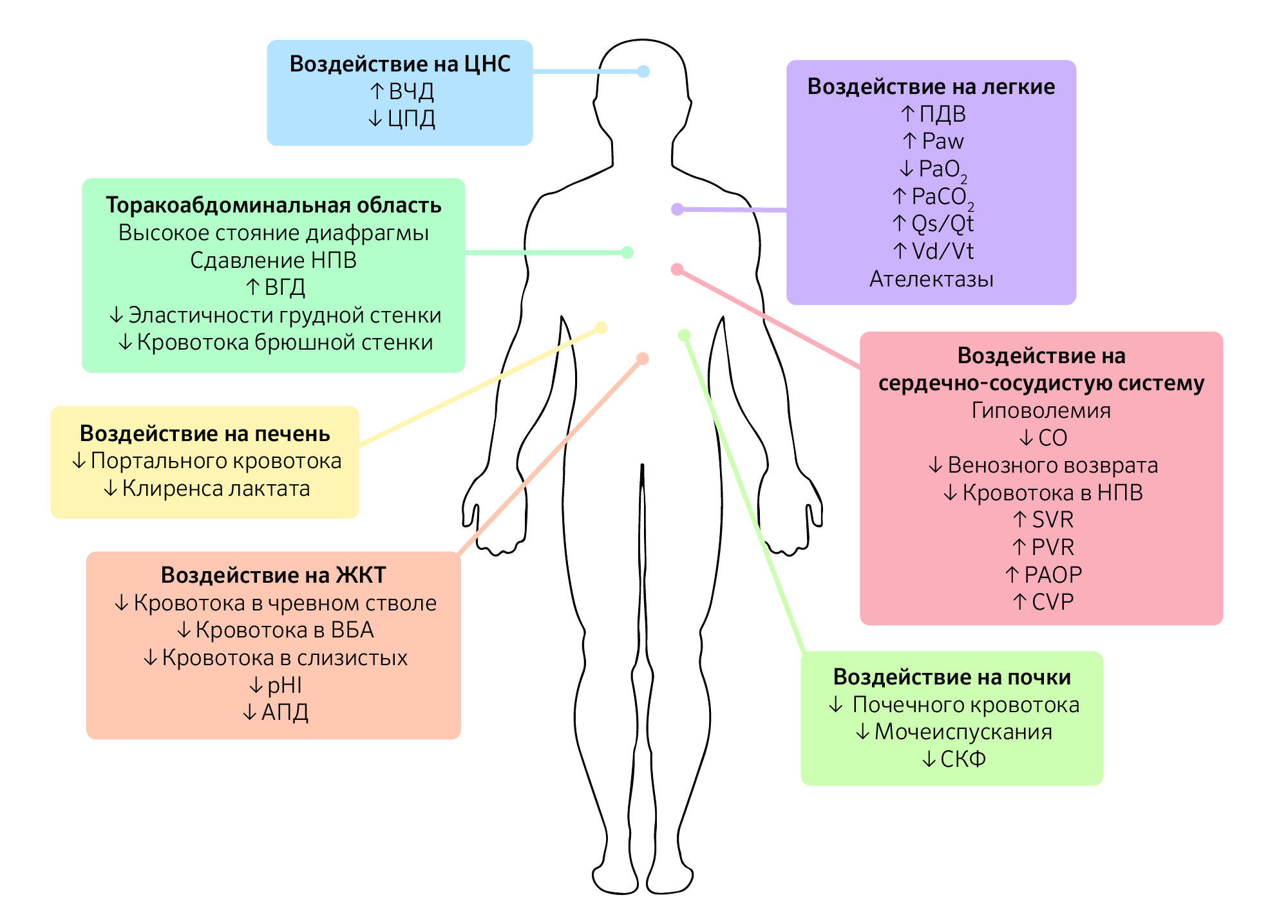
Изображение 1 | Патофизиологические последствия интраабдоминальной гипертензии.
Последствия интраабдоминальной гипертензии не ограничиваются только органами брюшной полости, а, скорее, оказывают прямое или косвенное воздействие на каждую систему органов в организме. Схема влияния ИАГ на системы органов.
Сокращения: ВЧД — внутричерепное давление; ЦПД — церебральное перфузионное давление; ВГД — внутригрудное давление; НПВ — нижняя полая вена; ВБА — верхняя брыжеечная артерия; pHI — pH слизистой желудка ; АПД — абдоминальное перфузионное давление; ПДВ — пиковое давление вдоха; Paw, mean airway pressure —среднее давление в дыхательных путях; PaО2 — парциальное давление кислорода в артериальной крови; PaCO2 — парциальное давление углекислого газа в артериальной крови; Qs/Qt — внутрилегочный шунт; Vd/Vt — легочное мертвое пространство; CO, cardiac output — сердечный выброс; SVR — системное сосудистое сопротивление; PVR — легочное сосудистое сопротивление; PAOP — окклюзионное давление в легочной артерии; CVP — центральное венозное давление; СКФ — скорость клубочковой фильтрации.
Повышение ИАГ увеличивает внутригрудное давление путем брюшно-грудной передачи через краниальное смещение диафрагмы. Это явление создает прямое сжатие внутригрудных органов. Прямая компрессия сердца вызывает снижение сократительной способности, наполнения сердца и эластичности правого желудочка. ИАГ также приводит к нарушению венозного возврата, поскольку давление нижней полой вены увеличивается параллельно увеличению ИАГ, это отмечается даже при ИАД 10 мм рт. ст. Кроме того, отклонение диафрагмы вызывает анатомическое сужение полой вены, что приводит к дальнейшему снижению венозного возврата к сердцу и, в конечном счете, сердечного выброса. С другой стороны, сдавление легочной паренхимы приводит к сдавлению сосудистой сети, тем самым увеличивая легочное, аортальное и системное сосудистое сопротивление. Потому, несмотря на снижение венозного возврата и сердечного выброса, среднее артериальное давление остается стабильным, что делает его неточным гемодинамическим маркером.
Измерение давления на основе внутрисердечного или внутрисосудистого объема также имеет тенденцию быть недостоверным. Это объясняется тем, что, как окклюзионное давление легочной артерии (pulmonary artery occlusion pressure, PAOP), так и центральное венозное давление (central venous pressure, CVP) измеряются пропорционально барометрическому давлению, когда на самом деле эти показатели — сумма внутрисосудистого и внутригрудного давления.
Параметрами, которые более точно отражают состояние внутрисосудистого объема, являются следующие: конечный диастолический объем правого желудочка (right ventricular end-diastolic volume, RVEDV), общий конечный диастолический объем (global end-diastolic volume, GEDV) и ударный объем, поскольку они остаются незатронутыми изменениями внутригрудного давления.
Аналогичным образом повышенное ИАД передается в грудную клетку главным образом через отклонение диафрагмы, вызывающее сдавление легочной паренхимы. Паренхиматозное сжатие при ИАД 16 мм рт. ст. снижает эластичность легочной ткани на 50 %. Паренхиматозное давление также вызывает снижение емкости вдоха и функциональной остаточной емкости, в то время как пиковое инспираторное, экспираторное и среднее давление в дыхательных путях увеличиваются. В результате возникает альвеолярный ателектаз, увеличивается альвеолярное мертвое пространство, снижается легочный капиллярный кровоток, что приводит к снижению транспорта кислорода и снижению экскреции углекислого газа, а также увеличению фракции внутрилегочного шунта (Qsp/Qt) и рассогласованию вентиляции и перфузии (VQ) и, в конечном счете, к гипоксемии и гиперкапнии.
Несколько механизмов были предложены в качестве этиологии для ИАГ-индуцированной почечной дисфункции и недостаточности. Компрессия почечных артерий и вен в сочетании с компрессией почечных канальцев — вероятный механизм, лежащий в основе ИАГ/АКС-индуцированной почечной дисфункции и недостаточности, сопровождающейся снижением сердечного выброса. Различные авторы предположили, что прямое сдавление паренхимы провоцирует развитие «синдрома почечного компартмента», при котором почечный артериальный кровоток уменьшается, а почечное венозное давление и почечное сосудистое сопротивление повышается. Это приводит к тому, что кровь шунтируется от коры почек и клубочков, что приводит к нарушению функции клубочков и канальцев, вызывая ишемию почек и последующую почечную недостаточность.
При ИАД более 15 мм рт.ст. отмечается олигурия, в то время как анурия проявляется при ИАД более 30 мм рт. ст. Клинически наблюдаются изменения в функции почек, такие как снижение СКФ, повышение содержания азота мочевины в крови (BUN) и креатинина в сыворотке крови, увеличение фракционной экскреции натрия, снижение концентрации натрия и хлорида в моче и увеличение концентрации калия в моче. Однако все эти изменения, по-видимому, могут быть устранены, если ИАГ диагностируется и успешно управляется до того, как произойдет существенная дисфункция органа.
Высокое давление в брюшной полости вызывает мальперфузию кишечника из-за нарушения артериального и венозного кровотока. Было показано, что повышение ИАД на 10 мм рт. ст. снижает брыжеечный кровоток. Снижение перфузии кишечника вызывает ишемию кишечника и даже отек кишечника и кишечную непроходимость. Перфузия слизистой оболочки кишечника также нарушается, вызывая снижение рН и молочнокислый ацидоз, который в конечном итоге повреждает слизистый барьер кишечника. Потеря слизистого барьера приводит к внутрипросветной бактериальной транслокации, приводящей к сепсису или септическому шоку и последующему ухудшению исхода.
Повышенный ИАД существенно влияет на функцию печени. Прямое сжатие печени нарушает печеночный венозный и портальный кровоток. Кроме того, сужение печеночных вен на уровне диафрагмы ослабляет печеночный венозный кровоток, в то время как печеночный артериальный поток нарушается из-за снижения сердечного выброса.
На клеточном уровне микроциркуляторный кровоток также снижается, нарушая метаболизм глюкозы, вызывая увеличение производства лактата и одновременно нарушая механизм его утилизации.
Устойчивое и длительное повышение внутрибрюшного и внутригрудного давлений вызывает повышение внутричерепного давления (ВЧД) и снижение церебрального перфузионного давления (ЦПД). Bloomfield и соавторами в ходе двух различных исследований было установлено, что при повышении внутригрудного давления снижается мозговой венозный поток, что, в свою очередь, вызывает внутримозговой отек.
Раннее выявление пациентов группы риска является первым шагом в диагностике ИАГ и АКС. WSACS рекомендует проводить скрининг на ИАГ/АКС при наличии двух или более факторов риска. Рекомендация состоит в том, чтобы оценить ИАД на исходном уровне, и, если оно повышено, то ИАД необходимо продолжать контролировать каждые 4-6 часов.
Клиническое обследование, такое как пальпация и измерение окружности живота, оказалось крайне неточным и ненадежным в диагностике ИАГ и/или АКС. Радиографический ввод, такой как обычная рентгенография грудной клетки и/или живота, УЗИ брюшной полости, компьютерная томография и МРТ брюшной полости, также оказался ограниченным, поскольку результаты не являются ни чувствительными, ни специфичными для ИАГ и АКС. Тем не менее они могут продемонстрировать наличие возможной причины ИАГ, а также могут выявить воздействие ИАД (высокий уровень стояния диафрагмы, уплощение нижней полой вены, сжатие почечных вен и повышенное усиление стенки кишечника).
Когда комбинация рентгенологических данных сочетается с клинической картиной, тогда рентгенолог и врач-клиницист должны поднять вопрос о возможной ИАГ и/или АКС в качестве дифференциального диагноза.
Лучшим методом установления или исключения факта ИАГ является измерение внутрибрюшного давления. Существуют прямые и косвенные способы определения ИАД. Прямое измерение внутрибрюшного давления может быть выполнено с помощью внутрибрюшинного катетера с датчиком давления. Методы косвенного измерения включают определение любого из следующих давлений:
- давление в нижней полой вене;
- внутрижелудочное давление;
- внутрикишечное давление;
- внутриматочное давление;
- внутрипузырное давление.
В связи с положением мочевого пузыря в брюшной полости, внутрипузырный метод считается простым, точным и минимально инвазивным; следовательно, это надежный и воспроизводимый способ измерения ИАД.
При выполнении измерения, необходимо соблюдать несколько рекомендаций:
- Сообщать о ИАД в мм рт.ст. (1 мм рт. ст. = 1,36 см H2O),
- Пациент должен находиться в положении лежа на спине, чтобы избежать ложного повышения ИАД,
- Измерения должны проводиться в конце выдоха во время расслабления мышц живота,
- Датчик должен быть обнулен в середине подмышечной линии на уровне подвздошного гребня.
Необходимое оборудование
- Катетер Фолея с мочеприемником
- Система контроля давления
- Физиологический раствор изотонический с инфузионной системой.
- Кабель датчика/преобразователя
- Шприц 30 мл
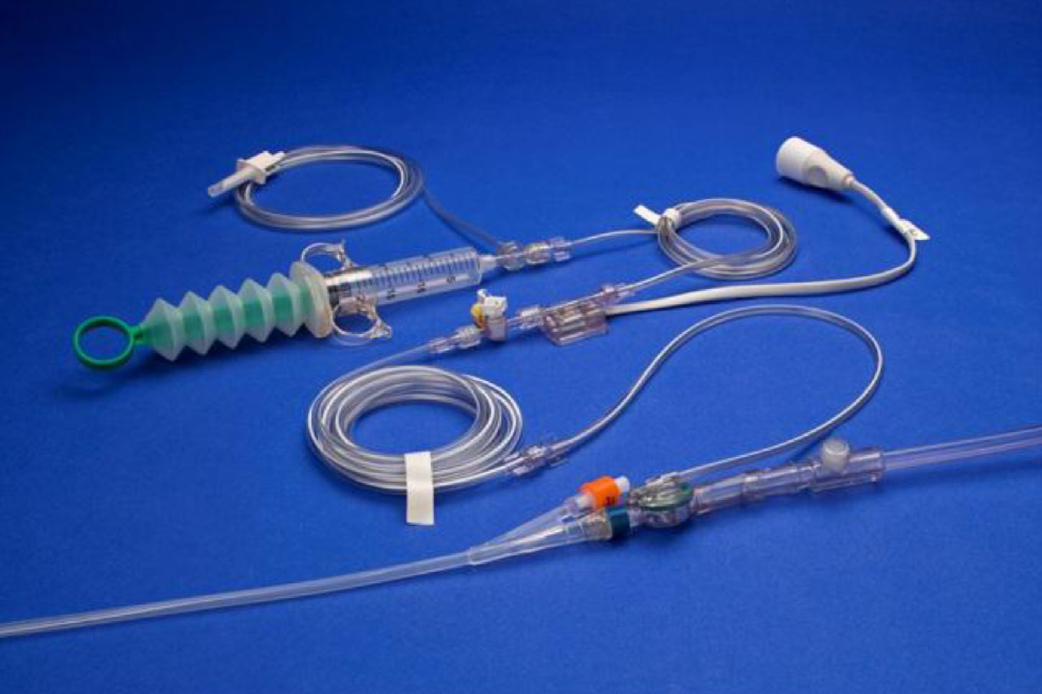
Изображение 2 | Система мониторинга ИАД ABVISER IPA
Шаги для измерения внутрипузырного давления:
- Подсоедините кабель датчика к монитору и настройте систему контроля давления.
- Расположите пациента в положении лежа на спине, чтобы избежать более высокого ИАД. Мочевой катетер устанавливается в полость мочевого пузыря.
- Отрегулируйте датчик и обнулите его так, чтобы атмосферный порт находился на уровне средней подмышечной линии, гребне подвздошной кости.
- Зафиксируйте катетер на расстоянии от порта, очистите порт спиртовым тампоном, затем подсоедините трубку датчика к порту отбора проб.
- Поверните кран на пациента и дайте шприцу заполнить максимум 25 мл по 0,9 % из пакета для внутривенного вливания.
- Поверните кран и введите 25 мл 0,9% физиологического раствора в мочевой пузырь.
- Освободите зажим на дренажной трубке для мочеиспускания, чтобы весь воздух удалялся из мочевого катетера.
- Подождите 30–60 с после установки для релаксации и стабилизации мышц детрузора мочевого пузыря.
- Измерьте ИАД в фазе выдоха, запишите показания давления на мониторе.
Установлено, что измерение ИАП имеет существенное прогностическое значение для тяжелобольных пациентов, так как ИАГ и АКС часто ассоциируются с неблагоприятными исходами. По этой причине ранняя и постоянная оценка, включая серийные измерения ИАД, должна контролироваться у любого пациента, у которого есть подозрение на ИАП/АКС.
Раннее распознавание имеет важное значение в управлении и благоприятном для пациента исходе. Необходимо понять патофизиологию ИАГ и АКС, исходить из более высокой настороженности и проверить наличие ИАГ у всех пациентов, имеющих факторы риска. В идеале хотелось бы иметь возможность диагностировать развивающийся ИАГ и АКС и вмешиваться до начала дисфункции и отказа органов и систем.
Предпочтительно, чтобы раннее терапевтическое вмешательство, будь то медицинские или хирургические попытки уменьшить ИАГ, рассматривалось как можно раньше. Руководящие принципы и рекомендации WSACS дают врачам полезное понимание ИАГ и АКС и их клинического управления для улучшения выживаемости пациентов.
Список литературы
- Meldrum D, Moore F, Franciose R, Sauaia A, Burch J. Prospective characterization and selective management of the abdominal compartment syndrome. Am J Surg . 1997;174(6):667–673. https://www.sciencedirect.com/… pii/S0 0 029610970 02018 . Accessed September 26, 2018.
- Eddy V, Nunn C, Morris J. Abdominal compartment syndrome: the Nashville experience. Surg Clin . 1997;77(4):801–812. https://www.surgical.theclinics.com/article/S0039- 6109(05)70585- 5/abstract . Accessed September 26, 2018.
- Tiwari A, Jenkins M, Amin A, Cheng K, Hamilton G. Regarding “Abdominal compartment syndrome after mesenteric revascularization. J Vasc Surg . 2002;35(4):831. https://www.jvascsurg.org/article/S0741- 5214(02)70067- 0/abstract . Ac- cessed September 26, 2018.
- Vidal, M., Weisser, J., Gonzalez, F., …MT-C care, 2008 undefined. Incidence and clinical effects of intra-abdominal hypertension in critically ill patients. https://journals.lww.com/ccmjo… 08/060 0 0/Incidence _ and _ clinical _ effects _ of _ intra _ abdominal.20.aspx . Accessed September 26, 2018.
- Holodinsky JK, Roberts DJ, Ball CG, et al. Risk factors for intra-abdominal hypertension and abdominal compartment syndrome among adult intensive care unit patients : a systematic review and meta-analysis. Crit Care . 2013;17(5):1. doi: 10.1186/cc13075.
- Hunt L, Frost SA, Hillman K, Newton PJ, Davidson PM. Management of intra-abdominal hypertension and abdominal compartment syndrome : a review. J Trauma Manag Outcomes . 2014;8(1):1–8. doi: 10.1186/1752- 2897- 8- 2 .
- Patel, A., Lall, C., …SJ-AJ of, 2007 undefined. Abdominal compartment syndrome. Am Roentgen Ray Soc . https://www. ajronline.org/doi/abs/10.2214/AJR.07.2092 . Accessed September 26, 2018.
Источник
