Код мкб анемия смешанная

Содержание
- Описание
- Классификация
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Анемия.
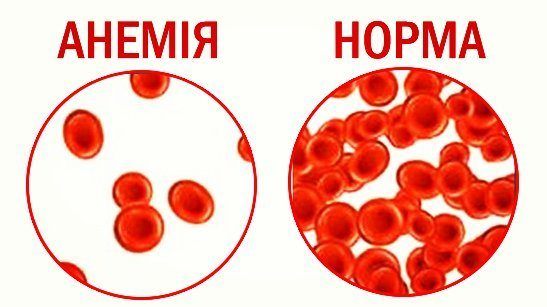
Анемия
Описание
Термин «анемия» без детализации не определяет конкретного заболевания, то есть анемию следует считать одним из симптомов различных патологических состояний. Следует различать гидремию и анемию, при гидремии число форменных элементов и гемоглобина остается прежним, но увеличивается объём жидкой части крови.
Классификация
Сама по себе любая анемия не является заболеванием, но может встречается как синдром при целом ряде заболеваний, которые могут быть либо связаны с первичным поражением системы крови, либо не зависеть от него. В большинстве случаев встречается у женщин. В связи с этим строгая нозологическая классификация анемий невозможна. Для классификации анемий принято использовать принцип практической целесообразности. Для этого наиболее удобно делить анемии по единому классификационному признаку — цветовому показателю.
Снижение концентрации гемоглобина в крови часто происходит при одновременном уменьшении количества эритроцитов и изменении их качественного состава. Любая анемия приводит к снижению дыхательной функции крови и развитию кислородного голодания тканей, что чаще всего выражается такими симптомами как бледность кожных покровов, повышенная утомляемость, слабость, головные боли, головокружение, учащенное сердцебиение, одышка и другими.
При рутинном исследовании мазка периферической крови морфолог указывает на отклонение размера эритроцитов в меньшую сторону (микроцитоз) или в большую сторону (макроцитоз), но такая оценка, если она производится без специальных приспособлений — микрометров, — не может быть свободна от субъективизма. Достоинством автоматического анализа крови является стандартизация показателя — СКО. Недостатком является относительно дорогое и сложное оборудование, требующее соответствующего сервисного обслуживания, что зачастую невозможно в условиях российского здравоохранения на периферии.
Замена цветового показателя на показатель СКО не нарушает привычной классификации анемий, построенной на основании цветового показателя.
Анемия
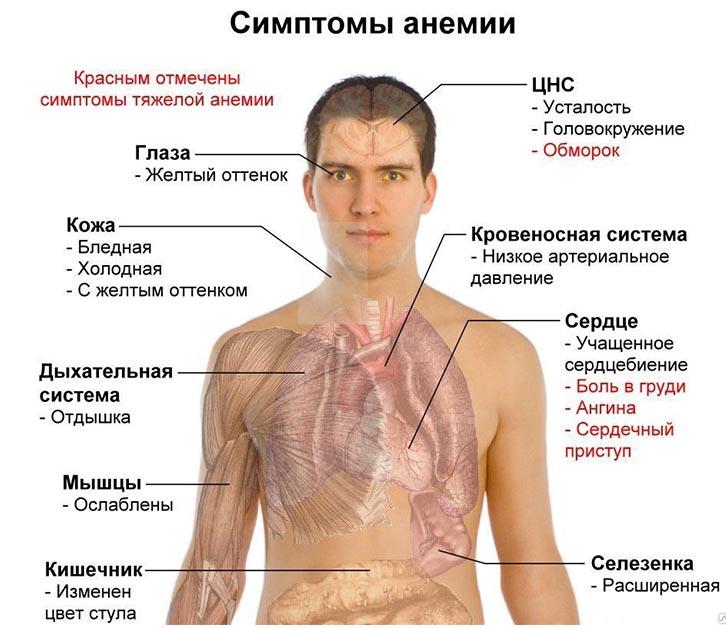
Симптомы
Нередко анемия протекает без выраженных проявлений и часто остаётся незамеченной, во многих случаях становясь случайной лабораторной находкой у людей, не предъявляющих специфических жалоб.
Как правило, страдающие анемией отмечают проявления, обусловленные развитием анемической гипоксии. При лёгких формах это может быть слабость, быстрая утомляемость, общее недомогание, а также снижение концентрации внимания. Люди с более выраженной анемией могут жаловаться на одышку при незначительной или умеренной нагрузке, сердцебиения, головную боль, шум в ушах, могут также встречаться нарушения сна, аппетита, полового влечения. При очень сильной анемии, или при наличии сопутствующей патологии, возможно развитие сердечной недостаточности.
Часто встречаемым диагностически важным симптомом умеренной или выраженной анемии является бледность (кожных покровов, видимых слизистых и ногтевых лож). Также ценное значение имеют такие симптомы, как развитие хейлоза и койлонихии, усиление сердечного толчка и появление функционального систолического шума. Проявления острых и тяжёлых анемий всегда более выражены, чем хронических и средней тяжести.
Кроме общих симптомов, непосредственно связанных с гипоксией, у анемий могут быть и другие проявления в зависимости от их этиологии и патогенеза. Например, развитие нарушений чувствительности при B12-дефицитной анемии, желтуха — при гемолитической анемии и пр.
При злокачественной анемии неизбежна ахлоргидрия.
Причины
Анемии при хронических воспалениях:
При инфекциях:
Туберкулёз.
Бактериальный эндокардит.
Бронхоэктатическая болезнь.
Абсцесс лёгкого.
Бруцеллёз.
Пиелонефрит.
Остеомиелит.
Микозы.
При коллагенозах:
Системная красная волчанка.
Ревматоидный артрит.
Узелковый полиартериит.
Болезнь Хортона.
Мегалобластные анемии:
Пернициозная анемия.
Лечение
В основном при лечении анемии используют витамин В12 и препараты железа. Также при низком уровне гемоглобина могут быть применены переливания эритроцитарной массы. В целом тактика лечения зависит от типа анемии и тяжести состояния больного.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Утратил силу — Архив

РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Архив — Клинические протоколы МЗ РК — 2007 (Приказ №764)
Категории МКБ:
Анемия, связанная с питанием, неуточненная (D53.9)
Общая информация
Краткое описание
Железодефицитная анемия (ЖДА) — патологическое состояние, характеризующееся снижением концентрации гемоглобина из-за дефицита железа в организме в результате нарушения его поступления, усвоения или патологических потерь.
Клинические признаки характеризуются сидеропеническим синдромом: эпителиальные нарушения (трофические нарушения кожи, ногтей, волос, слизистых оболочек), извращение вкуса и обоняния, астено-вегетативные нарушения, нарушение процессов кишечного всасывания, дисфагия и диспептические изменения, снижение иммунитета.
Согласно рекомендациям ВОЗ, нижней границей нормы гемоглобина у детей в возрасте до 6 лет следует считать 110 г/л, Ht=33; у детей 6-12 лет — 115 г/л, Ht=34; 12-13 лет — 120 г/л, Ht=36.
Код протокола: PN-P-001 «Железодефицитная анемия у детей»
Профиль: педиатрический
Этап: ПМСП (медицинский пункт)
Код (коды) по МКБ-10:
D53 Другие анемии, связанные с питанием
D50 Железодефицитная анемия
Мобильное приложение «MedElement»
— Профессиональные медицинские справочники. Стандарты лечения
— Коммуникация с пациентами: вопросы, отзывы, запись на прием
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»
— Профессиональные медицинские справочники
— Коммуникация с пациентами: вопросы, отзывы, запись на прием
Скачать приложение для ANDROID / для iOS
Классификация
По этиологии:
1. ЖДА при недостаточном исходном уровне железа (анемия недоношенных, близнецов).
2. Нутритивная (или алиментарная) ЖДА.
3. ЖДА инфекционного или инфекционно-алиментарного генеза.
4. ЖДА при резорбционной недостаточности железа (синдром мальабсорбции и др.).
5. Хроническая постгеморрагическая ЖДА.
По степени тяжести: легкая, средней тяжести, тяжелая.
По патогенезу: острая постгеморрагическая, хроническая.
Факторы и группы риска
1. Анемия беременных.
2. Недоношенность.
3. Нерациональное питание.
4. Заболевания ЖКТ.
5. Глистная инвазия.
6. Кровотечение.
7. Низкий социум.
Диагностика
Диагностические критерии: у детей младше 5 лет жизни ЖДА определяется при концентрации гемоглобина крови менее чем 110 г/л или уровне гематокрита менее 33%.
Перечень основных диагностических мероприятий:
1. Общий анализ крови (6 параметров).
2. Определение гемоглобина.
3. Определение ретикулоцитов.
Перечень дополнительных диагностических мероприятий:
1. ЭКГ.
2. Определение общей железосвязывающей способности.
3. Консультация гастроэнтеролога.
Лечение
Тактика лечения
До достижения 6-месячного возраста рекомендуется исключительно грудное вскармливание.
Детям с ЖДА, находящимся на грудном вскармливании, рекомендуется начало приема железа в 6-месячном возрасте.
Большинству детей, получающих искусственное вскармливание, рекомендуется использование смеси для питания, обогащенной железом, до начала приема ребенком жесткой еды (до 12-месячного возраста). Необходимо проводить обучение и консультации родителей по рациональному питанию для профилактики ЖДА.
Для лечения
недоношенных детей, находящихся на раннем искусственном и смешанном вскармливании с ферментопатиями и нарушениями кишечного всасывания, рекомендуется назначение декстрана железа III (25-100 мг/0,5 мл-2 мл) с 4-месячного возраста 1 раз в сутки с индивидуальным подбором курса.
Доношенные дети должны быть проверены на ЖДА (определение уровня НЬ и Ht) в 6-месячном возрасте, а недоношенные младенцы — не позднее чем в З-месячном возрасте.
Дети с установленной ЖДА должны получать препараты железа – железа соли**, однокомпонентные и комбинации препараты, оральные растворы, содержащие более 20 мг/мл соли железа с аскорбиновой кислотой по 1 табл. или 1-2 драже 3 раза в день, фолиевой кислотой** по 1 табл. 3 раза в день.
Препараты железа назначаются из расчета 3 мг/кг веса в сутки до нормализации гемоглобина, ребилитационная терапия — 1-2 мг/кг веса, не менее 2-3 месяцев. При резистентности к пероральному железу, а также при острых постгеморрагических анемиях с целью быстрого и эффективного восстановления уровня железа рекомендуется назначение декстрана железа III (100 мг/2 мл), 1 раз в сутки с индивидуальным подбором курса.
Питание, обогащенное железом (смесь). Для подтверждения эффективности назначенной терапии у всех детей младшего возраста с ЖДА через 4 недели после начала лечения ЖДА должны быть повторно определены НЬ и Ht. Если отмечается положительный результат на назначенное лечение (увеличение гемоглобина выше или равное 10 г/л, а увеличение Ht на 3% или более) или эти показатели определяются в пределах нормы, то лечение должно продолжаться еще 2 месяца и после этого назначение железа должно быть остановлено. В случае же отсутствия положительного результата на проводимое лечение или при увеличении гемоглобина менее 10 г/л, а увеличении Ht менее чем на 3%, врач должен определить другие возможные причины анемии путем последующего направления больного к гематологу.
Дети младшего возраста с
умеренной или тяжелой ЖДА (НЬ ниже 90 г/л или Ht менее 27%) должны быть проконсультированы гематологом, т.е. рекомендуется внутримышечное введение декстрана железа III (100 мг/2 мл).
Дети 6-12 лет, имеющие факторы риска на ЖДА (плохие условия жизни или питания), требуют повторного скрининга.
Девочки подросткового возраста должны быть обследованы на наличие ЖДА, по крайней мере, один раз между 15 и 25 годами. При присутствии факторов риска (плохое питание, большие менструальные потери крови, донорство и др.) или наличии в анамнезе диагноза ЖДА требуется более частый скрининг (каждый год).
Если ЖДА заподозрена на основании анализа периферической крови, взятой из пальца, то наличие ЖДА желательно подтвердить анализом крови, взятой из вены. Для девочек-подростков анемия определяется на уровне гемоглобина ниже 120 г/л, Ht- ниже 36%.
При концентрации гемоглобина ниже вышеуказанной границы более чем на 20 г/л, подростки должны получать терапевтическую дозу элементарного железа — 60 мг два раза в день (общая доза 120 мг железа), кроме того, необходимо обучение правильному питанию.
Врач должен проверить эффективность назначенной терапии через 1 месяц. Если результат незначительный или его вообще нет (увеличение гемоглобина менее 10 г/л; или увеличение Ht менее 3 единиц), клиницист должен определить другие возможные причины анемии путем последующего направления больной к гематологу.
При наличии воспалительного или инфекционного процессов, низкая концентрация гемоглобина или объем гематокрита может свидетельствовать о развитии ЖДА вследствие нарушения распределения железа в организме и требует дополнительного лечения. При получении положительного результата на назначение препарата железа, терапия должна продолжаться до достижения концентрации гемоглобина 120 г/л, после чего доза железа может быть снижена до 120 мг в неделю, и продолжаться в течение 6 месяцев.
Тяжелая ЖДА обычно нетипична для девочек подросткового возраста и дефицит железа редко является причиной такой анемии. Подробная информация о развитии болезни, включая характер питания, более глубокое обследование и дополнительные u1083 лабораторные анализы (общий анализ крови, сывороточное железо, содержание трансферрина, концентрация ферритина, количество ретикулоцитов, общий белок, общий билирубин и его фракции) показаны для окончательного подтверждения ЖДА.
У девочек подросткового возраста применение сбалансированного питания для профилактики ЖДА может остановить развитие ЖДА и предотвратить назначение препаратов железа. Поэтому необходимо уделять особое внимание, потреблению мяса и продуктов, богатых аскорбиновой кислотой (для увеличения всасывания железа из продуктов питания), исключить потребление чая и кофе во время приема пищи. У девочек подросткового возраста с высоким риском множественной микроэлементной недостаточности, назначить мультивитаминно — минеральные препараты, содержащие около 30 мг железа в таблетке.
После окончания курса лечения рекомендуется прием препарат элементарного железа с профилактической целью один раз неделю в течение 6 месяцев:
— возраст 6-12 мес. — доза препарата элементарного железа — сироп 30 мг или 3 мг/кг;
— возраст 12-18 мес. — доза препарата элементарного железа — 60 мг.
Перечень основных медикаментов:
— **железа соли, однокомпонентные препараты и комбинированные препараты, содержащие более 20 мг/мл соли железа
— **аскорбиновая кислота 50 мг, 100 мг, 500 мг табл.; 50 мг драже
— фолиевая кислота 1 мг табл.
— декстран железа III (100 мг/2 мл) для внутримышечного введения, амп.
Перечень дополнительных медикаментов: препараты элементарного железа 30-60 мг табл.
Показания для госпитализации: отсутствие нормализации клинико-лабораторных показателей через 2 недели.
Индикаторы эффективности лечения: нормализация показателей Hb и общего состояния ребенка, увеличение Hb на 10 г/л или более при лечении препаратами железа через 4 недели.
* – препараты, входящие в список основных (жизненно важных) лекарственных средств
** — входит в перечень видов заболеваний, при амбулаторном лечении которых лекарственные средства отпускаются по рецептам бесплатно и на льготных условиях
Информация
Источники и литература
- Протоколы диагностики и лечения заболеваний МЗ РК (Приказ №764 от 28.12.2007)
- Список использованной литературы:
1. Клиническое руководство по скринингу, профилактике и лечению
железодефицитной
анемии. Ташкент 2004, 68 с.
2. PRODIGY Guidance — Anaemia — iron deficiency Clinical Practice Guidelines, 2005
3. Screening for Iron Deficiency. Anemia—Including Iron Prophylaxis. Clinical guidelines
4. Iron Deficiency Anaemia. Assessment, Prevention and Control. A guide for programme
managers.
- Список использованной литературы:
Информация
Список разработчиков: Джаксон Н.Л., Республиканский Медицинский Колледж
Прикреплённые файлы
Внимание!
Если вы не являетесь медицинским специалистом:
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Источник
Рубрика МКБ-10: D63.0*
МКБ-10 / D50-D89 КЛАСС III Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм / D60-D64 Апластические и другие анемии / D63* Анемия при хронических болезнях, классифицированных в других
Определение и общие сведения[править]
Анемия — хорошо известное осложнение злокачественного заболевания и его лечения. Частота анемии у онкологических больных различается в зависимости от типа опухоли и характера лечения. Снижение концентрации гемоглобина в крови может быть одним из первых признаков заболевания, однако между степенью выраженности анемии и тяжестью злокачественного процесса, определившего её появление, нет прямой зависимости. Более 1/2 пациентов со злокачественными заболеваниями лёгких, мочеполовой системы, органов женской половой системы в течение болезни нуждаются в гемотрансфузии, тогда как лёгкая и умеренная анемии встречаются ещё чаще. У больных с лимфомой на момент постановки диагноза в 40% случаев выявляют анемию (Нb ‹ 120 г/л), к 3-4-му курсу химиотерапии этот показатель возрастает до 70%
Этиология и патогенез[править]
Клинические проявления[править]
Анемия проявляется целым рядом симптомов, обусловленных развитием тканевой гипоксии в органах и тканях с последующим нарушением их функций. Степень выраженности этих симптомов зависит от ряда факторов, таких, как выраженность анемии, скорость развития компенсаторных механизмов, сопутствующей патологии и функционального статуса пациента. По степени выраженности классификация Национального института рака (NCI) США выделяет лёгкую, умеренную, выраженную и тяжёлую анемию; в табл. 3 показано, как она соотносится с принятыми Всемирной организацией здравоохранения (WHO) и Европейской организацией по исследованиям и лечению рака (EORTC) классификациями.
Проявления анемического синдрома, их выраженность определяются не только уровнем гемоглобина крови, но и скоростью снижения его концентрации. Медленно развивающаяся анемия у молодого человека долго остаётся клинически незаметной, как правило, до значительного или резкого уменьшения концентрации гемоглобина или эпизода перегрузки. Для пожилого больного с «букетом» сопутствующих заболеваний даже незначительное, но быстрое снижение концентрации гемоглобина может иметь тяжёлые последствия: ухудшение течения ишемической болезни сердца, неврологические, психотические расстройства и т.д. Анемия при хронической сердечной недостаточности сама по себе является фактором, ухудшающим выживаемость. Снижение концентрации гемоглобина ниже 80 г/л у пациента, страдающего ишемической болезнью сердца, достоверно увеличивает вероятность эпизода коронарной недостаточности. При внимательном и целенаправленном опросе пациента выявляют другие признаки анемического синдрома: депрессию и нарушение сна, снижение либидо и головокружение при резком вставании, снижение способности к умственному труду, расстройства памяти и настроения, утомляемость.
Утомляемость (fatigue) — состояние слабости, следующее после эпизода физического/умственного напряжения и характеризующееся уменьшением работоспособности и снижением эффективности ответа на стимуляцию. Этот симптом встречается у 75% онкобольных. Более того, в условиях доступности полноценного обезболивания утомляемость описывают как самый частый симптом рака. Исследование Vogelzang N.J. и соавт. на группе из 419 пациенток с различными онкологическими заболеваниями, выбранных случайно из 100 тыс. домохозяек при телефонном опросе, показало, что 78% больных испытывали утомляемость в процессе болезни и лечения. Более 60% пациенток отмечали, что утомляемость ухудшала повседневную жизнь сильнее, чем вызванная опухолью боль. В исследовании французских онкологов пациенты определили утомляемость как основной побочный эффект химиотерапии, более значимый, чем тошнота и боль.
Анемия при новообразованиях (C00-D48+): Диагностика[править]
Дифференциальный диагноз[править]
Анемия при новообразованиях (C00-D48+): Лечение[править]
До последнего времени в современной литературе, посвящённой проблеме раковой анемии, не было однозначных указаний на то, при каких показателях Hb крови следует начинать лечение или профилактические мероприятия, какому методу лечения следует отдавать предпочтение. Однако уже сегодня появились клинические руководства по лечению как постцитостатической, так и собственно раковой анемии.
Условно в лечении анемии можно выделить 2 подхода: патогенетический и симптоматический. К патогенетическому варианту можно отнести устранение причин анемии, в том числе эффективное противоопухолевое лечение, коррекцию дефицита кофакторов гемопоэза (ионов железа, фолиевой кислоты) и алиментарных нарушений. Отдельно следует рассматривать необходимость устранения абсолютного или относительного дефицита эндогенного эритропоэтина. Пример симптоматического лечения — трансфузия эритроцитарной массы, восполняющая количественный дефицит эритроцитов.
Метод переливания крови и её компонентов в истории медицины последнего столетия занимает одно из главных мест. Трансфузия эритроцитарной массы — признанный вариант лечения хронической анемии. Современные лаборатории, оснащённые по последнему слову техники, при анализе крови доноров на наличие инфекции используют наиболее точные методики (ПЦР-диагностика), основным недостатком которых является дороговизна. В медицине Европы и США это свело к минимуму вероятность передачи возбудителей вирусных инфекций — вируса иммунодефицита человека, сывороточного гепатита (В и С), цитомегаловируса и т.д. Но среди осложнений многократных гемотрансфузий по-прежнему актуальны сывороточный гепатит, ВИЧ-инфекция, цитомегаловирусная инфекция, а также аллергические реакции, анафилаксия, перегрузка железом (гемосидероз печени и миокарда).
Несомненно, указанные риски влияют на решение врача в назначении трансфузии эритроцитарной массы при лечении анемического синдрома. Средний уровень гемоглобина крови в странах Европы, при котором назначают переливания эритроцитной массы, составляет 82 г/л . Принимая во внимание новые данные о значении анемии для качества жизни, эта точка отсчёта в большинстве случаев неадекватна. Но даже если показанием к гемотрансфузии будет Hb ‹ 90 г/л, большую часть времени пациенты будут жить с субоптимальным уровнем гемоглобина. Главное преимущество трансфузии эритроцитной массы — быстрое и дозируемое увеличение концентрации гемоглобина крови следует использовать в случаях острой симптомной анемии.
В реальной клинической ситуации (особенно в случаях субоптимальной анемии) маловероятно, что онколог предложит пациенту и госпитализирует его для переливания эритроцитарной массы. Как правило, лечебные мероприятия ограничиваются перерывом в проведении противоопухолевого лечения с последующей редукцией доз цитостатиков, назначением препаратов железа, поливитаминов. Одна перелитая стандартная доза эритроцитарной массы позволяет увеличить концентрацию Hb на 10 г/л, и, конечно, для достижения и поддержания уровня Hb в пределах физиологической нормы понадобятся неоднократные гемотрансфузии. При этом пропорционально возрастает вероятность таких осложнений, как иммуносупрессия, аллергические реакции, перегрузка Fe2+ печени и миокарда, инфицирование пациента.
Первый рекомбинантный человеческий эритропоэтин (эпоэтин альфа) зарегистрирован в 1993 г. для лечения анемии при онкологических заболеваниях. Препарат аналогично эндогенному эритропоэтину стимулирует дифференцировку клеток-предшественников эритроидного ряда, воздействуя на митоз. Позднее появились препараты рекомбинантного эритропоэтина: эритропоэтин бета (этоэтин бета). Применение ЭПО позволяет в большинстве случаев компенсировать абсолютный или относительный дефицит эндогенного эритропоэтина, что в конечном итоге приводит к увеличению концентрации Hb крови. ЭПО следует назначать при анемии I-III степени, при быстром (10 г/л за 1 мес) снижении концентрации Hb на фоне лечения, при наличии противопоказаний к гемотрансфузии. Стандартный дозовый режим как при коррекции постцитостатической, так и раковой анемии предполагает подкожное введение препарата по 10 000 MЕ 3 раза в неделю. Длительность применения ЭПО ограничивается, как правило, его эффективностью. В случае эффекта (повышение концентрации гемоглобина на 10 г/л за 4 нед лечения в дозе 10 000 МЕ 3 раза в неделю) терапию продолжают до достижения границы физиологической нормы Hb (> 110 г/л). Лечение может быть продолжено с редукцией дозы на 30% (ЭПО по 10 000 МЕ 2 раза в неделю) до достижения концентрации Hb 120-130 г/л. В последующем препарат можно использовать повторно при рецидиве анемии. Эффективность ЭПО не зависит от концентрации в крови эндогенного эритропоэтина, концентрации сывороточного железа и объективного статуса пациента.
Феномен функционального дефицита железа (несоответствие количества доступного для синтеза гема Fe2+ потребностям ускоренного эритропоэза) может быть одной из причин недостаточной эффективности ЭПО. Помимо снижения концентрации ферритина плазмы ‹ 100 нг/мл, косвенным признаком дефицита железа является снижение показателя насыщения трансферрина плазмы ‹ 20%. В этой ситуации одновременно с ЭПО обычно рекомендуют приём пероральных препаратов железа в дневной дозе элементарного железа 200 мг.
Рандомизированное исследовании Auerbach и соавт. оценило влияние метода введения препаратов железа одновременно с терапией ЭПО (эпоэтин альфа по 10 000 МЕ 3 раза в неделю в течение 6 нед). Эффективность ЭПО была достоверно выше при парентеральном введении препартов железа по сравнению с использованием перорального приёма препаратов железа или без применения препаратов железа. При парентеральном приёме препаратов железа эффект ЭПО был таким же, как и в группе пациентов, не получавших препаратов железа. Учитывая вероятность нарушения процесса абсорбции ионов железа в двенадцатиперстной кишке, описанного при анемии опухолевого процесса, более обосновано использование парентеральной формы препаратов железа.
Лечение ЭПО в стандартных дозах малоэффективно приблизительно у 30% пациентов (прирост Hb ‹ 10 г/л за 4 нед), но при уточнении противопоказаний к применению рекомбинантного эритропоэтина это число может быть меньше. Относительными противопоказаниями являются неконтролируемая артериальная гипертензия, кровотечение, тяжёлые коагулопатии, гемоглобинопатии, активная инфекция, нарушение белково-синтетической функции печени, значительное снижение резервов костномозгового кроветворения после многократных курсов химиотерапии и лучевого лечения, неэффективность предшествующего применения ЭПО, неблагоприятный прогноз жизни (‹ 8 нед), кахексия.
Анемия, развившаяся на фоне противоопухолевого лечения, как правило, углубляется от курса к курсу. Чем больше разрыв с физиологической нормой Hb, тем больше сил и, главное, времени потребуется организму пациента и лечащему врачу для его восстановления. Выявление анемии является показанием к уточнению патогенеза анемии и к началу её лечения. В исследовании Littlewood и соавт. было показано, что раннее назначение ЭПО по сравнению с отложенным началом терапии позволяет добиться быстрого прироста Hb (138 vs 128 г/л) и минимизировать потребности в гемотрансфузиях (7% vs 28%)
Профилактика[править]
Профилактическое использование препаратов рекомбинантного эритропоэтина в онкологии проходит стадию клинических исследований. Современные руководства по лечению анемии воздерживаются от рекомендаций по превентивному введению ЭПО.
Прочее[править]
ЭПО (эриторопоэтин) и гемотрансфузии
Рандомизированное плацебо-контролируемое исследование, проведённое Littlewood и соавт., показало, что эпоэтин альфа (ЭПО) уменьшает потребность в гемотрансфузиях у пациентов с анемией, которые получают противоопухолевую химиотерапию. В группе пациентов, получавших ЭПО, по сравнению с группой, получавшей плацебо, частота гемотрансфузий была значимо ниже (24,7 против 39,5% соответственно; р = 0,0057), а концентрация гемоглобина повысилась в большей степени (на 22 г/л против 5 г/л соответственно; p ‹ 0,001). В работе Seidenfeld J. и соавт. был представлен мета-анализ 22 клинических исследований, проведённых до публикации результатов исследования Littlewood и соавт. Лечение ЭПО снизило потребность в гемотрансфузии на 9-45% среди пациентов со средними исходными концентрациями Hb ≤ 100 г/л (n = 1080), на 7-47% среди пациентов со средними исходными концентрациями 100‹ Hb ‹ 120 г/л (n = 431) и на 7-39% среди пациентов со средними исходными концентрациями Hb > 120 г/л (n = 308). Обобщённое отношение шансов гемотрансфузии при использовании ЭПО по сравнению с контрольной группой составило 0,45 (95% ДИ = 0,33-0,62) в рандомизированных исследованиях и 0,14 (95% ДИ = 0,06-0,31) в прочих исследованиях. Диапазоны снижения частоты гемотрансфузий были сходными у пациентов с разными начальными уровнями гемоглобина. Мета-анализ однозначно показал, что лечение ЭПО достоверно снижает вероятность гемотрансфузии у пациентов, получающих противоопухолевую химиотерапию.
Источники (ссылки)[править]
«Онкология [Электронный ресурс] : клинические рекомендации / Абузарова Г.Р., Алексеев Б.Я., Антипов В.А. и др. Под ред. В.И. Чиссова, С.Л. Дарьяловой. — 2-е изд., испр. и доп. — М. : ГЭОТАР-Медиа, 2009. — (Серия «Клинические рекомендации»).» — https://www.rosmedlib.ru/book/RML0307V3.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
- Дарбэпоэтин альфа
- Железа (III) гидроксид полимальтозат
- Элтромбопаг
- Эпоэтин альфа
- Эпоэтин бета
- Эпоэтин тета
Источник
