Книга храп и синдром обструктивного апноэ сна
Текущая страница: 1 (всего у книги 10 страниц) [доступный отрывок для чтения: 7 страниц]
Храп и синдром обструктивного АПНОЭ сна у взрослых и детей. Практическое руководство для врачей
Список сокращений
АД – артериальное давление
ДТП – дорожно-транспортные происшествия
ИАГ – индекс апноэ/гипопноэ
ИБС – ишемическая болезнь сердца
ИД – индекс десатураций
ИМТ – индекс массы тела
ЛУПП – лазерная увулопалатопластика
МКП – мониторинговая компьютерная пульсоксиметрия
ОФД – отделение функциональной диагностики
ПСГ – полисомнография
ПЦПР – прогностическая ценность положительного результата
СОАС – синдром обструктивного апноэ сна
ЭКГ – электрокардиограмма
ЭМГ – электромиограмма (тонус подбородочных мышц)
ЭОГ – электроокулограмма (движения глаз)
ЭЭГ – электроэнцефалограмма
AutoCPAP – аппарат с автоматической настройкой лечебного давления в реальном времени СРАР – Continuous Positive Airway Pressure (постоянное положительное давление в дыхательных путях)
NYHA – New York Heart Association (Кардиологическая ассоциация Нью-Йорка)
РАТ – Peripheral Arterial Tone (периферический артериальный тонус)
REM – Rapid Eye Movies (быстрые движения глазных яблок)
SpO2 – Сатурация
Введение
Около 30 % всего взрослого населения постоянно храпит во сне. Храп не только создает очевидные социальные проблемы, но и является предвестником и одним из основных симптомов синдрома обструктивного апноэ сна (СОАС), проявляющегося остановками дыхания во сне с последующими громкими всхрапываниями. При СОАС тяжелой степени может отмечаться до 400–500 остановок дыхания за ночь продолжительностью до минуты и более (суммарно до 3–4 часов!), что ведет к острому и хроническому недостатку кислорода во время сна. Это, в свою очередь, существенно увеличивает риск развития артериальной гипертонии, нарушений ритма сердца, инфаркта миокарда, инсульта и внезапной смерти во сне.
Каждая остановка дыхания сопровождается частичным или полным пробуждением мозга, что приводит к резкому ухудшению качества сна. У пациента отмечаются пробуждения с ощущением удушья и сердцебиения, беспокойный и неосвежающий сон. Утром беспокоит разбитость и головная боль. В течение дня отмечаются тяжелая сонливость, раздражительность, сниженный фон настроения. Особенно опасны приступы острой сонливости во время управления автомобилем, существенно увеличивающие риск дорожно-транспортных происшествий. Ухудшается память и внимание, увеличивается масса тела, развивается импотенция.
Как видно, заболевание проявляется множеством симптомов, по поводу которых больной может обращаться к терапевту, кардиологу, неврологу, оториноларингологу, пульмонологу, эндокринологу и даже сексопатологу и психиатру. Особую важность данное заболевание приобретает у пожилых пациентов. Во-первых, в связи с высокой распространенностью СОАС у данной категории лиц. Во-вторых, из-за частых ошибок в его диагностике, когда симптомы СОАС интерпретируются как проявления церебрального атеросклероза, деменции и ряда других заболеваний. Более того, в пожилом возрасте наличие СОАС значительно утяжеляет течение ИБС, артериальной гипертонии и хронической обструктивной болезни легких. Еще одной важной проблемой является ошибочное назначение бензодиазепиновых транквилизаторов пожилым пациентам, которые противопоказаны при СОАС и могут провоцировать гипертонические кризы, инсульты, и внезапную смерть во сне.
Нарушения дыхания во сне актуальны и в педиатрической практике. Храп отмечается у 10–14 % детей в возрасте 2–6 лет, СОАС – у 1–3 %. Апноэ сна тяжелой степени у детей имеют драматические последствия: выраженный синдром дефицита внимания и гиперактивности, отставание в физическом и психическом развитии.
К сожалению, отечественные врачи еще недостаточно информированы о влиянии СОАС на здоровье человека и не уделяют его диагностике должного внимания. При этом сами пациенты не жалуются на остановки дыхания во сне, а храп считают недостойным внимания врача симптомом и не предъявляют соответствующих жалоб. В этой ситуации даже ярко выраженный СОАС тяжелой степени часто остается недиагностированным и нелеченным, что значительно ухудшает качество и прогноз жизни больных.
Установление точного диагноза важно и потому, что в настоящее время существуют эффективные методы лечения СОАС, в частности применение неинвазивной вспомогательной вентиляции легких постоянным положительным давлением во время сна (СРАР-терапия). Данный метод позволяет даже при тяжелой степени СОАС значительно улучшить качество жизни человека и предотвратить серьезные осложнения.
Определение и классификация
Синдром обструктивного апноэ сна (СОАС) – это состояние, характеризующееся наличием храпа, периодическим спадением верхних дыхательных путей на уровне глотки и прекращением легочной вентиляции при сохраняющихся дыхательных усилиях, снижением уровня кислорода крови, грубой фрагментацией сна и избыточной дневной сонливостью [1].
Из определения видно, что в основе болезни лежит периодическое прекращение дыхания из-за спадения стенок дыхательных путей на уровне глотки. Дыхательные пути могут смыкаться полностью, и тогда развивается апноэ – прекращение воздушного потока (легочной вентиляции) длительностью 10 секунд и более. При неполном спадении дыхательных путей отмечается гипопноэ – существенное снижение воздушного потока (более 50 % от исходных значений), сопровождающееся снижением насыщения гемоглобина артериальной крови кислородом (сатурации) на 3 % и более [2].
Апноэ и гипопноэ могут быть обструктивными и центральными. При обструктивном апноэ сна отмечается коллапс дыхательных путей при продолжающихся дыхательных усилиях (функция дыхательного центра сохранена). При центральном апноэ сна (дыхание Чейна-Стокса и другие формы) отмечается снижение функции или остановка дыхательного центра и прекращение дыхательных усилий. При этом дыхательные пути остаются открытыми. Предметом данного пособия является обструктивное апноэ сна, которое в терапевтической практике встречается существенно чаще, чем различные формы центрального апноэ.
Общепризнанным критерием степени тяжести СОАС является частота апноэ и гипопноэ в час – индекс апноэ/гипопноэ (ИАГ). Считается нецелесообразным подсчитывать отдельно количество апноэ и гипопноэ, так как они несут схожие риски в отношении развития сердечно-сосудистых и иных осложнений. В настоящее время большинство международных консенсусов и клинических рекомендаций [3–5] придерживается классификации, приведенной в таблице 1.
Таблица 1.
Классификация тяжести СОАС у взрослых на основании ИАГ [5].

Применение именно этих пограничных значений в классификации тяжести СОАС основывается на результатах крупных проспективных контролируемых исследований, которые показали достоверное увеличение частоты сердечно-сосудистых осложнений при ИАГ >15 в 2–3 раза и при ИАГ >30 в 5–6 раз [6–8]. Мы также применяем эту классификацию в своей практической деятельности.
Дополнительными критериями оценки тяжести СОАС могут служить величина десатурации на фоне эпизодов апноэ/гипопноэ; степень нарушения структуры ночного сна; сердечно-сосудистые осложнения, связанные с нарушениями дыхания (ишемия миокарда, нарушения ритма и проводимости, артериальная гипертония), выраженность когнитивного дефицита.
У детей следует ориентироваться на классификацию, представленную в таблице 2.
Таблица 2.
Классификация тяжести СОАС у детей на основании ИАГ [9].
В педиатрической практике дополнительными критериями степени тяжести состояния являются выраженность синдрома дефицита внимания и гиперактивности, а также степень задержки физического и психического развития.
Список литературы
1. Guilleminault, C; Demen, WC. Sleep apnoea syndromes. New York: Alan R. Liss Inc., 1978.
2. Sleep-related breathing disorders in adults: recommendations for syndrome defnition and measurement techniques in clinical research. Te Report of an American Academy of Sleep Medicine Task Force. Sleep, 1999, 22 – pp.667–689.
3. Management of obstructive sleep apnoea/hypopnoea syndrome in adults. A national clinical guideline [article online], 2003. – URL: https://www.sign.ac.uk/uidelines/fulltext/73/index.html. [Cited: 2012.01.08]
4. NICE technology appraisal guidance 139, march 2008. Continuous positive airway pressure for the treatment of obstructive sleep apnoea/hypopnoea syndrome, Diagnosis and treatment of obstructive sleep apnea in adults, Institute for Clinical Systems Improveme. Bloomington (MN): Institute for Clinical Systems Improvement (ICSI), 2008.
5. Punjabi, NM; Newman, A; Young, T; Resnick, HE; Sanders, M. Sleep disordered breathing and cardiovascular disease: an outcome-based defnition of hypopneas. Am J Respir Crit Care Med, 2008, 177 (10) – pp.1150–1155.
6. Marin, JM; Carrizo, SJ; Vicente, E; Agusti, AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet, 2005, 365 – pp.1046–1053.
7. Marshall, NS; Wong, KKH; Liu, PY; Cullen, SRJ; Knuiman, MW; Grunstein, RR. Sleep Apnea as an Independent Risk Factor for All-Cause Mortality: Te Busselton Health Study. Sleep, 2008, 31 (8) – pp.1079–1085.
8. Young, T; Finn, L; Peppard, PE; Szklo-Coxe, M; Austin, D; et al. Sleep Disordered Breathing and Mortality: Eighteen-Year Follow-up of the Wisconsin Sleep Cohort. Sleep, 2009, 31 (8) – pp.1071–1078.
9. Gozal, D; Kheirandish-Gozal, L. New approaches to the diagnosis of sleep-disordered breathing in children. Sleep Medicine, 2010, 11 (7) – pp.708–713.
Эпидемиология
Распространенность СОАС составляет 5–7 % всего населения старше 30 лет. СОАС тяжелой степени страдают около 1–2 % из указанной группы лиц [1–3]. Данные показатели превышают распространенность бронхиальной астмы [4]. Наши данные по распространенности СОАС у пациентов санатория приведены на рисунке 1.
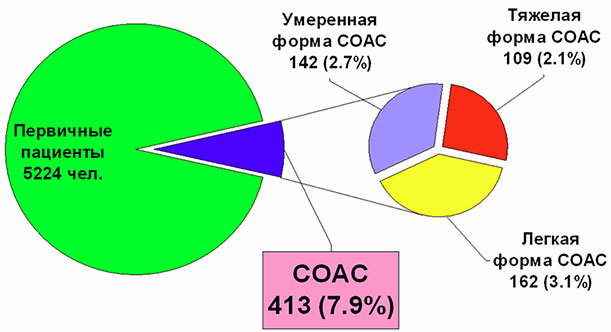
Рис. 1. Частота выявления и тяжесть СОАС у первичных пациентов Клинического санатория «Барвиха» (2006–2008 гг.).
У лиц старше 60 лет частота СОАС значительно возрастает и составляет около 30 % у мужчин и около 20 % у женщин [5]. У лиц старше 65 лет частота заболевания может достигать 60 % [6]. Распространенность храпа у детей в возрасте 2–6 лет составляет порядка 10–14 % [7], апноэ сна – 1–3 % [8].
Распространенность клинически значимых нарушений дыхания во сне достигает 15 % у пациентов терапевтического профиля в стационаре [9–11]. У кардиологических больных распространенность СОАС еще выше. У пациентов с системной артериальной гипертензией этот показатель составляет 30 % [12], а при рефрактерных формах гипертонической болезни достигает 83 % [13]. У больных с ночными брадиаритмиями обструктивное апноэ сна выявляется в 68 % случаев [14]. При ИБС и сердечной недостаточности II–IV функционального класса по классификации NYHA распространенность СОАС достигает 43 % [15]. Таким образом, пациенты с кардиологической патологией находятся в группе риска по наличию нарушений дыхания во сне и требуют пристального внимания и более тщательного обследования с целью выявления СОАС.
Нами было проведено исследование распространенности апноэ сна у пациентов кардиологического стационара. Протокол исследования предполагал сплошное проведение мониторинговой компьютерной пульсоксиметрии (МКП) во время ночного сна у всех пациентов, поступивших в стационарное кардиологическое отделение ФГБУ «ЦКБ с поликлиникой» Управления делами Президента РФ в течение двух месяцев. В анализ было включено 125 человек, что составило 89,9 % всех пациентов, поступивших в отделение за изучаемый период. У 72 % пациентов выявлен индекс десатураций > 5, что указывало на вероятность наличия у них апноэ сна обструктивного или центрального генеза. Из них у 36 % пациентов индекс десатураций был > 15, что соответствовало апноэ сна средней и тяжелой степени. И только у 28 % пациентов не было патологических изменений на кривой ночной сатурации. Таким образом, больше трети обследованных пациентов кардиологического профиля имеют высокую вероятность наличия клинически значимого апноэ сна средне-тяжелой степени различного генеза, что подтверждается работами зарубежных авторов [12,13,15–17].
Распространенность СОАС также высока при ожирении [18], метаболическом синдроме [19], сахарном диабете [20], гипотиреозе [21].
Список литературы
1. Lindberg, E; Elmasry, A; Gislason, T; et al. Evolution of sleep apnea syndrome in sleepy snorers: a population-based prospective study. Am J Respir Crit Care Med, 1999, 159 – pp.6024–6027.
2. Marin, JM; Gascon, JM; Carrizo, S; Gispert, J. Prevalence of sleep apnoea syndrome in the Spanish adult population. Int J Epidemiol, 1997, 26 – pp.381–386.
3. Stradling, JR; Crosby, JH. Predictors and prevalence of obstructive sleep apnoea and snoring in 1,001 middle aged men. Torax, 1991, 46 – pp.85–90.
4. Young, T; Palta, M; Dempsey, J; at al. Te occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med, 1993, 328 – pp.1230–1235.
5. Lindberg, E. Epidemiology of OSA. Eur Respir Mon, 2010, 50 – pp.51–68.
6. Ancoli-Israel, S; Kripke, DF; Klauber, MR; Mason, WJ; Fell, R; Kaplan, O. Sleep-disordered breathing in community-dwelling elderly. Sleep, 1991, 14 (6) – pp.486–495.
7. Young, T; Peppard, PE; Gottlieb, DJ. Epidemiology of obstructive sleep apnea: A Population Health Perspective. Am J Resp Crit Care Med, 2002, 165 (9) – pp.1217–1239.
8. Sohn, H; Rosenfeld, RM. Evaluation of sleep-disordered breathing in children. Otolaryngol Head Neck Surg, 2003, 128 (3) – pp.344–352.
9. Jennum, P; Soul, A. Epidemiology of snoring and obstructive sleep apnoea in the Dannish population age 30–60. J Sleep Res, 1992, 1 – pp.240–244.
10. Lavie, P; Ben-Yosef, R; Rubin, AE. Prevalence of sleep apnea syndrome among patients with essential hypertension. Am Heart J,1984, 108 – pp.373–376.
11. Lindberg, E; Gislason, T. Epidemiology of sleep-related obstructive breathing. Sleep Med Rev, 2000, 4 – pp.411–433.
12. Schulz, R; Grebe, M; Eisele, HJ; Mayer, K; Weissmann, N; Seeger, W. Obstructive sleep apnearelated cardiovascular disease. Med Klin (Munich), 2000, 101 (4) – pp.321–327.
13. Logan, AG; Perlikowski, SM; Mente, A; et al. High prevalence of unrecognized sleep apnoea in drug-resistant hypertensions. J Hypertens, 2001, 19 – pp.2271–2277.
14. Курлыкина, Н. В.; Певзнер, А. В.; Литвин, А. Ю.; Галицин, П. В.; Чазова, И. Е.; Соколов, С. Ф.; Голицын, С. П. Возможности лечения больных с длительными ночными асистолиями и синдром обструктивного апноэ сна созданием постоянного положительного давления воздуха в верхних дыхательных путях.//Кардиология.-2009.– 6 (49). – С. 36–42.
15. Schulz, R; Blau, A; Borgel, J. Sleep apnoea in heart failure. Eur Respir J, 2007, 29 – pp.1201–1205.
16. Marin, JM; Carrizo, SJ; Vicente, E; Agusti, A. G. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet, 2005, 365 – pp.1046–1053.
17. Bitter, T; Langer, C; Vogt, J; Lange, M; Horstkotte, D; Oldenburg, O. Sleep-disordered breathing in patients with atrial fbrillation and normal systolic lef ventricular function. Dtsch Arztebl Int, 2009, 106 (10) – pp.164–170.
18. Bahammam, A; Kryger, M. Decision making in obstructive sleep disordered breathing. Putting It Al Together. Otolaryngologic Clinics of North America, 1999, 32 – pp.333–348.
19. Wilcox, I; McNamara, SG; et al. Syndrome Z: the interaction of sleep apnea, vascular risk factors and heart disease. Torax, 1998, 53 (3) – pp.5–28.
20. Katsumata, K; Okada, T; Miyao, M; Katsumata, Y. High incidence of sleep apnea syndrome in a male diabetic population. Diabetes Res Clin Pract, 1991, 13 – pp.45–51.
21. Lin, C–C; Tsan, K-W; Chen, P-J. Te relationship between sleep apnea syndrome and hypothyroidism. Chest, 1992, 102 – pp.1663–1667.
Этиология
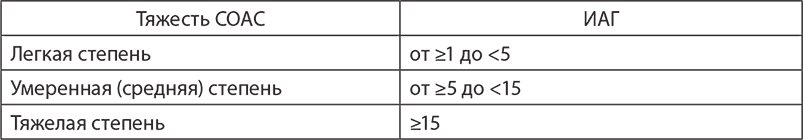
Во сне закономерно снижается общий мышечный тонус, в частности, расслабляются подвижные структуры на уровне глотки. Если имеются предрасполагающие факторы, приводящие к сужению глотки, то может возникнуть храп, обусловленный биением мягкого неба о стенки дыхательных путей. Дальнейшее сужение просвета дыхательных путей может приводить к полному их спадению и развитию эпизода обструктивного апноэ.
Величина просвета верхних дыхательных путей на уровне глотки зависит от исходного внутреннего диаметра, степени снижения давления в просвете во время вдоха и тонуса глоточных мышц во время сна. На рис. 1 представлены причины развития патологического сужения и спадения дыхательных путей во время сна.

Рис. 1. Причины и механизм обструкции дыхательных путей во сне.
Наиболее частой причиной сужения просвета дыхательных путей на уровне глотки у взрослых является ожирение (рис. 2). У пациентов с индексом массы тела (ИМТ), превышающим 29 кг/м2 (ожирение 1 степени и выше), вероятность наличия СОАС в 8–12 раз выше, чем у пациентов без ожирения [1]. У пациентов с ожирением 3 степени (ИМТ>40 к г/м2) тяжелая степень СОАС отмечается более чем в 60 % случаев [2].
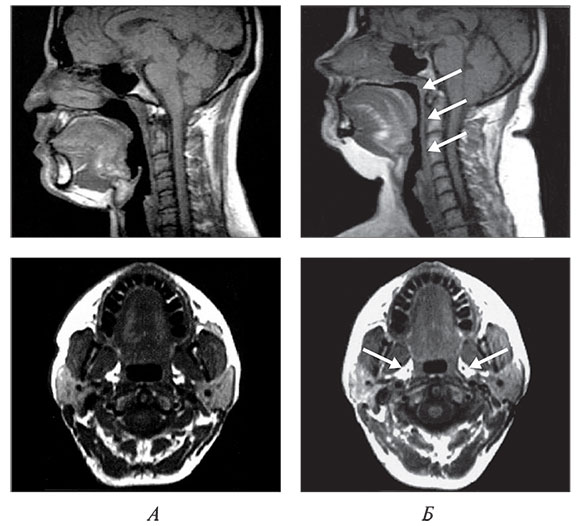
Рис. 2. Сагиттальный и поперечный срез головы в норме (А) и у пациента с ожирением и тяжелой степенью СОАС (Б). Отложения жира отображаются белым цветом. Магнитно-резонансная томография [3].
На рис. 2 Б на сагиттальном срезе отмечается значительное сужение просвета глотки на уровне мягкого неба, корня языка и надгортанника (отмечено стрелками); на поперечном срезе видны значительные отложения висцерального жира рядом с латеральными стенками глотки (отмечено стрелками).
При осмотре у пациентов с ожирением отмечается существенное сужение просвета глотки как за счет отложения жира в самих ее структурах (мягкое небо, небный язычок, боковые дужки), так и сдавления глотки висцеральным жиром преимущественно в области латеральных стенок (рис. 3).
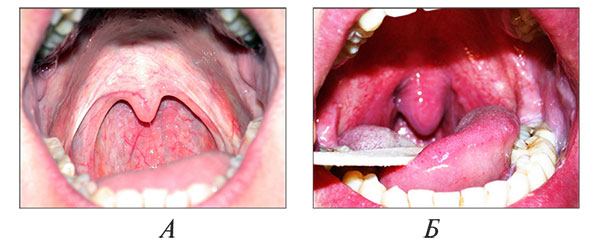
Рис. 3. Просвет глотки при визуальном осмотре в норме (А) и при ожирении (Б) (собственные данные).
Увеличение небных миндалин также может приводить к значительному сужению просвета дыхательных путей на уровне глотки и их спадению во время сна (рис. 4).
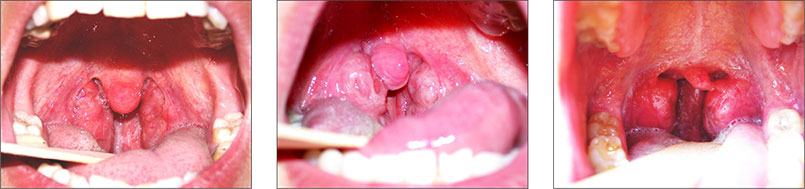
Рис. 4. Гипертрофия небных миндалин 3-й степени (собственные данные).
Основными причинами формирования СОАС у детей являются адено-тонзиллярная гипертрофия, деформации лицевого скелета и ожирение. Важную роль играет аллергический ринит, который рассматривается как самостоятельный фактор риска СОАС у детей [4]. При данном заболевании часто отмечаются хроническая носовая обструкция и аденоиды аллергического или воспалительного генеза. Это обуславливает постоянное дыхание через рот. Впоследствии развивается вторичная гипертрофия небных миндалин [5–7]. Длительно сохраняющееся ротовое дыхание приводит к формированию у ребенка вытянутого по вертикали лица, маленькой и смещенной назад нижней челюсти (микро– и ретрогнатии), «скученности» зубов, увеличенного с горбинкой носа. Данный характерный вид получил название «птичьего» лица (рис. 5).
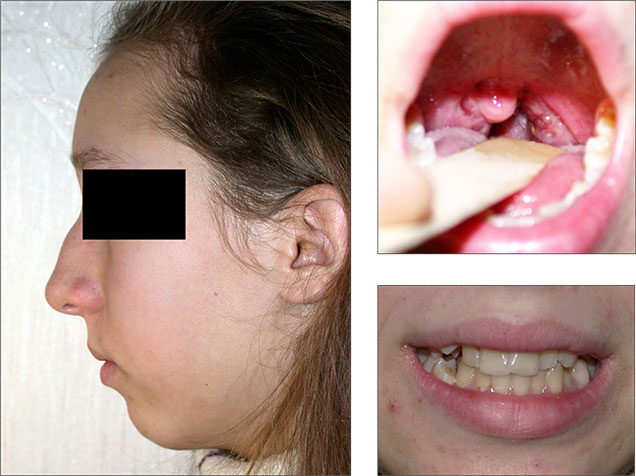
Рис. 5. Пациентка К., 11 лет. Тяжелая степень СОАС (ИАГ 60 в час) (собственные данные).
У пациентки имеется носовая обструкция, обусловленная аденоидами, гипертрофия небных миндалин 3-й степени, «птичье» лицо: выраженная ретро– и микрогнатия, «скученность» зубов, нос с горбинкой.
Если ребенка с хронической носовой обструкцией активно не лечить с самого начала болезни, то сформированные к 10–12 годам дефекты развития лицевого скелета сами по себе будут являться факторами риска развития храпа и СОАС. И даже удаление аденоидов и увеличенных небных миндалин в этом возрасте не всегда даст четкий положительный эффект. У этих пациентов к 25–30 годам может развиваться СОАС умеренной или тяжелой степени даже без существенного набора массы тела (рис. 6).
Пациент с характерным «птичьим» лицом. В анамнезе с детства практически не леченная хроническая носовая обструкция на фоне аллергического ринита, аденоидов и хронического тонзиллита. Аденэктомия не производилась. Тонзиллэктомия в возрасте 18 лет в армии. В 30 лет безуспешное оперативное лечение храпа методом лазерной увулопалатопластики (удаленный небный язычок, рубцовые изменения небных дужек).
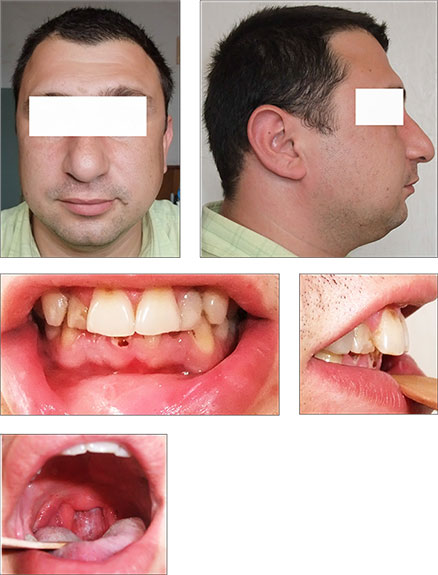
Рис. 6. Пациент С., 34 года. Тяжелая степень СОАС (ИАГ-54 в час), ИМТ – 28 кг/м2(собственные данные).
Предрасположенность к развитию СОАС у пациентов с гипотиреозом обусловлена набором массы тела, глобальным снижением мышечного тонуса и отеком висцеральных тканей при снижении функции щитовидной железы [8,9]. При акромегалии у взрослых отмечается непропорциональный рост отдельных органов и, в частности, языка. Это, в свою очередь, обуславливает сужение просвета глотки на уровне корня языка и увеличивает риск развития СОАС [10].
Нервно-мышечные дистрофические процессы (старение, нейромышечные заболевания, боковой амиотрофический склероз) обуславливают нарушение работы мышц, в том числе, отвечающих за поддержание просвета дыхательных путей в открытом состоянии во сне. Это увеличивает риск спадения стенок глотки и развития СОАС.
Алкоголь обладает миорелаксирующим действием и тормозит активность головного мозга, что способствует возникновению храпа и СОАС [11,12]. Курение также оказывает разноплановое отрицательное воздействие на верхние дыхательные пути, что провоцирует развитие нарушений дыхания во сне.
Следует учитывать, что у одного пациента может сочетаться 2–3–4 различных этиологических фактора СОАС. Это важно учитывать с точки зрения выбора комплексной тактики лечения пациента.
Источник
