Клиническая классификация паранеопластических синдромов по мухину
Паранеопластический синдром (ПНС) — клинико-лабораторное проявление злокачественной опухоли, обусловленное не её локальным или метастатическим ростом, а неспецифическими реакциями со стороны различных органов и систем или эктопической продукцией опухолью биологически активных веществ.[1] Паранеопластические синдромы распространены у пациентов среднего и пожилого возраста, и наиболее часто развиваются при раке лёгких, молочной железы, яичников, а также при лимфоме.[2] Иногда симптомы паранеопластического синдрома манифестируют ещё до диагностики злокачественной опухоли.
Классификация[править | править код]
Паранеопластические синдромы разделяются на 4 основные категории — эндокринные, неврологические, кожно-слизистые и гематологические ПНС, а также другие, не включённые в основные категории:
Неврологические ПНС[править | править код]
Наиболее тяжёлая в клиническом отношении группа паранеопластических синдромов — паранеопластические неврологические расстройства.[8] Эти синдромы могут вовлекать как центральную, так и периферическую нервную систему; некоторые из них сопровождаются нейродегенерацией [9], хотя некоторые (например, миастенический синдром Ламберта — Итона) могут клинически улучшаться на фоне лечения. В числе симптомов паранеопластических неврологических расстройств — атаксия, головокружение, нистагм, затруднение глотания, потеря мышечного тонуса, нарушение координации движений, дизартрия, проблемы со зрением, расстройства сна, деменция, потеря кожной чувствительности.
Более распространены паранеопластические неврологические расстройства при раке молочной железы, лёгких, опухолях яичников, однако встречаются и при многих других злокачественных заболеваниях.
Лечение включает в себя:
- Методы, направленные на лечение опухоли (химиотерапия, радиотерапия, хирургия);
- Методы, направленные на уменьшение или замедление нейродегенерации. Быстрая диагностика и лечение очень важны для возможности неврологического восстановления пациента. В связи с редкостью этой патологии лишь немногие специалисты встречались с ними в клинической практике, поэтому консультация таких специалистов необходима при лечении паранеопластических неврологических расстройств.
Примечания[править | править код]
- ↑ Л. И. Дворецкий — Паранеопластические синдромы
- ↑ NINDS Paraneoplastic Syndromes Information Page Архивировано 4 января 2015 года. National Institute of Neurological Disorders and Stroke (англ.)
- ↑ MeSH Paraneoplastic+endocrine+syndromes
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 Table 6-5 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson. Robbins Basic Pathology (неопр.). — Philadelphia: Saunders, 2007. — ISBN 1-4160-2973-7. 8th edition.
- ↑ MeSH Nervous+system+paraneoplastic+syndromes
- ↑ Cohen P.R., Kurzrock R. Mucocutaneous paraneoplastic syndromes (неопр.) // Semin. Oncol.. — 1997. — Т. 24, № 3. — С. 334—359. — PMID 9208889.
- ↑ Staszewski H. Hematological paraneoplastic syndromes (неопр.) // Semin. Oncol.. — 1997. — Т. 24, № 3. — С. 329—333. — PMID 9208888.
- ↑ Rees J.H. Paraneoplastic syndromes: when to suspect, how to confirm, and how to manage (англ.) // J. Neurol. Neurosurg. Psychiatr. (англ.)русск. : journal. — 2004. — Vol. 75 Suppl 2. — P. ii43—50. — doi:10.1136/jnnp.2004.040378. — PMID 15146039.
- ↑ Darnell R.B., Posner J.B. Paraneoplastic syndromes affecting the nervous system (англ.) // Semin Oncol : journal. — 2006. — Vol. 33, no. 3. — P. 270—298. — doi:10.1053/j.seminoncol.2006.03.008. — PMID 16769417.
Ссылки[править | править код]
- Neuroimmunology, The Medical School, Birmingham University (англ.) — Paraneoplastic neurological autoantibodies, Birmingham UK
- https://www.antibodypatterns.com/hu.php (англ.)
- IPA website (англ.)
- Rockefeller University clinical research laboratory (англ.) devoted to the paraneoplastic neurologic disorders
- Паранеопластические синдромы, видеолекция
Источник
Паранеопластический синдром – комплекс клинических и лабораторных признаков онкологического заболевания, не связанных с ростом первичного новообразования и появлением метастазов. Обусловлен неспецифической реакцией организма и выделением опухолью биологически активных соединений. Проявляется эндокринными, дерматологическими, сердечно-сосудистыми, нейромышечными, нефрологическими, гастроэнтерологическими, гематологическими или смешанными расстройствами. Диагностируется на основании анамнеза, симптомов и данных дополнительных исследований. Лечение – удаление либо консервативная терапия первичной опухоли.
Общие сведения
Паранеопластический синдром – неметастатические системные клинико-лабораторные проявления онкологического заболевания. Страдают преимущественно больные пожилого и среднего возраста. Паранеопластический синдром чаще возникает при лимфоме, раке легких, раке яичников и раке молочной железы. Иногда становится первым признаком ранее недиагностированного онкологического поражения. Играет как положительную, так и отрицательную роль в процессе диагностики онкологических заболеваний.
При отсутствии клинических проявлений первичного онкологического процесса становится неспецифическим маркером новообразования. Вместе с тем, одновременное появление паранеопластического синдрома и локальных симптомов злокачественной опухоли может усложнять клиническую картину и затруднять распознавание онкологического заболевания. Лечение осуществляют специалисты в области онкологии, эндокринологии, кардиологии, гастроэнтерологии, дерматологии и врачи других специальностей.

Паранеопластический синдром
Причины паранеопластического синдрома
Основными причинами развития паранеопластического синдрома являются активность злокачественной опухоли и реакции организма на эту активность. Клетки новообразования выделяют биологически активные белки, энзимы, иммуноглобулины, простагландины, цитокины, интерлейкины, факторы роста, активные и неактивные гормоны, влияющие на деятельность различных органов и систем. Контакт нормальных тканей организма с тканью опухоли и выделяемыми ею соединениями провоцирует нормальные иммунные реакции и вызывает развитие аутоиммунных нарушений.
Вероятность возникновения, интенсивность проявлений и характер паранеопластического синдрома зависят от локализации и вида новообразования, способности опухоли выделять различные активные вещества и генетически обусловленной склонности к аутоиммунным нарушениям. Чаще всего паранеопластический синдром развивается при раке легкого. В числе других онкологических заболеваний, часто провоцирующих этот синдром – рак молочной железы, рак яичников, рак почки, лимфомы, лейкозы, гепатоцеллюлярная карцинома, рак желудка, рак поджелудочной железы и опухоли ЦНС.
Характеристика паранеопластических синдромов
Паранеопластические синдромы – обширная группа синдромов, возникающих при злокачественных опухолях. Кроме того, паранеопластические синдромы выявляются при некоторых доброкачественных новообразованиях и заболеваниях неопухолевой природы, в том числе – при ревматических болезнях, хронических неспецифических заболеваниях легких, болезнях сердца, эндокринных заболеваниях и поражении паренхиматозных органов. Возможность вовлечения любых органов и систем, а также разнообразие клинических проявлений паранеопластических синдромов затрудняют создание единой классификации.
Существует несколько вариантов упорядочивания таких синдромов, наиболее распространенным из которых является группировка по органно-системному принципу (с учетом поражения тех или иных органов). Согласно этому варианту, различают эндокринные/метаболические, дерматологические, почечные, нервно-мышечные/неврологические и некоторые другие виды паранеопластических синдромов. Отличительными особенностями всех синдромов являются:
- общие патогенетические механизмы;
- возникновение при онкологических заболеваниях;
- неспецифичность клинической симптоматики и лабораторных показателей;
- возможность развития паранеопластического синдрома до появления локальных признаков опухоли, одновременно с локальными признаками опухоли либо на заключительных стадиях болезни;
- неэффективность терапии, исчезновение синдрома после радикального лечения новообразования и его повторное возникновение во время рецидива.
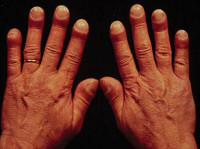
Развитие паранеопластического синдрома до появления местных признаков опухоли может, как облегчать, так и затруднять диагностику основной патологии. Например, синдром Мари-Бамбергера (оссифицирующий системный периостоз, при котором пальцы приобретают вид барабанных палочек) чаще наблюдается при злокачественных поражениях плевры и легких, но не является их специфическим проявлением, поскольку может обнаруживаться и при других заболеваниях, например, при хроническом обструктивном бронхите, циррозе печени или пороках сердца.
Тем не менее, наличие этого паранеопластического синдрома указывает на высокую вероятность патологии дыхательной системы и позволяет достаточно точно определить перечень необходимых обследований. Другие паранеопластические синдромы, например, лихорадка, тромбофлебит или дерматологические поражения могут трактоваться как самостоятельные заболевания, что ведет к недообследованию, назначению неправильного лечения и запоздалому выявлению онкологических поражений, ставших причиной развития данной патологии. Своевременная диагностика и дифференциальная диагностика этой группы патологических состояний остается актуальной проблемой современной онкологии.
Виды паранеопластических синдромов
Гастроинтестинальные паранеопластические синдромы (потеря аппетита, похудание) – самые распространенные синдромы при онкологических заболеваниях. На определенных этапах злокачественного процесса выявляются практически у всех больных. Основными проявлениями паранеопластического синдрома являются потеря аппетита, изменение вкуса, возникновение отвращения к некоторым пищевым вкусам и запахам. После постановки диагноза, прогрессирования локальной симптоматики и начала химиотерапии гастроинтестинальные расстройства могут усугубляться депрессией, страхом перед тошнотой и рвотой, нарушениями проходимости кишечника и другими обстоятельствами.
Гематогенные паранеопластические синдромы выявляются у большинства онкологических больных. Самой распространенной разновидностью этого паранеопластического синдрома является умеренная или нерезко выраженная нормохромная анемия. В анализе периферической крови нередко обнаруживаются другие признаки основного заболевания: повышение СОЭ, лейкоцитоз и сдвиг лейкоцитарной формулы влево. При В-клеточных лимфоидных новообразованиях паранеопластический синдром может проявляться аутоиммунной гемолитической анемией, при меланоме и лимфоме Ходжкина – гранулоцитозом, при лейкозах – тромбоцитопенией, при раке печени и почек – эритроцитозом.
Эндокринные и метаболические паранеопластические синдромы включают в себя разнообразные гормональные и обменные нарушения. При медуллярном раке щитовидной железы может развиваться гипокальциемия, протекающая бессимптомно или сопровождающаяся повышением нервно-мышечной возбудимости. При мелкоклеточном раке легкого паранеопластический синдром проявляется синдромом Кушинга и водно-электролитными нарушениями. Для феохромоцитом характерно повышение артериального давления, для лимфомы Ходжкина – гипоурикемия, для гематосаркомы и острых лейкозов – гиперурикемия.
Сосудистые паранеопластические синдромы обычно проявляются тромбофлебитами. Могут возникать за несколько месяцев до появления первых признаков онкологического заболевания. Чаще всего выявляются при раке молочной железы, опухолях ЖКТ, раке легких и раке яичников. Половина тробмофлебитов у пациентов в возрасте старше 65 лет связаны с развитием злокачественных новообразований. Сосудистые паранеопластические синдромы плохо поддаются антиагрегантной терапии. После оперативных вмешательств развиваются более чем у половины больных онкологическими заболеваниями. Являются третьей по распространенности причиной летальности в послеоперационном периоде.
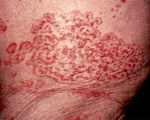
Дерматологические паранеопластические синдромы отличаются большим разнообразием. Включают в себя преходящую эритему, приобретенный ихтиоз, паранеопластическую пузырчатку и другие расстройства. Выявляются при лейкозах, медуллярном раке щитовидной железы и некоторых других онкологических заболеваниях.
Неврологические/нервномышечные паранеопластические синдромы сопровождаются поражением центральной и периферической нервной системы. Могут проявляться энцефалитом, деменцией, психозами, синдромом Ламберта-Итона (слабость мышц конечностей, напоминающая миастению, при сохранении тонуса глазных мышц; обычно возникает при опухолях в области грудной клетке, чаще всего при раке легкого), синдромом Гийена-Барре (периферическая нейропатия, выявляется у некоторых больных лимфомой Ходжкина) и другими периферическими нейропатиями.
Ревматологические паранеопластические синдромы встречаются как при ревматоидных заболеваниях, так и при злокачественных новообразованиях. Системный склероз, полимиалгия и ревматоидный артрит характерны для гемобластозов и опухолей толстого кишечника. Паранеопластический синдром в виде вторичного амилоидоза выявляется при почечно-клеточном раке, лимфомах и миеломе. Гипертрофическая остеопатия может наблюдаться при некоторых разновидностях рака легкого.
Источник
СПРАВОЧНИК НЕВРОЛОГА
Актуальность. Несмотря на наличие [1] клинических и [2] морфологических критериев, которые позволяют дифференцировать первично-множественные опухоли от метастазов, существует порочная тенденция к гипердиагностике метастазов (в т.ч. в центральной нервной системы), вследствие чего пациенты с излечимыми первично-множественными опухолями рассматриваются как инкурабельные. Диагностические ошибки связаны с недооценкой вероятности полинеоплазии, недостаточной осведомленностью о данной патологии, а в ряде случаев и с искусственным занижением показателей онкологической заболеваемости.
Для неврологов (обратите внимание): если у Вашей пациентки с отсутствием симптомов интоксикации, успешно прооперированной (и пролеченной), например, 5 лет назад, по поводу рака молочной железы (обратившейся, например, с жалобами на нарастающую по интенсивности головную боль и/или у которой Вы выявили очаговые церебральные симптомы), при проведении рентгеновской компьютерной томографии (КТ) выявлен очаг «подозрительный» на неоплазму (в т.ч. метастаз) головного мозга, то не следует поддаваться соблазну только лишь «метастатического объяснения церебральной катастрофы»; следует подумать (в том числе намекнуть Вашим коллегам) и о более вероятной причине выявленного на КТ церебрального процесса: ассоциация [1] соматического канцероматозного заболевания и [2] метахронного церебрального опухолевого процесса (первично-последовательный вариант метахронного множественного новообразования) …
Первично-множественные [злокачественные] новообразования (ПМЗНО) — это состояние, при котором у одного и того же человека выявляется [развиваются самостоятельно, то есть независимо друг от друга] два и более злокачественных новообразования (ЗНО) одновременно или через определенный (любой по продолжительности) промежуток времени, в пределах одного или нескольких органов (в т.ч. при условии исключении их метастатической связи). ПМЗНО являются группой заболеваний, которые входят в более обширную группу первично-множественных опухолей (ПМО), в т.ч. включают и доброкачественные опухоли.
ПМЗНО классифицируют в соответствии со сроками (времени) и последовательности обнаружения их выявления: метахронные (выявляемые последовательно, с интервалом более 6 месяцев); синхронные (опухоли, выявляемые в срок до 6 месяцев); метахронно-синхронные (вначале развивается одна опухоль, а через интервал более 6 месяцев выявляются еще две или более опухоли); синхронно-метахронные опухоли (одновременно выявляются 2 или более злокачественные опухоли, а затем диагностируется еще одна злокачественная опухоль). Срок 6 месяцев является условным, не отражает реальное время развития опухоли и используется лишь в качестве клинического критерия.
В зависимости от гистогенеза и локализации полинеоплазии могут быть: [1] мультицентрические (мультифокальные) — развиваются в пределах одного органа; [2] системные опухоли и опухоли парных органов (т.е. развившихся в пределах одной анатомо-функциональной системы — пищеварительный аппарат, респираторная система, система мочеотделения и т.д.; или развившихся в пределах одной анатомической области — полость рта, конечность, забрюшинное пространство и т.д.); [3] несистемные опухоли. [!!!] Синхронно-метахронный, метахронно-синхронный, мультицентрический рак и так далее — также определяются термином «сочетанные первично-множественные новообразования».
Понятие первичной множественности опухолей (ПМО) впервые было введено в практику в 1869 г. Бильротом, который и считается основоположником изучения данной проблемы. Он определил 3 основных критерия первичной множественности опухолей: [1] опухоли располагаются в различных органах; [2] имеют различную морфологическую структуру; [3] каждая из опухолей дает собственные метастазы. В дальнейшем данные положения были пересмотрены, и в 1932 г. S. Warren совместно с O. Gates установили, что единственным и обязательным условием постановки диагноза ПМО является доказанная первичность каждой из опухолей, т. е. они не должны являться метастатическими (лимфогенными, гематогенными или имплантационными метастазами). В 1968 г. появилась одна из первых классификаций ПМО, предложенная С.М. Слипчаком (табл. 1). Позднее был выявлен недостаток классификации С.М. Слипчака — отсутствие групп синхронно-метахронных и метахронно-синхронных опухолей. В 1974 г. вышла новая, дополненная классификация, предложенная В.Г. Бебякиным (табл. 2). Особенностью этой классификации является то, что в ней отражаются сочетания злокачественных, злокачественных и доброкачественных, множественных злокачественных и доброкачественных опухолей. На сегодняшний день накоплен большой опыт в изучении ПМО, в их структуре выделена группа ПМЗНО, предложена их классификация Г.Г. Непряхиным (табл. 3).
В настоящее время ПМЗНО являются достаточно распространенной разновидностью онкологической патологии (частота ПМЗНО составляет в среднем 10 — 15%). Одной из основных причин роста первично-множественных опухолей является появление более эффективных методов лечения, что позволяет больному «дожить» до развития второй опухоли. Анализ клинических данных показывает, что вероятность обнаружения второй опухоли увеличивается, если первая была выявлена у пациента в относительно раннем возрасте (установлено значение временного фактора: чем дольше катамнез у пациентов, ранее пролеченных по поводу неоплазмы, тем чаще у них возникают другие новообразования и в т. ч. головного мозга). Эти данные свидетельствуют о необходимости включения пациентов, перенесших онкологическое заболевание в молодом возрасте, в группу повышенного риска развития вторых новообразований. Другой причиной повышения частоты выявления синхронных и метахронных очагов называют совершенствование методов диагностики. Применение эндоскопических и ультразвуковых методик, а также компьютерной и магнитно-резонансной томографии, серологического, иммунологического и иммуноморфологического исследований с применением специфических антител к опухоль-ассоциированным антигенам позволяет обнаруживать новообразования незначительных размеров, которые не проявляются клинически (при целенаправленном обследовании пациентов с применением новейших диагностических методов частота обнаружения множественных опухолей значительно превышает частоту их выявления на вскрытии и при рутинном клиническом наблюдении за онкологическими больными).
Обратите внимание! С помощью КТ и магнитно-резонансной томографии (МРТ) у больных регулярно обнаруживают (0,35 — 0,5% среди всех случаев неоплазм) множественные независимые новообразования как внутренних органов, так и головного мозга, злокачественной и доброкачественной природы. По данным исследования Б.Н. Бейн [опубликованы в 2017 году] (ФГБОУ ВО «Кировский государственный медицинский университет») выделены следующие варианты ассоциации онкологического процесса с первичной опухолью головного мозга:
подробнее в статье «Ассоциация первичных раков внутренних органов и церебральных новообразований у больных» Б.Н. Бейн, ФГБОУ ВО «Кировский государственный медицинский университет» (журнал «Медицинский альманах» №5, 2017) [читать]
Клинические проявления ПМЗНО мало отличаются от таковых при солитарных новообразованиях. Каждая из развившихся опухолей протекает так же, как солитарная соответствующей локализации и распространенности (особенно при метахронных новообразованиях). При значительной распространенности одной из синхронных опухолей, другая, малых размеров, нередко является находкой при обследовании больного. Несмотря на наличие клинических и морфологических критериев, позволяющих дифференцировать ПМЗНО от метастазов (см. таблицу), существует порочная тенденция к гипердиагностике метастазов, вследствие чего пациенты с излечимыми ПМЗНО рассматриваются как инкурабельные. Диагностические ошибки связаны с недооценкой вероятности полинеоплазии, недостаточной осведомленностью о данной патологии, а в ряде случаев и с искусственным занижением показателей онкологической заболеваемости. Для своевременного распознавания метахронных ЗНО необходимо правильно организованная диспансеризация больных, перенесших радикальное лечение. Пациенты должны наблюдаться на протяжении всей жизни. Наибольшее внимание следует уделять органам, в которых риск метахронного поражения наиболее высок (молочная железа, желудок, матка, яичники, кожа, толстая кишка). Необходимо учитывать, что вероятность появления второй опухоли увеличивается в возрасте старше 55 лет.
Среди вероятностных факторов риска развития у пациентов первично-множественной опухоли головного мозга (как правило, метахронной) можно отметить мегадозное облучение зоны первичной опухоли (например, при раке бронхо-легочной системы), вегетативную нестабильность и гормональную дисфункцию (чаще у женщин [например, овариоэктомия при раке молочной железы]), наличие наследственно-семейной предрасположенности к новообразованиям (исходная генетическая мутацию в системе «проонкогены — гены супрессоры», снижающая контроль пролиферации нервных клеток и их созревания) и длительность наблюдения пациентов после комплексного излечения 1-й опухоли. У больных с церебральной неоплазмой также существует стойкий клеточный и гуморальный иммунодефицит, дополняемый снижением активационных маркеров иммунокомпетентных клеток. Иммунная недостаточность ещё больше угнетается при лучевой и химиотерапии (т. н. «постцитостатический иммунодефицит»), что угнетает противоопухолевую защиту. Поскольку длительность латентного периода между 1-й и последующей множественной опухолью составляет годы — от нескольких лет до 10 — 20, то это обусловливает, как было указано выше, многолетнюю диспансеризацию пролеченных больных с неоплазмой для ранней диагностики и лечения последовательно-множественных новообразований.Использованы также материалы следующих источников:
статья «Тактика лечения больных с первично-множественными злокачественными новообразованиями (обзор клинического наблюдения)» С.В. Поздняков, к.м.н. А.О. Атрощенко, профессор Г.С. Михайлянц; Московский клинический научный центр (на базе ЦНИИ гастроэнтерологии) ДЗ г. Москвы (РМЖ, №13, 2015) [читать];
учебно-методическое пособие «Первично-множественные новообразования. Паранеопластические синдромы» И.В. Михайлов, Т.Н. Нестерович; МЗ Республики Беларусь, УО «Гомельский государственный медицинский университет», кафедра онкологии с курсом лучевой диагностики и лучевой терапии; Гомель, 2014 [читать]
Источник
