Клиническая фармакотерапия хронического болевого синдрома
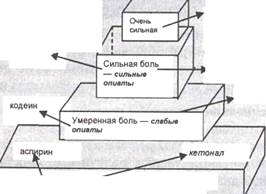
Схемы и принципы фармакотерапии ХБС.На протяжении длительного времени лекарственное лечение боли при запущенных формах злокачественных новообразований сводилось к назначению наркотических препаратов и часто не приносило желаемого обезболивающего эффекта.
В 1986 г. Комитетом экспертов ВОЗ были утверждены принципы анальгезирующей терапии хронического болевого синдрома нарастающей интенсивности, получившие название трехступенчатой схемы (рис. 3.2). Согласно трехступенчатой схемы ВОЗ назначают:
при слабой боли (1-я ступень) — ненаркотические анальгетики,
при умеренной боли (2-я ступень) — слабые опиаты,
при сильной боли (3-я ступень) — сильные опиаты.
В качестве базовых лекарственных препаратов рекомендованы:
при слабой боли — аспирин,
умеренной — кодеин,
сильной -морфин.
Создание новых анальгезирующих препаратов, обладающих преимуществами перед базовыми, позволило МНИОИ им. П.А. Герцена выделить понятие о нестерпимой боли и предложить четырехступенчатую схему (рис. 3.2). В этой схеме в качестве базовых препаратов используются:
при умеренной боли — трамадол,
при сильной боли — бупренорфин,
при нестерпимой боли — морфин.

Рис. 3.2. Схемы противоболевой терапии ВОЗ и МНИОИ
В основу обеих схем положены одинаковые принципы:
О борьбу с хроническим болевым синдромом следует начать
возможно раньше, при появлении даже незначительной боли;
вид и дозу анальгетика нужно подбирать индивидуально,
обеспечивая устранение или значительное облегчение боли в
течение 2-3 дней;
принимать анальгетики нужно не «по требованию» (чтобы
уменьшить боль), а строго «по часам», вводя очередную дозу
препарата до прекращения действия предыдущей (чтобы
предотвратить появление боли);
по мере уменьшения обезболивающего эффекта анальгетики следует изменять «по восходящей линии», переходя от максимальной дозы слабо действующего препарата к минимальной дозе сильно действующего, а не к замене на другой препарат такой же активности;
предпочтение следует отдавать оральному приему препаратов, как наиболее простому, эффективному и наименее болезненному пути введения для большинства пациентов.
Способы оценки интенсивности боли и эффективности обезболивания.Непременным условием успешного лечения является объективная оценка интенсивности болевого синдрома и постоянный контроль эффективности препаратов и побочных влияний медикаментозной терапии. Это позволяет врачу своевременно вносить изменения в систему лечения.
Оценку интенсивности хронической боли производят различными способами. Наиболее простой является оценка по 5-бальной словесной шкале:
0 — боли нет;
1 — слабая боль (чуть-чуть болит);
2 — умеренная боль (болит терпимо);
3 — сильная боль (очень больно);
4 — невыносимая боль (невозможно терпеть).
Более точной и наглядной является оценка по визуально-аналоговой шкале в виде линейки с делениями от 0 до 10 или до 100. Пациенту предлагают самому оценить по такой линейке интенсивность болевых ощущений до начала лечения. Повторная оценка в процессе терапии позволяет судить об эффективности лечебных мер.
Лечение слабой боли.Для первой ступени лечения используют нестероидные противовоспалительные средства (НПВС). Эти препараты тормозят синтез простагландинов Е1 и Е2, сенсибилизирующих болевые рецепторы, обладают противовоспалительным и анальгезирующим действием.
НПВС эффективны при метастазах в кости, опухолях мягких тканей, раке тела поджелудочной железы, а также при вызванном новообразованием механическом растяжении тканей и при воспалительных процессах в окружности опухоли, сопровождающихся отеком. Они не угнетают дыхательный и кашлевой центры, не вызывают эйфории и не приводят к возникновению психической или физической зависимости.
Побочное действие НПВС обусловлено токсическим воздействием на слизистую оболочку желудка, функцию почек, гемостаз и коагуляцию. При длительном применении они могут вызвать эрозивный гастрит, вплоть до желудочных кровотечений.
Базовый препарат схемы ВОЗ — аспирин — назначают по 250-650 мг 6 раз в день. Чаще применяют кетонал илиибупрофен. Используют индометацин, пироксиками другие. Полезен парацетамол, не обладающий выраженным противовоспалительным действием, но и не оказывающий токсического 92
Глава 3. Лечение
воздействия на желудок и кровь. Целесообразно использовать комбинированные препараты на основе парацетамола — панадол-экстра и солпадеин.
Лечение умеренной боли.Базовым анальгетиком второй ступени по схеме ВОЗ является слабый опиат — кодеин.
Применяется в дозах от 30 до 130 мг 4-6 раз в сутки. Доза кодеина в 30 мг по обезболивающему эффекту соответствует 650 мг аспирина.
• Запомните обязательно!
Совместное применение обоих препаратов в этих дозировках вдвое повышает обезболивающий эффект.
По схеме МНИОИ базовым анальгетиком считается трамадол (трамал, традол). Он вдвое превосходит кодеин по анальгезирующему действию, не вызывает тяжелых запоров, не обладает угнетающим влиянием на дыхание и кровообращение.
Для справки
Трамадол выпускается в таблетках, капсулах, каплях, свечах и ампулах. Разовая доза — 50-100 мг, вводится каждые 4-6 ч; максимальная суточная — 400 мг. Анальгетический эффект развивается к 30-й минуте и продолжается 5-6 часов.
Лекарственная зависимость к препарату не развивается, анальгезирующий эффект при ХБС может сохраняться в течение длительного времени.
При снижении эффекта от лечения трамадолом рекомендуют прием защечных таблеток наркотического анальгетика просидела, который хорошо устраняет умеренную и даже сильную боль. Его побочные влияния (тошнота, рвота, головокружение, затрудненное мочеиспускание) мало выражены и обычно ликвидируются самостоятельно в течение недели.
Для справки
Просидол по эффективности близок к промедолу. Защечные таблетки (по 20 мг) быстро всасываются слизистой полости рта. Действие непродолжительно. Прием 4-6 раз в сутки. Разовые дозы 20-80 мг, суточные 80-300 мг/сут.
Лечение сильной и очень сильной боли.По схеме ВОЗ базовым препаратом является морфин, по схеме МНИОИ — бупренорфин.
Бупренорфин (сангезик, темгезик, торгезик и др.) — опиоид центрального действия.
По анальгетической активности несколько уступает морфину, но повышает физическую активность больных, а побочные эффекты менее выражены и не опасны. В меньшей степени, чем морфин, вызывает привыкание и лекарственную зависимость. Одна и та же доза может оставаться эффективной в течение длительного времени.
Для справки
Бупренорфин выпускается в таблетках по 0,2 мг и ампулах по 0,3 и 0,6 мг. Принимается внутрь, в/в, в/м, сублингвально. Максимальная концентрация в плазме через 1 ч. Разовая доза для взрослых при в/в и в/м введении — 0,15-0,3 мг/кг. Инъекции повторяют каждые 3-4 ч. Сублингвальный прием по 0,2-ОД мгс интервалом 6-8 ч. Побочные явления: головная боль, головокружение, потливость, сухость во рту, тошнота, рвота.
С помощью бупренорфина удается достичь хорошего противоболевого эффекта даже у больных, длительно получавших морфин, при этом пациенты не испытывают синдрома отмены.
• Запомните обязательно!
Преимущества бупренорфина позволяют назначать его тяжелым больным на дому.
Морфин среди анальгетиков занимает особое место, поскольку с ним принято сравнивать силу действия и побочные эффекты всех обезболивающих
лекарств.
Препараты группы морфина характеризуются недостатками, существенно затрудняющими их использование, особенно в амбулаторных условиях.
• Оказывают выраженное побочное действие.
Они угнетают дыхание и кашлевой рефлекс, обладают снотворным действием, повышают тонус кишечника и мочевого пузыря, могут вызывать тошноту, рвоту, запор и др.
• К препаратам развивается резистентность.
Первоначальные дозы спустя 2-3 недели оказываются недостаточными для снятия боли или продолжительность действия их укорачивается. Это требует увеличения доз. Параллельно нарастают и побочные эффекты. Лечение больных большими дозами морфина на дому чревато опасными осложнениями.
• При длительном лечении убольных возникает физическая и психическая зависимость от наркотика.
Морфин выпускается в виде гидрохлорида и сульфата. Морфин сульфат обладает продленным действием. Лечение рекомендуют начинать с морфина гидрохлорида, а после подбора оптимальной дозы переходить на лечение морфином сульфатом. Обезболивающее действие морфина проявляется через 10-15 минут после подкожного введения и через 20-30 минут после перорального. Продолжается в течение 3-5 часов у морфина гидрохлорида и 12-ти часов у морфина сульфата.
По мере развития резистентности дозу постепенно повышают. Основными симптомами передозировки являются сонливость, адинамия, рвота, запоры, дезориентация, галлюцинации.
Эти явления требуют снижения дозы или отмены наркотика.
Одновременно с началом терапии морфином следует назначить противорвотные и слабительные средства. К рвотному действию морфина у больных постепенно развивается резистентность, поэтому антиэметики применяют не более 2 недель. Для предупреждения запоров рекомендуют диету с большим количеством жидкости, соков, фруктов, лекарств, стимулирующих перистальтику и опорожнение кишечника. Запоры требуют назначения слабительных, а иногда и клизм в течение некоторого периода терапии морфином.
Таблетированная форма морфина сульфата (МСТ континус) обладает продленным действием. Полный эффект наступает через 2 часа, анальгезия продолжается 12 часов. Побочные действия (тошнота, рвота и др.) возникают редко и купируются противорвотными препаратами.
Многих недостатков, свойственных морфину и опиатам, лишены синтетические опиоиды. К их числу относится буторфанол.
Буторфанол — синтетический анальгетик фенантренового ряда с агонистической и антагонистической активностью. По анальгетической активности и продолжительности действия близок к морфину. Применяется для лечения хронической боли умеренной и высокой интенсивности.
Для справки
Буторфанол (стадол) — выпускается в ампулах по 1,0 мл. вводится в/в, в м. интраназально. При интраназальном введении анальгезия через 1-2 часа, продолжительность действия 4-5 часов.
Меньше морфина угнетает дыхание, реже наблюдается привыкание, не вызывает эйфории и лекарственной зависимости. Возможны тошнота, рвота, усиленное потоотделение, сонливость, головокружение.
Буторфанол у больных с ХБС рассматривают как резервный препарат. Применяют при плохой переносимости опиоидов и опиатов.
Фентанил — синтетический опиоид, по анальгезирующему эффекту превосходит морфин в 100 раз. Способен диффундировать через кожу. Создана специальная трансдермальная система в виде многослойного пластыря, который наклеивается на кожу. Пластырь с фентанилом выпускается под названием «Дюрогезик». Из него препарат постепенно, на протяжении трех суток, поступает в кровь.
Для справки
Диффузия фентанила начинается через 2 часа, анальгезирующий эффект развивается в среднем через 12-13 часов и продолжается в течение 72 часов. После удаления пластыря обезболивающий эффект сохраняется еще на протяжении 12 часов. Новый пластырь наклеивают на другое место.
Дюрогезик удобен для использования в домашних условиях, но возможна брадикардия, угнетение дыхания.
Адъювантные лекарственные средства.Учитывая сложный патогенез ХБС при злокачественных новообразованиях, наркотические препараты следует сочетать с нестероидными анальгетиками периферического действия и дополнительными т. н. «адъювантными» средствами. В противоположность этому не рекомендуется одновременно применять два наркотических препарата, поскольку слабый опиат может блокировать клеточные рецепторы, препятствуя воздействию более сильного.
Адъювантные препараты применяют
• для усиления действия анальгетиков;
• терапии осложнений, связанных с прогрессирующим опухолевым процессом;
• коррекции побочных эффектов обезболивающих препаратов.
Арсенал адъювантных средств широк. Используют кортикостероиды, противосудорожные и антигистаминные препараты, транквилизаторы и нейролептики, антидепрессанты и др.
Кортикостероиды снижают продукцию простагландинов, уменьшают воспаление и отек. Полезны при метастазах в кости, в головной и спинной мозг, при сдавлении опухолью и метастазами нервных стволов.
Противосудорожные препараты (карбамазепин, валъпромид и др.) показаны при сдавлении или прорастании опухолью нервных стволов. Они также оказывают антидепрессивное влияние, улучшают психическое состояние и настроение больных.
Транквилизаторы и нейролептики используют при тревоге, беспокойстве, агрессивности больных.
Антидепрессанты (амитриптилин) назначают при выраженной депрессии. С их помощью удается повысить настроение и улучшить сон.
Терапию нейролептиками, антидепрессантами и противосудорожными препаратами начинают с минимальных доз. Дозы повышают до максимальных, а затем постепенно снижают до полной отмены в течение несколько недель или месяцев в зависимости от конкретной ситуации.
По мере прогрессирования опухоли интенсивность ХБС изменяется, чаще в сторону нарастания. Это требует тщательного наблюдения за больным и периодической смены анальгетиков и адъювантных препаратов.
Вопросы тестового контроля
34. Под термином «радикальная» операция понимают
а) удаление основной массы опухоли
б) удаление части или всего пораженного органа без регионарных лимфатических узлов
в) удаление части или всего пораженного органа в пределах анатомической зоны
г) удаление части или всего пораженного органа с регионарными лимфатическими узлами, но с оставлением отдаленных метастазов
Источник
Комментарии
Н.В. Стуров
Кафедра общей и клинической фармакологии РУДН, Москва
Хронический болевой синдром (ХБС) является компонентом клинической картины многих заболеваний, что предопределяет его высокую распространённость: только в США ХБС страдают приблизительно 86 млн. человек, а ежегодные социально-экономические потери, связанные с терапией ХБС и утратой трудоспособности, оцениваются в 90 млрд. долларов [1, 2]. Знание патофизиологических механизмов ХБС и более широкое использование при этом состоянии некоторых противоэпилептических препаратов (ПЭП) и антидепрессантов (АД) позволят оказывать больным более качественную медицинскую помощь [2].
Виды болевых синдромов
При проведении дифференциальной диагностики болевых синдромов неракового происхождения важно помнить о принципиальных отличиях острой и хронической боли, Острая боль эволюционно является защитным механизмом на экзо- или эндогенное повреждение и передаётся ноцицептивной системой. Хроническая боль чаще представляет собой неадекватно высокий, продолжительный и стойкий ответ на те или иные повреждающие факторы и может передаваться как ноцицептивно, так и существовать на основе патологической межнейронной циркуляции импульсов преимущественно на центральном уровне (нейропатическая боль). Исходя из этих представлений, при лечении ноцицептивной боли традиционно используют анальгетики или нестероидные противовоспалительные средства (НПВС). Для терапии нейропатической боли применяют средства, воздействующие на систему нейротрансмиттеров (АД и ПЭП) [3].
Пациенты с нейропатическим болевым синдромом предъявляют жалобы на жгучие, колющие, стреляющие или ноющие боли, сопровождающиеся дрожью, парестезиями, чувством онемения. Характерна аллодиния – чувство боли, вызываемое нормальными, безболезненными стимулами. Боль обычно усиливается в ночное время или при физических нагрузках.
При установлении ХБС неракового происхождения необходимо определить, какая именно его разновидность (периферическая нейропатическая боль, центральная нейропатическая боль или боль, не связанная с нейропатией) имеется у пациента, что окажет влияние на терапевтическую тактику (табл. 1).
Таблица 1. Причины хронического болевого синдрома неракового происхождения [4]
| Периферическая нейропатическая боль | Центральная нейропатическая боль | Боль, не связанная с нейропатией, или ненейропатическая (элементы нейропатической боли могут накладываться на основную симптоматику) |
|---|---|---|
|
|
|
Механизм действия ТЦА и ПЭП
Передача болевых импульсов по спинному и головному мозгу осуществляется при участии возбуждающих и тормозящих нейротрансмиттеров, а также лимитируется степенью активности натриевых и кальциевых каналов. Норадреналин, серотонин и в наибольшей степени гамма-аминомасляная кислота (ГАМК) являются физиологическими ингибиторами болевой передачи. Антидепрессанты и противоэпилептические препараты облегчают болевой синдром путём воздействия на указанные нейротрансмиттеры и ионные каналы (табл. 2).
Таблица 2. Механизмы действия АД и ПЭП при ХБС [5]
| Механизм действия | Препараты |
|---|---|
| Ингибирование обратного нейронального захвата норадреналина | ТЦА (вторичные амины): дезипрамин, нортриптилин |
| Ингибирование обратного нейронального захвата норадреналина и серотонина | ТЦА (третичные амины): амитриптилин, имипрамин «Новые» антидепрессанты: венлафаксин, дулоксетин Циклобензаприн |
| Блокада натриевых каналов | ПЭП: карбамазепин (Финлепсин), габапентин, ламотриджин |
| Блокада кальциевых каналов | ПЭП: габапентин, прегабалин |
| Улучшение ГАМК-ергической передачи | ПЭП: карбамазепин (Финлепсин) Спазмолитики: баклофен |
Примечание: ТЦА – трициклические антидепрессанты.
ТЦА воздействуют на болевую передачу на уровне спинного мозга, ингибируя обратный захват норадреналина и серотонина, которые накапливаясь, тормозят передачу болевых импульсов. Агонизм в отношении Н1-гистаминовых рецепторов и связанная с этим седация коррелирует с анальгетическим действием ТЦА. Амитриптилин эффективен так же у пациентов с острой болью [6].
ТЦА удобно разделить на производные вторичного и третичного амина. Вторичные амины (нортриптилин, дезипрамин) довольно селективно блокируют нейрональный захват норадреналина. Третичные амины (амитриптилин, имипрамин) практически в равной степени ингибируют захват норадреналина и серотонина, а также обладают выраженным холинолитическим действием [2].
«Новые антидепрессанты» венлафаксин и дулоксетин ингибируют обратный нейрональный захват норадреналина и серотонина, не воздействуя на другие нейрорецепторы, в том числе не обладают холинолитическим действием. Механизм действия бупропиона связан с блокадой обратного захвата дофамина (остальные механизмы действия препарата изучены не до конца) [2].
ПЭП угнетают возбуждение в нейронах и усиливают процессы торможения. Эти препараты воздействуют на вольтаж-зависимые (натриевые и кальциевые) и лиганд-зависимые ионные каналы, на специфические рецепторы глутамата и N-метил-D-аспартата, а также возбуждают глициновые и ГАМК-рецепторы (табл. 3) [7]. Некоторые сведения о препаратах, которые можно использовать при ХБС, приведены в таблице 3.
Таблица 3. Антидепрессанты и ПЭП, применяемые при ХБС [7]
| Препарат | Доза | Неблагоприятные побочные реакции (НПР), противопоказания, комментарии |
|---|---|---|
| Антидепрессанты | ||
| ТЦА | НПР: сухость во рту, запор, задержка мочи, седация, увеличение массы тела | |
| Амитриптилин, имипрамин | 10–25 мг; наращивают по 10–25 мг/нед до дозы от 75 до 150 мг на ночь | Выраженное холинолитическое действие, нельзя использовать в пожилом возрасте |
| Дезипрамин, нортриптиллин | 25 мг утром или на ночь; наращивают по 25 мг/нед до 150 мг/сут | Менее выраженное холинолитическое действие |
| СИОНЗС | ||
| Флуоксетин, пароксетин | 10–20 мг/сут, до 80 мг/сут при фибромиалгии | НПР: тошнота, седация, снижение либидо, головная боль, увеличение массы тела; эффект при ХБС слабый |
| «Новые» антидепрессанты | ||
| Бупропион | 100 мг/сут, нарашивают по 100 мг/нед до 200 мг 2 р/сут | НПР: тревога, инсомния или седация, потеря веса, припадки (при дозе выше 450 мг/сут) |
| Венлафаксин | 37,5 мг/сут, наращивают по 37,5 мг/нед до 300 мг/сут | НПР: головная боль, тошнота, повышенное потооделение, седация, артериальная гипертензия, припадки; серотонинергические эффекты в дозе ниже 150 мг/сут; серотонин- и норадренергические эффекты в дозе выше 150 мг/сут |
| Дулоксетин | 20–60 мг/сут в 1–2 приёма при депрессии, 60 мг/сут при фибромиалгии | НПР: тошнота, сухость во рту, запор, головокружение, инсомния |
| ПЭП | ||
| I поколение | ||
| Карбамазепин1 (Финлепсин) | 200 мг/сут, наращивают по 200 мг/нед до 400 мг 3 р/сут (1200 мг/сут) | НПР: головокружение, диплопия, тошнота, апластическая анемия |
| Фенитоин | 100 мг на ночь, дозу наращивают еженедельно до 500 мг на ночь | НПР: тошнота, головокружение, атаксия, невнятная речь, беспокойство, нарушение кроветворения, гепатотоксичность |
| II поколение | ||
| Габапентин1 | 100–300 мг на ночь, наращивают по 100 мг каждые 3 дня до 1800–3600 мг/сут на 3 приёма | НПР: сонливость, утомляемость, головкружение, тошнота, седация, увеличение массы тела |
| Прегабалин1 | 150 мг на ночь при диабетической нейропатии; 300 мг 2 р/сут при постгерпетической невралгии | НПР: сонливость, утомляемость, седация, головокружение, тошнота, увеличение массы тела |
| Ламотриждин | 50 мг/сут, наращивают по 50 мг каждые 2 нед до 400 мг/сут | НПР: сонливость, запор, тошнота, редко жизнеугрожающие кожные реакции |
Примечание. 1 – препараты, одобренные в США для лечения нейропатической боли.
Клиническая эффективность АД и ПЭП при ХБС
Нейропатическая боль
Эффективность ТЦА в лечении нейропатической боли подтверждена в клинических исследованиях. Другие АД демонстрируют вариабельный эффект при этой патологии. Так, неселективные АД или АД с норадренергической активностью обладают наибольшей эффективностью при нейропатической боли. Амитриптилин и нортриптилин имеют наибольшую доказательную базу из всех АД при терапии нейропатических и ненейропатичеких болевых синдромов [8]. Эффект ТЦА коррелирует с их антидепрессивным действием [9]. Препараты с серотонинергической активностью (типа флуоксетина), как правило, неэффективны в терапии ХБС.
Традиционно при лечении пациентов с нейропатической болью применяют ПЭП, причём чаще других используется препарат первой генерации карбамазепин, особенно при наличии тригеминальной [10] и постгерпетической невралгии [11], а также болевого синдрома на фоне диабетической нейропатии [12]. Частота купирования болевого синдрома при тригеминальной невралгии на фоне приёма карбамазепина колеблется, по данным разных авторов, в пределах 58–90%, а при диабетической нейропатии достигает 63%, что наравне с экономической доступностью определяет широкое использование препарата при этих заболеваниях [13,14].
ПЭП II поколения тоже имеют убедительную базу в плане эффективности при нейропатической боли. В клинических исследованиях габапентин оказался эффективнее плацебо у пациентов с диабетической нейропатией [15] и постгерпетичекой невралгией [16]. Аналогичными свойствами обладает прегабалин [17, 18].
Ламотриджин продемонстрировал эффективность при тригеминальной невралгии [19], невралгии, ассоциированной с ВИЧ-инфекцией [20] и постинсультном болевом синдроме [21]. Препарат неэффективен у пациентов с неспецифической рефрактерной нейропатической болью [22]. Длительное использование ламотриджина во многом ограничивается риском развития опасных для жизни кожных реакций.
АД и ПЭП в целом сравнимы по эффективности при ХБС, особенности имеются лишь в использовании и переносимости препаратов внутри этих групп [23]. Данные различных мета-анализов при сравнении АД и ПЭП рознятся от достоверных различий до отсутствия таковых при терапии нейропатической боли [24, 25]. Например, в одном из двойных слепых рандомизированных исследований не было выявлено отличий в эффективности и переносимости между габапентином и амитриптилином [26].
Ненейропатическая боль
В большинстве случаев при различных ненейропатических болевых синдромах эффективны ТЦА (хотя выраженность их действия может снижаться с течением времени) [27], остальные АД и ПЭП активности при этих состояниях не демонстрируют.
АД имеют среднюю степень эффективности в редуцировании выраженности болевого синдрома и беспокойства, улучшении сна и общего состояния больных фибромиалгией. Сравнительный анализ различных схем лечения фибромиалгии затруднен из-за несоответствия критериев оценки клинического результата. Во многих исследованиях демонстрируется сравнимость эффектов большинства АД, транквилизаторов, циклобензаприна и НПВС, но обращает на себя внимание высокая активность амитриптилина [28].
Флуоксетин оказывает значимое действие при болевом синдроме на фоне фибромиалгии в дозе 80 мг/сут и не обладает таковым в дозе 20 мг/сут [29]. Циклобензаприн (миорелаксант, являющийся по структуре трициклическим соединением) обладает при фибромиалгии слабо выраженным действием [30].
Из ПЭП эффективными средствами при фибромиалгии считаются дулоксетин [31] и прегабалин [32].
АД имеют достоверный (но слабый) эффект при хронической поясничной боли [33]. Наименьшее действие оказывают АД с преимущественной серотонинергической активностью.
Вопрос об эффективности АД и ПЭП при других ненейропатических состояниях (в том числе остеоартрите, ревматоидном артрите) требует дальнейшего изучения. Имеются данные небольших исследований с методологическими издержками, согласно которым, при использовании этих препаратов у 26–68% пациентов наблюдается половинная редукция выраженности болевого синдрома [34].
Литература
- Moskowitz M.A. Advances in understanding chronic pain: mechanisms of pain modulation and relationship to treatment // Neurology. 2002; 59: 5: Suppl 2: S1.
- Maizels M., McCarberg B. Antidepressants and antiepileptic drugs for chronic non-cancer pain // Am Fam Physician. 2005; Feb; 1: 71: 3: 483–490.
- Cruccu G. Treatment of painful neuropathy // Curr Opin Neurol. 2007; Oct; 20: 5: 531–535.
- Dworkin R.H., Backonja M., Rowbotham M.C. et al. Advances in neuropathic pain: diagnosis, mechanisms, and treatment recommendations // Arch Neurol. 2003; 60: 1524–1534.
- Ross E.L. The evolving role of antiepileptic drugs in treating neuropathic pain // Neurology. 2002; 55: 5: Suppl 1: S42.
- Bryson H.M., Wilde M.I. Amitriptyline. A review of its pharmacological properties and therapeutic use in chronic pain states // Drugs Aging. 1996; 8: 459–476.
- Backonja M.M. Use of anticonvulsants for treatment of neuropathic pain // Neurology. 2002; Sep; 10: 59: 5: Suppl 2: S14–17.
- McQuay H.J, Tramer M., Nye B.A. et al. A systematic review of antidepressants in neuropathic pain // Pain. 1996; 68: 217–227.
- Sindrup S.H., Bach F.W., Madsen C. et al. Venlafaxine versus imipramine in painful polyneuropathy: a randomized, controlled trial // Neurology. 2003; 60: 1284–1289.
- Liu J.K., Apfelbaum R.I. Treatment of trigeminal neuralgia // Neurosurg Clin N Am. 2004; Jul; 15: 3: 319–334.
- Tyring S.K. Management of herpes zoster and postherpetic neuralgia // J Am Acad Dermatol. 2007; Dec; 57: 6: Suppl: S136–142.
- Robinson-Papp J., Simpson D.M. Safety profile of treatment in diabetic peripheral neuropathic pain // Pain Med. 2007; Sep; 8: Suppl 2: S43–49.
- Sindrup S.H., Jensen T.S. Efficacy of pharmacological treatments of neuropathic pain: an update and effect related to mechanism of drug action // Pain. 1999; 83: 163–168.
- Nurmikko T.J., Eldridge P.R. Trigeminal neuralgia—pathophysiology, diagnosis and current treatment // Br J Anaesth. 2001; Jul; 87: 1: 117–132.
- Backonja M., Beydoun A., Edwards K.R. et al. Gabapentin for the symptomatic treatment of painful neuropathy in patients with diabetes mellitus: a randomized controlled trial // JAMA. 1998; 280: 1831–1836.
- Rowbotham M., Harden N., Stacey B. et al. Gabapentin for the treatment of postherpetic neuralgia: a randomized controlled trial // JAMA. 1998; 280: 1837–1842.
- Shneker B.F., McAuley J.W. Pregabalin: a new neuromodulator with broad therapeutic indications // Ann Pharmacother. 2005; Dec; 39: 12: 2029–2037.
- Rosenstock J., Tuchman M., LaMoreaux L., Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial // Pain. 2004; 110: 628–638.
- McCleane G.J. Lamotrigine in the management of neuropathic pain: a review of the literature // Clin J Pain. 2000; 16: 321–326.
- Simpson D.M., Olney R., McArthur J.C. et al. A placebo-controlled trial of lamotrigine for painful HIV-associated neuropathy // Neurology. 2000; 54: 2115–2119.
- Vestergaard K., Andersen G., Gottrup H. et al. Lamotrigine for central poststroke pain: a randomized controlled trial // Neurology. 2001; 56: 184–190.
- McCleane G. 200 mg daily of lamotrigine has no analgesic effect in neuropathic pain: a randomised, double-blind, placebo controlled trial // Pain. 1999; 83: 105–107.
- Wolfe G.I., Barohn R.J. Painful Peripheral Neuropathy // Curr Treat Options Neurol. 2002; May; 4: 3: 177–188.
- Vanotti A., Osio M., Mailland E. et al. Overview on pathophysiology and newer approaches to treatment of peripheral neuropathies // CNS Drugs. 2007; 21: Suppl 1: 3–12.
- Sindrup S.H., Jensen T.S. Pharmacologic treatment of pain in polyneuropathy // Neurology. 2000; 55: 915–920.
- Morello C.M., Leckband S.G., Stoner C.P. et al. Randomized double-blind study comparing the efficacy of gabapentin with amitriptyline on diabetic peripheral neuropathy pain // Arch Intern Med. 1999; 159: 1931–1937.
- Goldenberg D.L. Fibromyalgia syndrome a decade later: what have we learned? // Arch Intern Med. 1999; 159: 777–785.
- White K.P., Harth M. An analytical review of 24 controlled clinical trials for fibromyalgia syndrome (FMS) // Pain. 1996; 64: 211–219.
- Arnold L.M., Hess E.V., Hudson J.I. et al. A randomized, placebo-controlled, double-blind, flexible-dose study of fluoxetine in the treatment of women with fibromyalgia // Am J Med. 2002; 112: 191–197.
- Crofford L.J. Pharmaceutical treatment options for fibromyalgia // Curr Rheumatol Rep. 2004; 6: 274–280.
- Arnold L.M., Lu Y., Crofford L.J. et al. A double-blind, multicenter trial comparing duloxetine with placebo in the treatment of fibromyalgia patients with or without major depressive disorder // Arthritis Rheum. 2004; 50: 2974–2984.
- Goldenberg D.L. Pharmacological treatment of fibromyalgia and other chronic musculoskeletal pain // Best Pract Res Clin Rheumatol. 2007; Jun; 21: 3: 499–511.
- Salerno S.M., Browning R., Jackson J.L. The effect of antidepressant treatment on chronic back pain: a meta-analysis // Arch Intern Med. 2002; 162: 19–24.
- Onghena P., Van Houdenhove B. Antidepressant-induced analgesia in chronic non-malignant pain: a meta-analysis of 39 placebo-controlled studies // Pain. 1992; 49: 205–219.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
