Кардиотомный синдром что это такое

Постперикардиотомный синдром – воспалительное заболевание перикарда аутоиммунного генеза, развивающееся как осложнение хирургических вмешательств на открытом сердце. Его основные симптомы – лихорадочная реакция и боли в грудной клетке, возникающие через неделю или позже после операции. При диагностике учитываются лабораторные признаки воспалительного процесса, данные рентгенографии грудной клетки, ЭКГ, УЗИ и МРТ сердца. Для лечения патологии используются нестероидные противовоспалительные средства (НПВС) или кортикостероиды. Развитие осложнений заболевания нередко требует дополнительного кардиохирургического вмешательства.
Общие сведения
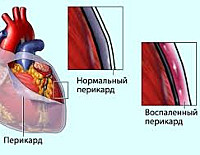
Постперикардиотомный синдром (ППТС) — патологическое состояние, возникающее после хирургического рассечения перикарда – перикардиотомии. Впервые ППТС описан в 50-х годах XX века у пациента, перенесшего открытую митральную комиссуротомию. Заболевание обычно протекает как одиночный эпизод, но впоследствии может рецидивировать. Чаще всего кардиохирурги сталкиваются с этим осложнением после вмешательств по поводу тетрады Фалло, дефектов межпредсердной или межжелудочковой перегородки, трансплантации сердца. Постперикардиотомный синдром осложняет от 2 до 30% подобных операций. Обычно он встречается у детей старше 2 лет и взрослых. Одним из вариантов патологии является постинфарктный синдром Дресслера. Несмотря на отсутствие травмы сердечной сумки, он также вызван ее аутоиммунным воспалением.
Постперикардиотомный синдром
Причины ППТС
Причина формирования постперикардиотомного синдрома – аутоиммунная реакция, возникающая после кардиохирургических операций. Она является следствием врожденных или приобретенных изменений клеточного иммунитета. После повреждения перикардиальных листков организм начинает вырабатывать антитела, взаимодействующие с тканями сердца. Это ведет к развитию аллергической реакции по типу гиперчувствительности замедленного типа и аутоиммунному воспалению.
Развитие синдрома описано после коррекции врожденных и приобретенных пороков сердца, имплантации электрокардиостимулятора, стентирования коронарных артерий, аортокоронарного шунтирования, перикардиальной пункции, радиочастотной аблации, тупой травмы грудной клетки, операций по поводу заболеваний аорты. Фактором риска ПТТС является инфицирование вирусом Коксаки В, цитомегаловирусом, аденовирусом.
Патогенез
Повреждение тканей перикарда вызывает образование антител к мембране клеток (антисарколемных), мышечным волокнам (антифибриллярных) и к клеточным ядрам. Реакция между собственными тканями и аутоантителами сопровождается привлечением к очагу патологии иммунных клеток-макрофагов, эозинофилов, нейтрофильных лейкоцитов. Начинается воспалительная реакция, сопровождающаяся выбросом медиаторов воспаления, лизосомальных ферментов, активных форм кислорода, разрушающих клетки сердечной сумки.
Еще один фактор развития ППТС – системная реакция организма на операционную травму. Она сопровождается эндотоксемией, повреждением клеток миокарда, повышением концентрации гистамина, серотонина, кининов, эйкозаноидов, цитокинов, компонентов комплемента. Это приводит к кислородному голоданию тканей, повышению сосудистой проницаемости, развитию интоксикации, что усиливает местный воспалительный процесс.
Вследствие повышения сосудистой проницаемости в очаге воспаления между двумя перикардиальными листками появляется жидкость, богатая фибрином. Этот белок образует отложения на стенках околосердечной сумки. Кроме того, подобная реакция начинается в плевральной полости. Трение листков перикарда и плевры вызывает появление важного признака, сопровождающего постперикардиотомный синдром, – боли в груди.
Симптомы постперикардиотомного синдрома
Заболевание развивается через 1–6 недель после перенесенной операции. У пациента повышается температура тела до 38-40°C. Продолжительность лихорадочного периода составляет до 3-х недель. Больных беспокоит тупая боль в левой половине грудной клетки. Она не связана с физической активностью, но может усиливаться во время глубокого дыхания, а также в положении лежа. Ухудшается аппетит, появляется слабость, раздражительность. Иногда пациентов беспокоит одышка в состоянии покоя, при незначительной нагрузке, а также ноющие суставные боли.
Когда объем выпота увеличивается, болевой синдром становится менее интенсивным. Образовавшийся экссудат сдавливает сердце, поэтому появляется учащенное сердцебиение, усиливается одышка, набухают шейные вены. Могут присоединяться отеки, постоянная тяжесть в подреберье справа, вызванная увеличением печени. Кроме того, ППТС вызывает затруднения глотания, постоянный сухой кашель, осиплость голоса, тошноту, приступы икоты. У детей признаком тяжелого течения синдрома служит рвота.
Осложнения
Постперикардиотомный синдром сопровождается накоплением выпота внутри перикардиальной полости. Если медицинская помощь оказана несвоевременно, это может привести к развитию опасного для жизни осложнения – тампонады сердца. Сдавление органа вызывает ухудшение сократительной способности миокарда и становится причиной острой сердечной недостаточности. Частота возникновения такого осложнения составляет 10%. Если объем перикардиального выпота мал, сгущение экссудата и образование наслоений фибрина могут спровоцировать появление констриктивного («сдавливающего») перикардита. Данное осложнение развивается у 5% больных ППТС и также сопровождается тяжелой сердечной недостаточностью.
Диагностика
При физикальном обследовании пациента определяется шум трения перикарда и плевры, отеки, увеличение печени. Может обнаруживаться парадоксальный пульс, который сопровождается снижением систолического АД на 10 мм рт. ст. и более, одновременным уменьшением пульсового наполнения на лучевой артерии во время вдоха. Лабораторная диагностика ППТС включает следующие исследования:
- Общий и биохимический анализ крови. Определяется увеличение количества лейкоцитов, появление незрелых форм белых клеток («сдвиг формулы влево»), нарастание СОЭ. Эти признаки характеризуют тяжесть воспалительного процесса. Иногда отмечается увеличение содержания эозинофилов – один из признаков аллергической реакции. Выявляется увеличение концентрации С-реактивного белка, фибриногена, интерлейкина-6. Эти данные свидетельствуют об остром воспалительном процессе.
- Определение антимиокардиальных антител. Исследование подтверждает аутоиммунный характер заболевания. В крови и перикардиальном выпоте определяется высокий титр антител к клеточной оболочке (сарколемме), компонентам мышечных волокон (актину, миозину, тропомиозину), клеточным ядрам. Для ПТТС характерно высокое содержание лимфоцитов, альбумина в перикардиальном экссудате, при назначении антикоагулянтов возможно появление эритроцитов. При бактериоскопии и посеве на питательную среду патогенные микроорганизмы не обнаруживаются.
Для диагностики ПТТС наиболее информативны визуализирующие методики. Они дают возможность оценить количество выпота, его локализацию, угрозу тампонады, состояние легочной ткани. Основные способы инструментальной диагностики заболевания включают:
- УЗИ сердца (ЭхоКГ). С его помощью обнаруживается жидкость в перикардиальной полости, оценивается ее количество и расположение, выявляется уменьшение амплитуды движений (гипокинез) стенок сердца, парадоксальная сократимость сердечных камер, увеличение диаметра нижней полой вены. Кроме трансторакальной, применяется чреспищеводная ЭхоКГ, дающая более точные диагностические сведения. При трудностях проведения или интерпретации данных УЗИ назначается МРТ или МСКТ сердца.
- Рентгенографию органов грудной клетки. На рентгенограммах определяется увеличение сердечной тени, пропорциональное количеству экссудата. При развитии воспаления обнаруживаются признаки пневмонита, скопление плеврального выпота.
- ЭКГ в динамике. Для ПТТС наиболее характерны преходящие подъем сегмента ST, депрессия сегмента PR, формирование отрицательных зубцов Т в нескольких отведениях, прогрессирующее снижение вольтажа (высоты) зубцов. По мере стихания воспаления ЭКГ возвращается к исходной.
Диагностические критерии патологии предложены Американской Кардиологической Ассоциацией. Постперикардиотомный синдром предполагается, если у больного имеются по крайней мере два из перечисленных признаков: лихорадка; боль, вызванная перикардитом или плевритом; шумы трения перикарда или плевры; увеличение количества жидкости в сердечной сумке; экссудативный перикардит, сопровождающийся повышением количества С-реактивного протеина в крови. Дифференциальная диагностика осуществляется с констриктивным перикардитом, застойной сердечной недостаточностью, инфекционным эндокардитом и перикардитом, миокардитом вирусной или иной этиологии.
Лечение посткардиотомного синдрома
Пациенты с ПТТС обычно наблюдаются у кардиолога амбулаторно. Показанием к госпитализации в отделение кардиологии или торакальной хирургии является нарастание объема плеврального выпота, угроза тампонады сердца. Во время лихорадочного периода и сохраняющихся электрокардиографических изменений необходим постельный режим. Специальных диетических ограничений нет, рекомендуется полноценное богатое витаминами питание. Лечение назначается с учетом выраженности и скорости развития клинических проявлений, тяжести заболевания, общего состояния пациента. Преимущественно используется медикаментозная терапия, в некоторых случаях показано хирургическое вмешательство:
- Фармакотерапия. Основу медикаментозной терапии составляют НПВС. В более тяжелых ситуациях или при рецидивирующем течении патологии показан 7-дневный курс глюкокортикоидных гормонов с их постепенной отменой. Эти препараты вызывают более быструю положительную динамику по сравнению с НПВС.
- Кардиохирургические методы. При неэффективности медикаментов, нарастании объема перикардиального выпота, увеличении риска осложнений требуется операция. Возможны следующие варианты хирургических вмешательств: перикардиоцентез, перикардиостомия, чрескожная баллонная перикардиотомия, перикардэктомия. Цель подобных операций – удаление выпота из полости перикарда и профилактика его повторного накопления.
Прогноз и профилактика
Несмотря на высокую частоту развития синдрома, в большинстве случаев прогноз благоприятный. Под влиянием лечения проявления воспалительной реакции постепенно исчезают. Развитие тяжелых осложнений наблюдается у 15% пациентов. Постперикардиотомный синдром рецидивирует у 2% прооперированных, иногда через несколько лет после вмешательства. Для профилактики ПТТС необходимо соблюдение техники кардиохирургических операций: использование прерывистого шва для закрытия перикарда, послеоперационное дренирование его полости, предотвращение попадания крови в сердечную сумку. Есть данные об эффективности у взрослых пациентов послеоперационного назначения колхицина, однако они требуют дальнейшего подтверждения.
Источник
Точная этиология синдрома постперикардиотомии не известна. Постперикардиотомический синдром постулируется как аутоиммунный ответ с участием аутоантител, которые нацелены на антигены, экспонируемые после повреждения перкардиальной ткани.
В исследовании пациентов, у которых развился синдром постперикардиотомии после трансплантации, было обнаружено увеличение доли активированных хелперных Т-клеток (CD4 + / 25 +) и цитотоксических Т-клеток (Leu-7 + / CD8 +). Это привело исследователей к выводу, что в этой популяции синдром постперикардиотомии, возможно, был вторичным по отношению к клеточному иммунитету.
Симптомы синдрома постперикардиотомии (ППС) обычно развиваются в течение 1-6 недель после операции, включающей перикардиотомию. Температура после первой послеоперационной недели обычно достигает 38-39 ° C перорально, но может достигать 40 ° C. Несмотря на высокую температуру, пациент может не выглядеть больным. Температура обычно спадает в течение 2-3 недель.
Недомогание, боль в груди, раздражительность и снижение аппетита являются типичными симптомами. Пациенты также могут сообщать о одышке и артралгии. Дети могут сообщать о боли в груди, которая усиливается при вдохе и в положении лежа на спине, но усиливается при сидении в вертикальном положении и наклоне вперед. О рвоте также сообщалось как о главном симптоме у детей с надвигающейся тампонадой сердца, вторичной по отношению к синдрому постперикардиотомии.
У больных часто наблюдается тахикардия и трение перикарда. Перикардиальное трение исчезает либо с улучшением, либо с дальнейшим накоплением перикардиальной жидкости. Системная задержка жидкости и гепатомегалия также могут возникать в условиях низкого сердечного выброса из-за нарушения желудочкового наполнения. Импульсный парадоксус также может быть очевидным и представлен снижением системного артериального давления более 10 мм рт. ст. Во время вдоха и уменьшением амплитуды пульсовой волны при пальпации лучевой артерии. Трения плевральной трения распространены. Также могут присутствовать признаки пневмонита, включая кашель, лихорадку и снижение насыщения кислородом.
Диагностика
Ожидаемые результаты подсчета полных клеток крови у пациентов с синдромом постперикардиотомии включают лейкоцитоз со сдвигом влево.
Как и у других пациентов с подозрением на воспалительные и инфекционные заболевания, забирайте посевы крови на ранних стадиях обследования. Результаты посевов крови должны быть отрицательными.
Реагенты с острой фазой, такие как скорость оседания эритроцитов (СОЭ) и уровни С-реактивного белка (СРБ), повышены.
Антитела к сердцу обычно присутствуют в высоких титрах (обычно не получаются).
Тестирование сердечного фермента обычно не помогает, потому что результаты варьируются. Кроме того, исследования не выявили различий в уровнях ферментов по сравнению с пациентами, перенесшими сердечно-легочное шунтирование, у которых нет клинических признаков синдрома постперикардиотомии.
Если установлен перикардиальный дренаж, необходимо получить жидкость для подсчета клеток, дифференцировки, цитологии, культивирования, окрашивания по Граму, уровня триглицеридов и общего уровня белка.
Лечение
Оценка пациентов с подозрением на постперикардиотомного синдрома обычно проводится в амбулаторных условиях. Обследование и лечение могут продолжаться амбулаторно, если пациент не страдает гемодинамическим заболеванием, хотя это требует тщательного наблюдения.
Медикаментозное лечение включает использование нестероидных противовоспалительных препаратов (НПВП) таких как аспирин, который назначается в течение 4-6 недель и уменьшается по мере уменьшения жидкости. Для пациентов, не чувствительных к аспирину, ибупрофену или напроксену, кортикостероиды, такие как преднизон, могут назначаться в течение 1 недели с последующим сужением в течение 4 недель. Существуют очень ограниченные данные, если таковые имеются, относительно эффективности колхицина для лечения в педиатрической популяции.
К счастью, успешное лечение рецидивирующего перикардиального выпота было описано с использованием одной высокой дозы внутривенного иммуноглобулина у одного пациента и низкой еженедельной дозы метотрексата у одного другого. Совсем недавно двое детей с рефрактерным рецидивирующим перикардитом после кардиохирургических вмешательств успешно получали 3 и 5 месячные высокие дозы (2 г / кг) внутривенного иммуноглобулина до разрешения выпота в перикарде.
Стационарное лечение пациентов с ППС показано в более тяжелых случаях, таких как пациенты с симптомами и признаками, указывающими на тампонаду. Пациенты с тампонадой должны быть госпитализированы для перикардиального дренажа.
После дренирования перикардиального выпота и улучшения клинических симптомов большинство пациентов могут лечиться амбулаторно.
Хирургическая терапия
Немедленный перикардоцентез необходим для облегчения угрожающей жизни тампонады сердца.
Хирургическое перикардиальное окно может быть необходимо у пациентов с рецидивами рецидивов после медицинской и катетерной терапии. Это может быть достигнуто с помощью открытой торакотомии или с помощью видео-ассистированной торакоскопической техники.
Чрескожная баллонная перикардиотомия может быть другой альтернативой для этих пациентов. Это менее инвазивная процедура, при которой в лаборатории катетеризации создается перикардиальное окно с использованием баллонного катетера под флюороскопическим контролем. Процедура эффективно приводит к тому, что перикардиальная жидкость стекает в брюшную полость через перфорацию диафрагмы.
Профилактика
В настоящее время не существует известной профилактической терапии для синдрома постперикардиотомии.
Рандомизированное контролируемое исследование по оценке использования колхицина для предотвращения синдрома постперикардиотомии у пациентов, перенесших сердечно-легочное шунтирование, не обнаружило статистически значимого различия от плацебо. Тем не менее, авторы отметили тенденцию к значению, которая может быть более очевидной при более широком исследовании.
Предварительные результаты исследования колхицина для профилактики синдрома постперикардиотомии и послеоперационной фибрилляции предсердий у взрослых показали, что по сравнению с плацебо периоперационное применение колхицина снижало частоту возникновения ППС, но не послеоперационной фибрилляции предсердий или послеоперационного перикардиального / плеврального выпота. Однако при применении колхицина также увеличивался риск возникновения желудочно-кишечных побочных эффектов, что сводило на нет потенциальные выгоды.
Медикаментозная терапия
Основой медикаментозной терапии является использование противовоспалительных средств. Различные лекарства доступны; все имеют одинаковую эффективность. Кортикостероиды часто используются в более тяжелых или рефрактерных случаях. Кортикостероиды привели к быстрому улучшению клинических симптомов и снижению количества антител к сердцу.
Нет данных, свидетельствующих о том, что стероиды, вводимые до и после сердечно-легочного шунтирования, снижают риск развития синдрома постперикардиотомии. Сообщалось об одном случае применения метотрексата в низких дозах при синдроме постперикардиотомии, резистентном к стандартной терапии; но, это не было далее поддержано.
Источник
Посткардиотомный синдром — это осложнение, наступающее после хирургического вмешательства на сердце со вскрытием околосердечной сумки и проявляющееся повышением температуры, сухим или выпотным перикардитом, плевритом, лейкоцитозом и ускорением РОЭ.
Патогенез посткардиотомного синдрома недостаточно ясен. Высказываются различные предположения. Посткардиотомный синдром после митральной комиссуротомии рассматривают как обострение ревматизма. Как на причину посткардиотомного синдрома указывают на асептическое воспаление, возникающее от раздражения перикарда и плевры кровью из операционной раны. Посткардиотомный синдром рассматривается также как проявление аутосенсибилизации, происходящей в результате повреждения тканей сердца при операции. Как сама операция, так и послеоперационный период могут благоприятствовать развитию повышенной чувствительности организма, так как в результате хирургического вмешательства накапливается денатурированный белок, что ведет к проявлениям аллергической реакции вследствие аутосенсибилизации организма.
Морфологической основой синдрома у большинства больных является фибринозный перикардит (см.).
Клиническая картина посткардиотомного синдрома характеризуется внезапным повышением температуры, чаще всего на второй или третьей неделе после операции. Температура может повышаться до 38—39°, но часто носит затяжной субфебрильный характер. Наиболее постоянны интенсивные боли в грудной клетке, чаще слева. Иногда отмечается лишь ощущение тяжести в области сердца. У ряда больных наблюдаются загрудинные боли с отдачей в левую половину грудной клетки, левую руку. В более редких случаях боли распространяются по всей поверхности грудной клетки. Загрудинные боли могут сопровождаться выраженной одышкой. Реже бывают кашель и кровохарканье. При обследовании устанавливают сухой, реже выпотной перикардит; может обнаруживаться плеврит, чаще левосторонний.
Пневмония относится к более редким проявлениям посткардиотомного синдрома. При выпотном перикардите или плеврите при пункции обычно получают серозно-геморрагическую жидкость, как правило, стерильную. На ЭКГ могут быть зарегистрированы изменения, типичные для поражения перикарда, а также различные нарушения ритма, воспринимаемые больными в виде сердцебиения и перебоев в области сердца.
Некоторые авторы относят к симптомам посткардиотомного синдрома явления правожелудочковой недостаточности в виде значительного увеличения печени, асцита, отеков нижних конечностей. Более вероятно, что подобного рода осложнения связаны с гемодинамическими нарушениями в послеоперационном периоде. Определяется выраженный нейтрофильный лейкоцитоз, ускоренная РОЭ, реже гипохромная анемия.
Несмотря на склонность к рецидивам, посткардиотомный синдром протекает обычно доброкачественно; продолжительность его колеблется от 1 недели до 1—2 месяцев.
Диагноз посткардиотомного синдрома может представлять известные трудности. Посткардиотомный синдром следует дифференцировать от тромбоэмболических послеоперационных осложнений, активации ревматизма.
Лечение посткардиотомного синдрома проводится антибиотиками, салицилатами, глюкокортикоидами и симптоматическими средствами.
Источник
