Эндотелиальная дисфункция у больных с метаболическим синдромом
Большинство авторов сходятся во мнении о существовании нескольких механизмов, обусловливающих наличие связи артериальной гипертензии и инсулинорезистентности.
Еще в 80-х годах прошлого века ученые пришли к выводу, что сочетание артериальной гипертензии с метаболическими факторами риска – это не механическое скопление, а закономерное проявление единой цепи целого ряда сложных биохимических нарушений на тканевом уровне. В 1985 г. Было высказано предположение, что гиперинсулинемия может служить связывающим звеном между артериальной гипертензией, ожирением и нарушением толерантности к глюкозе (НТГ). В ряде исследований по прямому определению инсулинорезистентности было показано, что больные с артериальной гипертензией в среднем утилизируют на 40% меньше глюкозы, чем лица с нормальным артериальным давлением.
В эпидемиологических исследованиях продемонстрировано также, что 64% больных с артериальной гипертензией имели инсулинорезистентности и только у половины пациентов она клинически манифестировала с нарушением углеводного обмена. С другой стороны, у 36% больных, имевших гиперлипопротеидемию (ГЛП) или избыточную массу тела (ИМТ), не было выявлено инсулинорезистентности. Таким образом, даже на фоне имеющегося в настоящее время огромного интереса к метаболическому синдрому было бы ошибочным связывать каждый случай эссенциальной артериальной гипертензии с проявлениями тканевой инсулинорезистентности.
Хроническая гиперинсулинемия как проявление тканевой инсулинорезистентности способствует задержке в организме натрия путем ускорения его реабсорбции, что приводит к увеличению объема жидкости и общего периферического сосудистого сопротивления. Повышение активности Na-K-, H- и Ca-Mg-АТФазы под непосредственным воздействием инсулина вызывает увеличение содержания внутриклеточного натрия и кальция, что способствует вазоконстрикции гладкой мускулатуры сосудов. При этом усиливается и чувствительность сосудов к прессорным агентам, таким как адреналин и ангиотензин.
Гиперинсулинемия также способствует активации симпатической нервной системы (СНС), в результате чего возрастает сердечный выброс и стимулируется вазоконстрикция периферических кровеносных сосудов. Симпатическая стимуляция почек запускает мощный механизм развития артериальной гипертензии – ренин-ангиотензин-альдостероновую систему. Исследования показывают, что при сочетании артериальной гипертензии с инсулинорезистентностью активность АПФ является достоверно более высокой по сравнению с больными артериальной гипертензией без проявлений инсулинорезистентности. Ангиотензин 11 – главный действующий компонент ренин-ангиотензин-альдостероновой системы – прямо и косвенно (опосредованно через активацию симпатической нервной системы) повышает давление в клубочковом аппарате, вызывает пролиферацию гладкомышечных стенок артерий, гипертрофию кардиомиоцитов и нарушает функцию эндотелия, что способствует системной артериальной и венозной вазоконстрикции.
Особую роль в ассоциации артериальной гипертензии и инсулинорезистентности играет ожирение абдоминального типа, характерное для метаболиского синдрома. В адипоцитах брыжейки и сальника идет синтез метаболически активных веществ, ингибирующих выработку эндогенного оксида азота, соответственно стимулируя вазоконстрикцию. В последние годы также активно обсуждается роль лептина в усилении активности симпатической нервной системы. Артериальная гипертензия развивается примерно у 60% больных ожирением.
В последнее десятилетие получило развитие учение о роли функции эндотелия в формировании и прогрессировании артериальной гипертензии. Показано, что в патогенезе артериальной гипертензии, связанном с метаболическими нарушениями, эндотелиальная функция является интегральным аспектом синдрома инсулинорезистентности и способствует ее углублению, увеличению реактивности сосудов и дальнейшему формированию артериальной гипертензии.
Источник
Что является причиной развития метаболического синдрома и инсулинорезистентности (ИР) тканей? Какова связь между ИР и прогрессированием атеросклероза? На эти вопросы пока не получено однозначного ответа. Предполагают, что первичным дефектом, лежащим в основе развития ИР, является дисфункция эндотелиальных клеток сосудов.
Эндотелий сосудов представляет собой гормонально активную ткань, которую условно называют самой большой “эндокринной железой” человека. Если выделить из организма все клетки эндотелия, их вес составит приблизительно 2 кг, а общая протяженность – около 7 км. Уникальное положение клеток эндотелия на границе между циркулирующей кровью и тканями делает их наиболее уязвимыми для различных патогенных факторов, находящихся в системном и тканевом кровотоке. Именно эти клетки первыми встречаются с реактивными свободными радикалами, с окисленными липопротеинами низкой плотности, с гиперхолестеринемией, с высоким гидростатическим давлением внутри выстилаемых ими сосудов (при артериальной гипертонии), с гипергликемией (при сахарном диабете). Все эти факторы приводят к повреждению эндотелия сосудов, к дисфункции эндотелия, как эндокринного органа и к ускоренному развитию ангиопатий и атеросклероза. Перечень функций эндотелия и их нарушений перечислены в таблице 1.
Функциональная перестройка эндотелия при воздействии патологических факторов проходит несколько стадий:
I стадия – повышенная синтетическая активность клеток эндотелия, эндотелий работает как “биосинтетическая машина”.
II стадия – нарушение сбалансированной секреции факторов, регулирующих тонус сосудов, систему гемостаза, процессы межклеточного взаимодействия. На этой стадии нарушается естественная барьерная функция эндотелия, повышается его проницаемость для различных компонентов плазмы.
III стадия – истощение эндотелия, сопровождающееся гибелью клеток и замедленными процессами регенерации эндотелия.
Из всех факторов, синтезируемых эндотелием, роль “модератора” основных функций эндотелия принадлежит эндотелиальному фактору релаксации или оксиду азота (NO). Именно это соединение регулирует активность и последовательность “запуска” всех остальных биологически-активных веществ, продуцируемых эндотелием. Оксид азота не только вызывает расширение сосудов, но и блокирует пролиферацию гладкомышечных клеток, препятствует адгезии клеток крови и обладает антиагрегантными свойствами. Таким образом, оксид азота является базовым фактором антиатерогенеза.
К сожалению, именно NO-продуцирующая функция эндотелия оказывается наиболее ранимой. Причина тому – высокая нестабильность молекулы NO, являющейся по природе своей свободным радикалом. В результате благоприятное антиатерогенное действие NO нивелируется и уступает место токсическому атерогенному действию других факторов поврежденного эндотелия.
В настоящее время существуют две точки зрения на причину эндотелиопатии при метаболическом синдроме. Сторонники первой гипотезы утверждают, что дисфункция эндотелия вторична по отношению к имеющейся ИР, т.е. является следствием тех факторов, которые характеризуют состояние ИР – гипергликемии, артериальной гипертонии, дислипидемии. При гипергликемии в эндотелиальных клетках активируется фермент протеинкиназа-С, который увеличивает проницаемость сосудистых клеток для белков и нарушает эндотелий-зависимую релаксацию сосудов. Кроме того, гипергликемия активирует процессы перекисного окисления, продукты которого угнетают сосудорасширяющую функцию эндотелия. При артериальной гипертонии повышенное механическое давление на стенки сосудов приводит к нарушению архитектоники эндотелиальных клеток, повышению их проницаемости для альбумина, усилению секреции сосудосуживающего эндотелина-1, ремоделированию стенок сосудов. Дислипидемия повышает экспрессию адгезивных молекул на поверхности эндотелиальных клеток, что дает начало формированию атеромы. Таким образом, все перечисленные состояния, повышая проницаемость эндотелия, экспрессию адгезивных молекул, снижая эндотелий-зависимую релаксацию сосудов, способствуют прогрессированию атерогенеза.
Сторонники другой гипотезы считают, что дисфункция эндотелия является не следствием, а причиной развития ИР и связанных с ней состояний (гипергликемии, гипертонии, дислипидемии). Действительно, для того чтобы соединиться со своими рецепторами, инсулин должен пересечь эндотелий и попасть в межклеточное пространство. В случае первичного дефекта эндотелиальных клеток трансэндотелиальный транспорт инсулина нарушается. Следовательно, может развиться состояние ИР. В таком случае ИР будет вторичной по отношению к эндотелиопатии (рис. 1).
Рис. 1. Возможная роль дисфункции эндотелия в развитии синдрома инсулинорезистентности
Для того, чтобы доказать эту точку зрения, необходимо исследовать состояние эндотелия до появления симптомов ИР, т.е. у лиц с высоким риском развития метаболического синдрома. Предположительно, к группе высокого риска формирования синдрома ИР относятся дети, родившиеся с низким весом (менее 2,5 кг). Именно у таких детей впоследствии в зрелом возрасте появляются все признаки метаболического синдрома. Связывают это с недостаточной внутриутробной капилляризацией развивающихся тканей и органов, включая поджелудочную железу, почки, скелетную мускулатуру. При обследовании детей в возрасте 9–11 лет , родившихся с низким весом, было обнаружено достоверное снижение эндотелий-зависимой релаксации сосудов и низкий уровень антиатерогенной фракции липопротеидов высокой плотности, несмотря на отсутствие у них других признаков ИР. Это исследование позволяет предположить, что, действительно, эндотелиопатия первична по отношению к ИР.
До настоящего времени не получено достаточных данных в пользу первичной или вторичной роли эндотелиопатии в генезе ИР. В то же время неоспоримым является факт, что эндотелиальная дисфункция является первым звеном в развитии атеросклероза, связанного с синдромом ИР. Поэтому поиск терапевтических возможностей восстановления нарушенной функции эндотелия остается наиболее перспективным в предупреждении и лечении атеросклероза. Все состояния, входящие в понятие метаболического синдрома (гипергликемия, артериальная гипертония, гиперхолестеринемия) усугубляют дисфункцию эндотелиальных клеток. Поэтому устранение (или коррекция) этих факторов безусловно будет способствовать улучшению функции эндотелия. Перспективными препаратами, позволяющими улучшить функцию эндотелия, остаются антиоксиданты, устраняющие повреждающее воздействие окислительного стресса на клетки сосудов, а также лекарства, повышающие продукцию эндогенного оксида азота (NO), например, L-аргинин.
В таблице 2 перечислены препараты, у которых доказано антиатерогенное действие посредством улучшения функции эндотелия. К ним относятся: статины (симвастатин), ингибиторы ангиотензинпревращающего фермента (в частности, эналаприл), антиоксиданты, L-аргинин, эстрогены.
Экспериментальные и клинические исследования по выявлению первичного звена в развитии ИР продолжаются. Одновременно идет поиск препаратов, способных нормализовать и сбалансировать функции эндотелия при различных проявлениях синдрома инсулинорезистентности. В настоящее время стало совершенно очевидно, что тот или иной препарат только в том случае сможет оказать антиатерогенное воздействие и предупредить развитие сердечно-сосудистых заболеваний, если он прямо или опосредованно восстанавливает нормальную функцию эндотелиальных клеток.
Симвастатин –
Зокор (торговое название)
(Merck Sharp & Dohme Idea)
Эналаприл –
Веро-эналаприл (торговое название)
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Исламгалеева З.М.
1
Хусаинова Л.Н.
1
Мингазетдинова Л.Н.
1
Муталова Э.Г.
1
1 ГБОУ ВПО «Башкирский Государственный медицинский университет»
Цель – изучить показатели молекул межклеточной адгезии и фактора эндотелиального роста VEGF, их взаимосвязь с эндотелиальной дисфункцией у женщин артериальной гипертонией и метаболическим синдромом. Материал и методы. В исследование включено 126 женщин артериальной гипертонией (АГ), из них у 22 была эссенциальная гипертония 1–3 степени без ожирения, у 104 на фоне АГ имелся метаболический синдром (МС). Женщины с МС были выделены в 2 группы: период менопаузы (2 группа) и репродуктивный (3 группа). Наличие эндотелиальной дисфункции оценивали по изучению моноцитарно-макрофагальных цитокинов (G-CSF и VEGF), по экспрессии молекул межклеточной адгезии (VCAM-1, ICAM-2, sP-селектин) и фактору фон Виллебранда. Результаты и обсуждение. У пациентов АГ отмечено развитие эндотелиальной дисфункции, что определяется нарастанием локального воспаления по показателю VCAM-1, G-CSF повышением прокоагуляционных компонентов (фактор фон Виллебранда, sP-селектин) и VEGF как фактора ангиогенеза. Также отмечено значимое увеличение полиморфного маркера S290N гена SELP (sP-селектин) и тенденция к нарастанию экспрессии маркера – 2578 (18) I/D гена VEGF. Выявлено повышение всех показателей с наличием метаболического синдрома у женщин, а при менопаузе высоко значимым оказался уровень VEGF, VCAM-1 и sP-селектин, что позволяет определить МС и менопаузу как дополнительные маркеры эндотелиальной дисфункции.
эндотелиальная дисфункция
менопауза
метаболический синдром
артериальная гипертония
1. Алмазов В. А. Эндотелиальная дисфункция у больных с дебютом ишемической болезни сердца в разном возрасте / В. А. Алмазов, О. А. Беркович, М. Ю. Симникова и др. // Кардиология. – 2001. – № 5. – С. 24-29.
2. Бутрова С. А. Метаболический синдром: патогенез, клиника, диагностика, подходы лечения // Русский медицинский журнал. – 2003. – № 27. – С. 1494-1503.
3. Ковалев И. А. Дисфункция эндотелия у лиц с отягощенной по атеросклерозу сердечной недостаточностью // Кардиология. – 2004. – № 1. – С. 39-42.
4. Оганов Р. Г. Абдоминальное ожирение у больных артериальной гипертонией, атерогенные нарушения в системах транспорта липидов и обмена углеводов / Р. Г. Оганов, Н. В. Перова, М. Н. Мамедов и др. // Русский медицинский журнал. – 2001. – № 5(1). – С. 111-115.
5. Оганов Р. Г. Экономический ущерб от сердечно-сосудистых заболеваний в Российской Федерации / Р. Г. Оганов, А. В. Концевая, А. М. Калинина // Кардиоваскулярная терапия и профилактика. – 2011. – № 10 (4). – С. 4-9.
6. Шальнова С. А. Тендеции смертности в России в начале XXI века / С. А. Шальнова, А. Д. Деев // Кардиоваскулярная терапия и профилактика. – 2011. – № 10 (6). – С. 5-10.
7. Action plan for the global strategy for prevention and control of noncommunicable disease. WHO. 2009.
Артериальная гипертония занимает первое место по вкладу в смертность от болезней системы кровообращения, является ведущим фактором риска развития ишемической болезни сердца, где метаболические нарушения ускоряют прогрессирование заболевания, а наличие метаболического синдрома, длительный прием гормональных препаратов, возросшая частота курения, наследственная отягощенность определяют у женской популяции возможность повышения фатальных и нефатальных осложнений [6]. Распространенность АГ по-прежнему составляет 39 % у мужчин и 41 % у женщин [5]. При рассмотрении АГ важным показателем является позиция суммарного сердечно-сосудистого риска, где очень высокий риск у женщин встречается чаще (27,9 %), чем у мужчин – 22,3 % [6,7]. Нарастание высокого риска с возрастом у женщин происходит быстрее, а после 45 лет чаще переходит в категорию очень высокого риска (47,3 и 43,6 % соответственно). Это можно, вероятно, объяснить наступлением менопаузы, чаще развитием избыточной массы тела и ожирения, сахарный диабет у женщин.
Артериальная гипертония также является одной из составляющих метаболического синдрома (МС) наряду с ожирением, инсулинорезистентностью, гиперинсклинемией, дислипидемией. Инсулинорезистентность приводит к снижению реакции эндотелия на вазодилатацию, уменьшению протромбических свойств, увеличению адгезивных свойств по отношению лейкоцитов и тромбоцитов [1,2,3,4].
В настоящее время достаточно изучены показатели, определяющие нарушения вазодилатации сосудистой стенки, однако мало работ по определению участия молекул внеклеточного матрикса и ангиогенеза у женщин с АГ и метаболическим синдромом.
Цель исследования: изучить показатели молекул межклеточной адгезии и фактора эндотелиального роста (VEGF), их взаимосвязь с эндотелиальной дисфункцией у женщин артериальной гипертонией и метаболическим синдромом.
Материал и методы. В исследование включено 126 женщин с АГ (средний возраст – 49,2 ± 8,16 лет). После оформления согласия на медицинское вмешательство и в соответствии с критериями исключения были сформированы профильные группы, сопоставимые по возрасту: 1 группа – пациенты с эссенцильной гипертонией (ЭГ) 1–3 степени (n = 22 чел.) без ожирения (ИМТ в среднем 24,9 ± 1,16 кг/м²), 2 группа – женщины с АГ и метаболическим синдромом (ИМТ ≥ 30 кг/м²) в состоянии менопаузы (n = 74 чел.), 3 группа (n = 30 чел.) – пациенты с АГ и МС репродуктивного возраста. Группу сравнения составили 112 условно здоровых донора (средний возраст 44,1 ± 2,3 лет), 20 человек при клиническом обследовании. По встречаемости компонентов МС у 55 (43,8 %) пациентов выявлен 3-х компонентный МС (АГ, ожирение, гипергликемия), у 58 (45,9 %) – 4 компонентный (АГ, ожирение, гипергликемия, гипертриглицеридемия) и у 13 (10,3 %) лиц – 5 компонентный МС. Диагноз АГ верифицирован с учетом рекомендации ВОЗ (1999), МС диагностировался с помощью критериев NCEP — АГ/III (2001) и включал: абдоминальное ожирение (объем талии ≥ 94 см, ИМТ ≥ 30 кг/м²), глюкоза крови натощак ≥ 6,1 ммоль/мл, триглицериды (ТГ) ≥ 1,7 ммоль/мл, артериальное давление ≥ 140–90 мм рт. ст. (по ВОЗ). Средняя длительность АГ у обследованных составила 9,1 года, семейный анамнез по АГ отмечали по группам 61,3 %; 57,8 % и 62,1 % соответственно.
Всем обследованным проводили суточное мониторирование артериального давления (СМАД), исследование углеводного обмена с определением концентрации глюкозы глюкозооксидазным методом с помощью стандартных наборов «BIOLA-TEST» LACHENA, концентрацию иммунореактивного инсулина в сыворотке крови с помощью стандартного набора «INSULIN RIA DSL 1600». Инсулинорезистентность оценивалась по методу HONO IR. Метаболический синдром выставлялся на основании критериев ATP III. Исследование липидного обмена проводилось путем определения общего холестерина, холестерина липопротеидов высокой и низкой плотности, триглицеридов на автоанализаторе «FP-901». Исследование межклеточной адгезии молекул (sVCAM-1, sICAM-2, sP-селектин) проводилось иммуноферментным методом на анализаторе «AMER CARD» с использованием коммерческих наборов, фактор фон Виллебранда (ФВ) определялся на способности бестромбоцитарной плазмы обследуемого в смеси с раствором ристомицина вызывать агглютинацию отмытых и фиксированных формалином тромбоцитов. Экспрессия цитокиновой системы исследовалась в сыворотках крови методом ИФА, используя тест-систему ООО «протеиновый контур», где изучались гранулоцитарный колониестимулирующий фактор (G-CSF), который коррелирует выраженность воспалительного процесса эндотелия, а также фактор роста эндотелия сосудов (VEGF), как ведущего фактора ангиогенеза, который блокирует апоптоз эндотелиальных клеток сосудов, усиливает их проницаемость и вазодилатацию.
Материалом молекулярно-генетического анализа служили образцы ДНК, выделенные из лимфоцитов периферической венозной крови, проводилось определение полиморфных маркеров генов предрасположенности к эндотелиальной дисфункции – sP-селектина и фактора роста эндотелия VEGF. Математическую обработку результатов исследования проводили с использованием пакетов статистических программ: STATISTIKA v. 7.0, Microsoft Access BIOSTAT с помощью биометрических методов анализа.
Результаты исследования и обсуждение. Артериальное давление варьировало от 150 до 240 мм рт. ст. для систолического (САД) и от 95 до 135 мм рт. ст. для диастолического давления (ДАД). Уровни концентрации глюкозы были самыми высокими во 2 группе (6,18, 5,24 и 6,60 ммоль/мл), превышая группу сравнения на 28,3 % и на 12,7 % 3 группу женщин.
Исследование хемокинов у женщин с АГ выявило значимое повышение содержания G-CSF во всех группах: до 11,98 (10,16; 13,08) пг/мл в 1 группе, до 12,3 (10,61; 13,99) пг/мл во 2 и до 13,4 (11,78; 15,08) пг/мл в 3 группе, т. е. наибольшие показатели содержания фермента наблюдались в группе больных АГ с метаболическим синдромом (p ˂ 0,01). Фактор роста эндотелия сосудов VEGF является ведущим показателем нарушения функции эндотелия. Получен большой разброс VEGF у больных АГ (46,25 – 160,58 пг/мл) и достигает значимых величин у всех больных по отношению группы сравнения. У пациентов 1 группы с ЭГ он составил 118,16 (105,74; 136,58) пг/мл (р = 0,016), превышая группу сравнения в 2 раза. В группе больных АГ с МС он увеличивался в 2,6 раза у 2 группы — 132,5 (118,22; 156,78) пг/мл (р = 0,002) и был близок в 3 группе — 120,5 (60,82; 144,48) пг/мл. (Рис. 1).
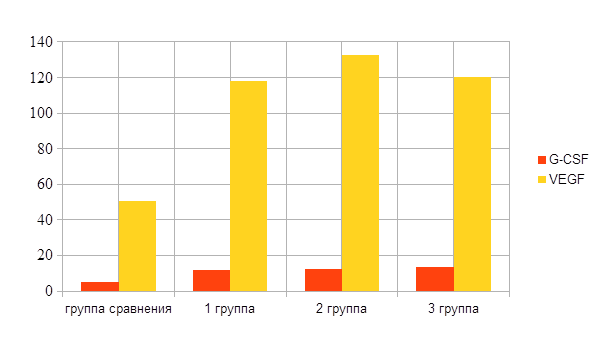
Рис. 1. Продукция G-CSF и VEGF у больных артериальной гипертонией с метаболическим синдромом
Примечание: достоверность различий с группой сравнения: * – р<0,05; ** – р<0,01.
В целом, отмечено увеличение продукции хемокинов у всех больных с АГ. Если показатели G-CSF увеличивались одинаково во всех группах пациентов с АГ и незначительным превышением в 3 группе, то фактор эндотелиальной дисфункции VEGF был наибольшим у женщин в менопаузе (2 группа) и одинаков в 1 и 3 группах, превышая группу сравнения в 2 раза. Следовательно, метаболический синдром у женщин становится предиктором в развитии эндотелиальной дисфункции у больных АГ, где повышение продукции цитокинов G-CSF и VEGF свидетельствует об их значимости в патогенезе АГ.
В процессе повреждения эндотелия увеличиваются адгезивные свойства крови по отношению к форменным элементам. Молекулы агдезии, обеспечивая регуляцию иммунных процессов, отражают активацию или повреждения эндотелия.
Определение экспрессии растворимых молекул адгезии выявило разнонаправленное их действие (табл.1).
Таблица 1
Показатели молекул межклеточной адгезии у женщин артериальной гипертонией с метаболическим синдромом
Показатели | Сравнение n = 20 | Артеральная гипертония | ||
1 группа n = 22 | Метаболический синдром | |||
2 группа n = 74 | 3 группа n = 30 | |||
VCAM — 1, пг/мл | [781,32] 716,20; 846,44 | [839,56] 783,73; 859,30 | [925,72]* 872,70; 987,74 | [831,57] 755,74; 886,80 |
ICAM — 2, пг/мл | [680,45] 515,36; 797,15 | [372,44] 345,77; 398,12 | [355,98]* 321,16; 390,80 | [411,97]* 361,20; 461,87 |
sP- селектин, пг/мл | [178,22] 141,34; 209,56 | [183,54] 163,56; 202,50 | [411,59]** 396,67; 426,51 | [292,78]* 279,54; 307,02 |
Примечание: достоверность различий с группой сравнения * – р < 0,05; ** – р < 0,01.
У всех пациентов наблюдалось повышение экспрессии VCAM -1, наиболее высокие показатели получены у больных 2 группы, они превышали на 25,7 % данные группы сравнения и на 11,3 % больных 3 группы женщин без менопаузы. Но значимыми оказались результаты экспрессии VCAM-1 только в период менопаузы у женщин АГ с МС. Полученные данные указывают на возможность обеспечения адгезии лейкоцитов через взаимодействие с лейкоцитарным воспалением и становятся показателем локального воспаления сосудистой стенки.
При изучении молекулы адгезии ICAM-2 у больных АГ отмечено снижение по сравнению с контролем во всех группах, что, возможно, определяется слабой связью данного иммуноглобулина с функционирующим эндотелием.
Содержание sP-селектина имело отчетливую тенденцию к повышению. Если в 1 группе пациентов с ЭГ sP-селектин был близок к показателям группы сравнения, то с развитием метаболического синдрома он возрастал на 64,3 % (р=0,01) в 3 группе по отношению группы сравнения и на 131 % во 2 группе женщин с наличием менопаузы, отражая высокий тромбогенный риск. Метаболический синдром при АГ становится предиктором развития гиперкоагуляционного синдрома на фоне эндотелиальной дисфункции особенно у женщин с ожирением в менопаузе.
Также повышался уровень протромбогенного фактора фон Виллебранда с наличием АГ и метаболического синдрома (рис. 2).
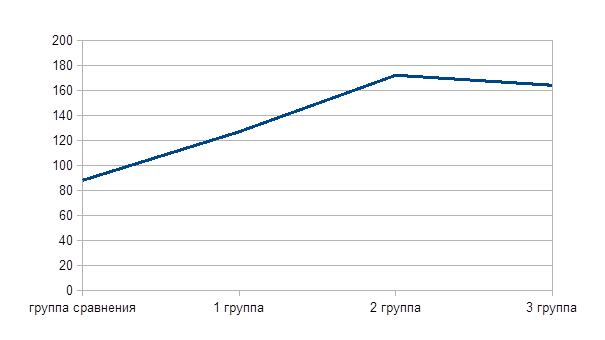
Рис. 2. Уровень фактора фон Виллебранда у больных артериальной гипертонией с метаболическим синдромом
Примечание: достоверность различий * – р < 0,05; ** – р < 0,01.
Показатели ФВ у обследованных больных с АГ значимо превышали значения группы сравнения. У пациентов 1 группы он превышал на 44,8 % – составил 126,82 % (98,4; 142,3 %), у больных с МС содержание ФВ высоко значимо увеличивалось на 97,7 % (172,18 %; 158,3 % и 198,6 %) во 2 группе и на 87,3 % (164,08 %; 146,2 и 184,1 %) в 3 группе. Более высокие показатели ФВ у больных с метаболическим синдромом позволяют отнести МС при АГ к маркерам эндотелиальной дисфункции.
Таким образом, у женщин АГ с метаболическим синдромом наблюдаются нарушения функции эндотелия, которые прогрессируют в связи с метаболическими нарушениями и повышаются при менопаузе, ускоряют дисфункцию эндотелия сосудов и проявляются высоко значимым нарастанием локального иммунного воспаления (VCAM – 1), гиперкоагуляционного синдрома (sP-селектин, ФВ), что определяет и ускоряет состояние ангиогенеза (VEGF).
Эндотелиальная дисфункция, вызванная различными повреждениями, ведет к развитию компенсаторных реакций, которые нарушают гомеостатические свойства эндотелия, увеличивают его адгезивные свойства по отношению к лейкоцитам и тромбоцитам, повышают проницаемость, усиливают прокоагулянтные свойства и ангиогенез.
Нами проведен анализ ассоциаций полиморфных локусов молекул адгезии sP-селектин и сосудистого эндотелиального фактора роста VEGF. Установлено, что у женщин АГ статистически значимо увеличена частота генотипа SELP S290N* S/*N (sP-селектин) по сравнению с группой контроля (36,86 % и 27,27 % соответственно, p = 0,011) и аллеля SELP*N (29,58 % и 19,29 %, p = 0,001).
Анализ распределений частот генотипов и аллелей полиморфизма – 2549 (18) I/D гена VEGF показал, что в группе пациентов с наличием АГ статистически достоверно снижена частота генотипа VEGF *D/D по отношению группы сравнения (19,78 % и 28,52 % соответственно) при незначимом повышении генотипа *I/I до 18,92 ± 2,23 % (в контроле 16,05 ± 2,16 %, p = 0,125).
Следовательно, анализ ассоциаций полиморфного маркера S290N гена SELP у больных АГ выявил значимое повышение генотипа *S/N и аллеля *N в сочетаниях, маркирующих повышенный риск развития эндотелиальной дисфункции у женщин.
Анализ сочетаний генотипов и аллелей в распределении частот полиморфного маркера – 2549 (18) I/D гена VEGF выявил снижение (D) нуклеотидной вставки у больных АГ. В выборках популяции чаще встречается генотип *I/I и аллель *I (49,2 % и 43,18 % соответственно с группой сравнения, p = 0,052).
Повышенная экспрессия SELP у больных АГ может быть использована в качестве предиктора неблагоприятного течения артериальной гипертонии у женщин с метаболическим синдромом путем нарушения функции эндотелия.
Ассоциация полиморфного маркера – 2578 (18) I/D гена VEGF у больных АГ ассоциирован с риском сердечно-сосудистых осложнений, а его повышение, вероятно, определяет готовность к ангиогенезу на фоне эндотелиальной дисфункции. Отмечена корреляция средней силы полиморфного генотипа *I/I с ФВ (r = 0,45; p = 0,029).
Таким образом, полученные нами данные по изучению показателей эндотелиальной дисфункции выявили достоверные различия в повышении содержания моноцитарно-макрофагального фактора воспаления G-CSF, фактора роста эндотелия VEGF и молекулы межклеточной адгезии VCAM-1 и sP-селектин у больных АГ с метаболическим синдромом, что определяет развитие у них эндотелиальной дисфункции с гиперкоагуляцией. Наличие менопаузы у женщин с АГ становится дополнительным маркером повреждения эндотелия.
Выводы
Эндотелиальная дисфункция была отмечена во всех группах женщин с артериальной гипертонией, однако с развитием метаболического синдрома нарастало локальное воспаление по уровню G-CSF и VCAM-1, а значимое повышение sP-селектина, ФВ определяло выраженность гиперкоагуляционного синдрома при нарушениях метаболизма.
У больных с АГ и МС в менопаузе имеются максимальные значения VEGF, меньше у пациентов 1 группы без выраженных различий между группами. Отмечено повышение полиморфного маркера – 2578 (18) I/D гена VEGF генотипа *I/I у больных АГ по сравнению с контролем. Вероятно, данная мутация формирует потенциальный фактор неблагоприятного развития эндотелиальной дисфункции с наличием ангиогенеза.
Рецензенты:
Загидуллин И.М., д.м.н., профессор, зав. каф. терапии и общей врачебной практики с курсом гериатрии ИПО БГМУ, г. Уфа;
Мирсаева Г.Х., д.м.н., профессор, зав. каф. факультетской терапии БГМУ, г. Уфа.
Библиографическая ссылка
Исламгалеева З.М., Хусаинова Л.Н., Мингазетдинова Л.Н., Муталова Э.Г. ОЦЕНКА ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ И АНГИОГЕНЕЗА У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ // Современные проблемы науки и образования. – 2015. – № 5.;
URL: https://science-education.ru/ru/article/view?id=21922 (дата обращения: 16.05.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
