Эффекты глюкокортикоидов при общем адаптационном синдроме
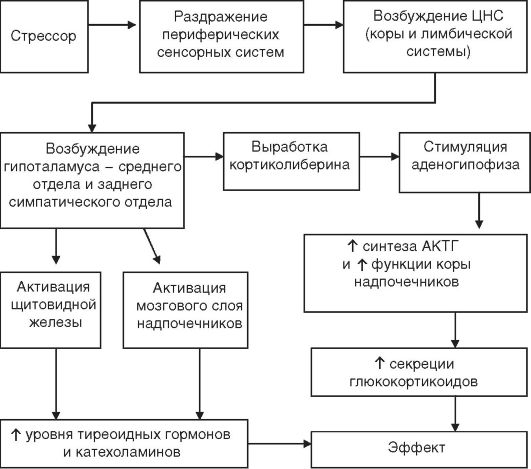
Уже в начальной стадии тревоги в паравентрикулярном ядре среднего отдела гипоталамуса увеличивается выработка кортиколиберина и гипоталамических нейропептидов (предшественников вазопрессина и окситоцина), обладающих следующими эффектами:
• кортиколиберинактивирует центр страха и тревоги, вызывает анорексию и усиливает двигательную активность, стимулирует симпатоадреналовую систему, повышает артериальное давление и увеличивает синтез АКТГ, может стимулировать лимфоцитарную продукцию эндорфинов;
• АКТГстимулирует кору надпочечников и обладает вненадпочечниковыми эффектами: повышает синтез соматотропного
 Рис. 4-2.Патогенез общего адаптационного синдрома. АКТГ — адренокортикотропный гормон
Рис. 4-2.Патогенез общего адаптационного синдрома. АКТГ — адренокортикотропный гормон
гормона (СТГ), активирует липолиз, увеличивает транспорт аминокислот в мышцы, снижает распад глюкокортикоидов в печени, в результате чего удлиняется время их циркуляции в крови. В ЦНС АКТГ влияет на поведенческие реакции: усиливает тревогу и страх, подавляет половое влечение, повышает кратковременную память. Таким образом, кортиколиберин и АКТГ стимулируют центры
страха и тревоги в лимбической системе, что создает характерный
эмоциональный фон в начальной стадии стресса.
• Вазопрессин(в чрезвычайных ситуациях продукция этого гормона увеличивается в 200-1000 раз) задерживает воду и сохраняет объем циркулирующей крови, что важно при кро-
• вотечениях; вызывает констрикцию сосудов кожи и мышц, а в больших дозах — коронарных сосудов (в связи с чем он является фактором риска сердечно-сосудистой патологии при стрессе), усиливает распад гликогена, активирует липогенез в адипоцитах, способствуя поглощению «излишней» глюкозы и избытка жирных кислот. Последнее в какой-то мере предохраняет организм при стрессе от диабетогенного действия других стрессорных гормонов. Поведенческие эффекты действия этого гормона состоят в том, что он стимулирует память, снижает ответ ЦНС на боль. Окситоцинстимулирует иммунный ответ, обладает инсулиноподобным действием на жировую ткань (аналогично антидиуретическому гормону — АДГ). Гормоны щитовидной железыувеличивают основной обмен и способствуют развитию гипергликемии, повышают катаболизм белка, усиливают липолиз, что способствует кетоацидозу; увеличивают диурез, повышают возбудимость ЦНС и симпатической нервной системы, в результате чего могут отмечаться тахикардия и гипертония. Продукты распада тиреоидных гормонов обладают свойствами катехоламинов.
Однако основную роль в разитии стресса играют надпочечники и вырабатываемые в них гормоны.
Механизм адаптогенного действияглюкокортикоидов и катехоламинов во многом зависит от их влияния на метаболизм, сердечнососудистую, дыхательную и другие системы организма.
Метаболический эффектэтих гормонов проявляется в изменении углеводного, белкового, липидного и других обменов. Его смысл заключается в мобилизации и «перекачке» энергетических ресурсов индивида в активно работающие органы: сердце, мозг, отчасти в печень, почки.
Изменения углеводного обмена.Глюкокортикоиды и катехоламины — антагонисты инсулина, они уменьшают его секрецию и эффект, в связи с этим, несмотря на гипергликемию, снижается захват глюкозы инсулинозависимыми тканями и органами (скелетные мышцы, органы желудочно-кишечного тракта, жировая ткань).
Одновременно повышается доступность глюкозы для сердца, мозга, почек, эритроцитов — их клетки имеют как инсулинозависимые, так и инсулинонезависимые системы захвата и метаболизма глюкозы. Глюкокортикоиды стимулируют процессы глюконеогенеза (синтез глюкозы из аминокислот, жирных кислот, глицерина
и др.), что помогает накоплению глюкозы в печени и почках. При этом недостаток глюкозы в инсулинозависимых тканях компенсируется повышением гликогенолиза.
Изменения белкового обмена.Глюкокортикоиды увеличивают синтез белка в сердечной мышце, печени, в органах ЦНС, но одновременно снижают синтез белка и повышают его распад в коже, костях, скелетных мышцах, в лимфоидной и жировой ткани.
Изменения жирового обмена.Под влиянием глюкокортикоидов активируется липолиз, освобождая из подкожной жировой клетчатки, легких и костного мозга неэтерифицированные жирные кислоты, используемые сердечной и скелетными мышцами, а также почками как энергетические субстраты. Образующиеся при катаболизме белков и липидов аминокислоты и жирные кислоты служат источником для глюконеогенеза в печени и почках.
В экспериментах доказано, что в печени при стрессе стимулируется гликолиз, требующий большого количества глюкозы, повышается использование глюкозы в пентозофосфатном пути, что увеличивает образование НАДФН, необходимого для работы антиоксидантной системы печени в условиях активации свободнорадикального окисления при стрессе.
Изменения со стороны сердечно-сосудистой системы.Повышается сосудистый тонус (вазоконстрикторный эффект), увеличивается частота пульса, становится больше сердечный выброс, увеличиваются объем циркулирующей крови, артериальное давление и скорость кровотока (например, повышаются кровенаполнение сосудов мозга и линейная скорость кровотока в них), что активизирует транспорт О2 и субстратов к тканям.
Кроме того, выброс катехоламинов стимулирует секрецию почками ренина, участвующего в механизме развития артериальной гипертензии при стрессе.
Изменения в дыхательной системе.Адреналин расширяет бронхи и улучшает их проходимость; норадреналин вызывает констрикцию сосудов слизистой дыхательных путей и уменьшает секрецию слизи. Глюкокортикоиды оказывают пермиссивный эффект на бронхолитическое действие катехоламинов. Результатом их совместного действия являются гипервентиляция и повышение образования сурфактанта, облегчающего расправление альвеол и повышающего эффективность внешнего дыхания.
Изменения в системе крови и иммунной системе.При избытке глюкокортикоидов активируются эритропоэз и тромбоцитопоэз,
увеличивается число нейтрофилов, моно- и лимфоцитопоэз при этом угнетаются. В крови развивается лимфопения, а также эозинопения, что приводит к угнетению клеточного и гуморального иммунитета; подавляется фагоцитоз, снижается синтез реагиновых антител, уменьшается продукция цитокинов (IFN, TNF, фактора, ингибирующего миграцию макрофагов).
Противовоспалительное действиеглюкокортикоидов связано с тем, что они стабилизируют мембраны клеток и клеточных органелл, снижают проницаемость сосудистых стенок, тормозят выход из клеток медиаторов воспаления, стимулируют антиоксидантные системы, инактивируют ферменты арахидонового каскада (снижая образование простагландинов и лейкотриенов), ингибируют экспрессию молекул межклеточной адгезии, что угнетает эмиграцию лейкоцитов из сосудов в очаг воспаления. Под действием глюкокортикоидов снижается активность NO-синтазы и таким образом уменьшаются зависящие от оксида азота релаксация и проницаемость сосудистой стенки, а также альтерация тканей.
Являясь антипиретиками, глюкокортикоиды препятствуют развитию лихорадки.
Важным компонентом противовоспалительного действия указанных гормонов является их способность индуцировать в активированных лимфоцитах и эозинофилах эндонуклеазы, вызывая апоптоз этих клеток. В результате из организма удаляются активированные антигенами лимфоциты, что подавляет деструктивный компонент иммунного ответа. В экспериментах при ингибировании данного эффекта крысы умирали от разлитого воспаления, индуцированного цитокинами лимфоцитов.
Клиническое применение адаптивных гормонов — природных глюкокортикоидов (кортизол, кортизон) и их синтетических производных (преднизолон, дексаметазон) — произвело революцию в трансплантации органов и тканей, шоковых состояний, в хирургической практике, аллергологии и иммунологии, лечении ревматоидного артрита. Однако их применение уменьшает не только альтерацию и отек при воспалении, но и пролиферацию и коллагенообразование, при избытке этих гормонов ухудшается заживление ран и эрозий. Длительное воздействие глюкокортикоидов может вызвать вторичный иммунодефицит.Отрицательные последствия их избыточной продукции становятся особенно значимыми в условиях хронического стресса,что приводит к развитию болезней адаптации.
4.1.6. Механизмы стрессорных повреждений и развитие «стресс-болезней»
Один из таких механизмов можно представить следующим образом. Известно, что глюкокортикоиды необходимы для развертывания иммунологических механизмов защиты организма (образование антител, фагоцитоз и др.). Однако если при общем адаптационном синдроме секреция глюкокортикоидов окажется чрезмерной, они будут угнетать эти же механизмы, подавят развитие неспецифических защитных реакций (воспаление), и тогда попавшие в организм микроорганизмы получат возможность беспрепятственно размножаться, что может привести к сепсису.
Современными исследованиями показано, что на клеточном уровненеизбежными компонентами стресса являются:
• активация свободнорадикального и перекисного окисления липидов и белков, индуцируемая высокими концентрациями катехоламинов (оксидативный стресс);
• повреждение или структурно-функциональная модификация клеточных мембран и органелл образующимися в избытке свободными радикалами (клеточный стресс);
• дестабилизация лизосомальных мембран и высвобождение протеолитических ферментов в цитоплазму и плазму крови и как результат — ферментемия;
• образование митохондриальных пор с выходом из митохондрий их содержимого и др.
В третьей стадии употреблять термин «общий адаптационный синдром» представляется не вполне уместным. Следует подчеркнуть, что наступление дистресса,или стадии истощения,возникает только при действии раздражителей, превышающих функциональные ресурсы нейроэндокринного аппарата.
В своем труде «Очерки об адаптационном синдроме» Г. Селье пишет о неоптимальности адаптаций вообще и стрессорной адаптации в частности. Он указывает на потенциальную патогенность стресса и вводит понятие болезней адаптации.Этот термин нельзя признать удачным, поскольку «адаптацией» заболеть нельзя, хотя сам факт такой патологии не вызывает сомнений. Г. Селье использовал и более удачное название для нее — «стресс-болезни»(язвенная болезнь желудка и двенадцатиперстной кишки, иммунодефициты, онкозаболевания, ожирение, сахарный диабет, остео-
хондроз, артриты, воспалительные изменения в тканях глаза, гипертоническая болезнь, импотенция, бесплодие и др.).
Стресс-болезнипоявляются, когда приспособительная реакция организма становится неадекватной и выступает в роли патогенного фактора. Например, избыток стероидных гормонов при частых и интенсивных стрессах может способствовать возникновению поражений желудочно-кишечного тракта (стероидная язва). Экспериментально доказано, что стресс ускоряет рост новообразований, повышает частоту метастазирования, улучшает перевиваемость опухолей. Кроме того, хронический стресс вызывает нервно-психические расстройства (депрессию, тревогу, утомляемость и т.д.).
У людей с функциональной недостаточностью гипоталамогипофизарной или симпатоадреналовой системы стадия резистентности может отсутствовать, тогда возможно быстрое наступление дистресса.К развитию «стрессовых болезней»может привести и нарушение взаимоотношений двигательного и вегетативного аппарата. Современный человек — существо социальное, он (в отличие от древних предков) сдерживает свои эмоции, не проявляет двигательных реакций в ответ на стрессор (бегство, нападение и др.).
В настоящее время российскими медиками описана роль эмоционального стресса в развитии соматических и психических заболеваний у ликвидаторов последствий аварии на Чернобыльской АЭС, особенно эти нарушения были выражены при длительном, интенсивном стрессе. Интересно, что американские эпидемиологи обнаружили наибольший уровень стресса и частоту болезней адаптации у индивидов, чьи амбиции не соответствовали их социальному или профессиональному статусу. И напротив, плодотворная деятельность в соответствии со способностями и уровнем притязаний человека препятствовала дистрессу.
Механизмы, переводящие организм из фазы сопротивления в фазу истощения, до сих пор до конца не выяснены.
Г. Селье рассматривал стресс-болезни как результат функциональной недостаточности коры надпочечников и нарушения равновесия между провоспалительными (альдостерон, дезоксикортикостерон) и противовоспалительными кортикостероидами (кортизол, кортикостерон). Следует отметить, что в сущности все эти заболевания связаны с расстройством тех органов и тканей, которые во время стресса оказываются в «метаболическом проигрыше».
Особенно высока патогенность хронического стресса для лиц с недостаточностью стресс-лимитирующих систем, гипокортицизмом, синдромом хронической усталости, гипофизарной недостаточностью. Например, опасность длительного отрицательного эмоционального состояния заключается в том, что сформировавшийся в ЦНС генератор патологически усиленного возбуждения нейрогуморальным путем начинает оказывать непрерывные нисходящие влияния на соматовисцеральные функции. Если при кратковременных стресс-реакциях измененные функции быстро возвращаются к исходному уровню, то в условиях хронического стресса длительные перегрузки приводят к необратимым изменениям в отдельных звеньях саморегуляции какой-либо функции. Выход из строя того или иного органа и развитие соответствующего заболевания обусловлены генетической предрасположенностью и избирательным вовлечением их в патологический процесс.
Клинические наблюдения и экспериментальные данные показывают, что развитие эмоционального стресса в конфликтной ситуации у разных индивидуумов может идти различными путями. В тех случаях, когда имеются генетические или приобретенные механизмы устойчивости, стресс не приводит ни к церебральным, ни к соматовисцеральным нарушениям. В других случаях могут развиваться нарушения деятельности ЦНС в форме неврозов либо висцеральные нарушения в форме ишемической болезни сердца, артериальной гипертензии, поражений желудочно-кишечного тракта и т.д. Иногда может наблюдаться сочетанное нарушение церебральных и висцеральных функций.
Источник
Стрессор
↓
Раздражение периферических сенсорных систем
↓
Возбуждение ЦНС — коры головного мозга и лимбической системы
↓
Возбуждение гипоталамуса
среднего заднего (симпатического отдела)
↓ ↓
выработка кортиколиберина по нисходящим
↓ симпатическим путям
стимуляция аденогипофиза к мозговому слою надпочечников
↓ ↓
усиление синтеза выброс катехоламинов
аденокортикотропного гормона (адреналин, норадреналин)
(АКТГ) ↓
↓ эффект
стимуляция коры надпочечников
↓
повышение секреции глюкокортикоидов
(гидрокортизон, кортикостерон)
↓
эффект
Адаптогенный эффект глюкокортикоидов и катехоламинов в организме проявляется следующим образом. Их влияние на сердечно-сосудистую системупроявляетсяее гиперфункцией, повышаются сосудистый тонус (вазоконстрикторный эффект), частота сердечных сокращений, сердечный выброс, ОЦК, артериальное давление и скорость кровотока. В результате быстрее осуществляется транспорт кислорода и субстратов к тканям. В развитии артериальной гипертензии при стрессе существенное значение имеет также стимулирующее действие катехоламинов на секрецию почками ренина. Влияние на дыхательную систему определяется повышением эффективности внешнего дыхания. Кроме того, при избытке глюкокортикоидов в организме регистрируются изменения со стороны системы крови: усиливаются эритропоэз и тромбоцитопоэз. Повышается число циркулирующих нейтрофильных гранулоцитов. Однако процессы моно- и лимфоцитопоэза при этом угнетаются. В крови устанавливается лимфопения, а также эозинопения. Это в свою очередь влияет на состояние клеточного и гуморального иммунитета (подавляется фагоцитоз, антителообразование).
Метаболический эффект глюкокортикоидов и катехоламинов проявляется в сфере углеводного, белкового и липидного обмена. Смысл его заключается в мобилизации и «перекачке» энергетических ресурсов организма в активно работающие органы: сердце, мозг, отчасти в печень, почки. Разберем подробнее эффекты глюкокортикоидов и катехоламинов на обмен веществ в организме.
Углеводный обмен. Глюкокортикоиды и катехоламины угнетают секрецию и эффекты инсулина, действуя как его антогонисты. Это приводит к уменьшению захвата глюкозы инсулинозависимыми тканями и органами, такими как кожа, скелетные мыщцы, органы ЖКТ, кровеносные сосуды, жировая ткань. В то же время возрастает доступность глюкозы для сердца, печени, почек, клетки которых располагают как инсулинозависимыми, так и инсулинонезависимыми механизмами захвата и метаболизма глюкозы. Накоплению глюкозы в печени и почках способствует также свойство глюкокортикоидов стимулировать процессы глюконеогенеза (синтеза глюкозы из аминокислот, жирных кислот, глицерина и др.). При этом недостаток глюкозы в инсулинозависимых тканях компенсируется усилением под влиянием катехоламинов процессов гликогенолиза (расщепления гликогена до глюкозы).
Белковый обмен. Глюкокортикоиды усиливают синтез белка в сердечной мышце, печени, в органах ЦНС и в то же время подавляют синтез белка и повышают интенсивность белкового распада в коже, костях, скелетных мышцах, в лимфоидной и жировой ткани.
Кроме того, глюкокортикоиды и катехоламины действуют на жировой обмен – стимулируют липолиз, освобождая из подкожной жировой клетчатки, легких и костного мозга неэтерифицированные жирные кислоты, которые могут быть использованы некоторыми тканями и органами (например, сердечной и скелетными мышцами, почками, нервной тканью) в качестве энергетических эквивалентов.
Образующиеся при катаболизме белков и липидов аминокислоты и жирные кислоты служат дополнительным субстратом для глюконеогенеза в печени и почках.
Помимо перечисленных метаболических эффектов глюкокортикоиды обладают мощным противовоспалительным действием. Они стабилизируют мембраны клеток и клеточных органелл, тормозят высвобождение из клеток медиаторов воспаления.
Если действие стрессора прекращается, то изменения, вызванные им в организме, постепенно нормализуются. Однако если действие патогенного фактора сохраняется в течение длительного времени, то развивается истощение коры надпочечников и развивается третья стадия – стадия истощения.
Несмотря на то, что общий адаптационный синдром имеет защитно-приспособительное значение, чрезмерно сильная реакция на стрессор либо длительное действие стрессорного фактора могут стать причиной патологических изменений в организме. Данное явление Селье охарактеризовал как болезни адаптации или дистресс. В частности, при хроническом стрессе за счет чрезмерной секреции глюкокортикоидов возможно развитие вторичных иммунодефицитов, подавление такой неспецифической защитной реакции как воспаление. Стресс является патогенетической основой развития заболеваний ССС и ЖКТ (в частности гипертонической болезни и язвенной болезни желудка), бесплодия и др. К развитию «стрессовых болезней» может привести нарушение взаимоотношений двигательного и вегетативного аппарата. Современный человек – существо социальное, он (в отличие от древних предков) сдерживает свои эмоции, не проявляет двигательных реакций в ответ на стрессор (бегство, нападение и др.).
Интересен в этой связи вопрос: «А существуют ли в организмесистемы, лимитирующие проявления стресса?».
Различают центральные и периферические системы, ограничивающие стресс-реакцию.
§ Центральная
o ГАМК-ергическая система (γ-аминомасляная кислота — метаболит глютаминовой кислоты — тормозной медиатор);
o Опиоид-ергическая (эндорфины и энкефалины, выделяемые гипоталамусом и периферическими органами, они обладают анальгезирующим эффектом, лимитируют болевой стресс).
§ Периферическая
o простогландины (они влияют на гладкую мускулатуру, кровяное давление, железы внутренней секреции, водно-солевой обмен);
o антиоксиданты – клеточные системы защиты от повреждения свободными радикалами: аскарбиновая кислота – регенерирует окисляющиеся токоферол и убихинон; каталаза – разлагает пероксид водорода с выделением кислорода; глутатионпероксидазы – удаляют гидроперекиси липидов и т.д.);
o стрессорные белки (белки теплового шока – участвуют в организации изменений теплорегуляции).
В заключение хотелось бы подчеркнуть важность стресс-реакции для организма словами Вольтера: «Страсти – это ветры, надувающие паруса корабля. Они иногда его топят, но без них он не может плавать».
Источник
