Изменения белковой фракции при нефротическом синдроме
[06-011]
Белковые фракции в сыворотке
500 руб.
Определение количественных и качественных изменений основных фракций белка крови, используемое для диагностики и контроля лечения острых и хронических воспалений инфекционного и неинфекционного генеза, а также онкологических (моноклональных гаммапатий) и некоторых других заболеваний.
Синонимы русские
Протеинограмма.
Синонимы английские
Serum Protein Electrophoresis (SPE, SPEP).
Метод исследования
Электрофорез на пластинках с агарозным гелем.
Единицы измерения
Г/л (грамм на литр), % (процент).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Общий белок сыворотки крови включает в себя альбумин и глобулины, которые в норме находятся в определенном качественном и количественном соотношении. Оно может быть оценено с помощью нескольких лабораторных методов. Электрофорез белков в агарозном геле – это метод разделения белковых молекул, основанный на различной скорости их движения в электрическом поле в зависимости от размера, заряда и формы. При разделении общего белка сыворотки крови удается выявить 5 основных фракций. При проведении электрофореза белковые фракции определяются в виде полос различной ширины с характерным, специфичным для каждого типа белка местоположением в геле. Для определения доли каждой фракции в общем количестве белка оценивают интенсивность полос. Так, например, основная белковая фракция сыворотки – это альбумин. На его долю приходится около 2/3 всего белка крови. Альбумин соответствует самой интенсивной полосе, полученной при электрофорезе белков сыворотки крови здорового человека. К другим фракциям сыворотки, выявляемым с помощью метода электрофореза, относят: альфа-1 (преимущественно альфа-1-антитрипсин), альфа-2 (альфа-2-макроглобулин и гаптоглобин), бета (трансферрин и С3-компонент комплемента) и гамма-глобулины (иммуноглобулины). Различные острые и хронические воспалительные процессы и опухолевые заболевания сопровождаются изменением нормального соотношения белковых фракций. Отсутствие какой-либо полосы может указывать на дефицит белка, что наблюдается при иммунодефицитах или недостаточности альфа-1-антитрипсина. Избыток какого-либо белка сопровождается увеличением интенсивности соответствующей полосы, что наиболее часто наблюдается при различных гаммапатиях. Результат электрофоретического разделения белков может быть представлен графически, при этом каждая фракция характеризуется определенной высотой, отражающей ее долю в общем белке сыворотки. Патологическое увеличение доли какой-либо фракции носит название «пик», например «М-пик» при множественной миеломе.
Исследование белковых фракций играет особую роль при диагностике моноклональных гаммапатий. В эту группу заболеваний входят множественная миелома, моноклональная гаммапатия неясного генеза, макроглобулинемия Вальденстрема и некоторые другие состояния. Эти заболевания характеризуются клональной пролиферацией В-лимфоцитов или плазматических клеток, при которой происходит бесконтрольная выработка одного вида (одного идиотипа) иммуноглобулинов. При разделении сывороточного белка пациентов с моноклональной гаммапатией с помощью электрофореза наблюдаются характерные изменения – появление узкой интенсивной полосы в зоне гамма-глобулинов, которая называется М-пик, или М-белок. М-пик может отражать гиперпродукцию любого иммуноглобулина (как IgG при множественной миеломе, так и IgM при макроглобулинемии Вальденстрема и IgA при моноклональной гаммапатии неясного генеза). Важно отметить, что метод электрофореза в агарозном геле не позволяет дифференцировать различные классы иммуноглобулинов между собой. Для этой цели используют иммуноэлектрофорез. Кроме того, данное исследование позволяет дать приблизительную оценку количества патологического иммуноглобулина. В связи с этим исследование не показано для дифференциальной диагностики множественной миеломы и моноклональной гаммапатии неясного генеза, так как она требует более точного измерения количества М-белка. С другой стороны, если диагноз «множественная миелома» был верифицирован, метод электрофореза в агарозном геле может быть использован для оценки динамики М-белка при контроле лечения. Следует отметить, что у 10 % пациентов с множественной миеломой нет никаких отклонений в протеинограмме. Таким образом, нормальная протеинограмма, полученная с помощью электрофореза в агарозном геле, не позволяет полностью исключить это заболевание.
Другим примером гаммапатии, выявляемой с помощью электрофореза, является ее поликлональная разновидность. Она характеризуется гиперпродукцией различных видов (различных идиотипов) иммуноглобулинов, что определяется как однородное увеличение интенсивности полосы гамма-глобулинов при отсутствии каких-либо пиков. Поликлональная гаммапатия наблюдается при многих хронических воспалительных заболеваниях (инфекционных и аутоиммунных), а также при патологии печени (вирусных гепатитах).
Исследование белковых фракций сыворотки крови используют для диагностики различных синдромов иммунодефицита. Примером может послужить агаммаглобулинемия Брутона, при которой снижается концентрация всех классов иммуноглобулинов. Электрофорез белков сыворотки пациента с болезнью Брутона характеризуется отсутствием или крайне низкой интенсивностью полосы гамма-глобулинов. Низкая интенсивность альфа-1-полосы – характерный диагностический признак недостаточности альфа-1-антитрипсина.
Широкий спектр состояний, при которых наблюдаются качественные и количественные изменения протеинограммы, включает самые разные заболевания (от хронической сердечной недостаточности до вирусных гепатитов). Несмотря на наличие некоторых типичных отклонений протеинограммы, позволяющих в ряде случаев с определенной уверенностью диагностировать заболевание, обычно результат электрофореза белков сыворотки не может служить однозначным критерием постановки диагноза. Поэтому интерпретацию исследования белковых фракций крови проводят с учетом дополнительных клинических, лабораторных и инструментальных данных.
Для чего используется исследование?
- Для оценки качественного и количественного соотношения основных белковых фракций у пациентов с острыми и хроническими инфекционными заболеваниями, аутоиммунными состояниями и некоторыми болезнями печени (хронические вирусные гепатиты) и почек (нефротический синдром).
- Для диагностики и контроля лечения моноклональных гаммапатий (множественной миеломы и моноклональной гаммапатии неясного генеза).
- Для диагностики синдромов иммунодефицита (агаммаглобулинемии Брутона).
Когда назначается исследование?
- При обследовании пациента с острыми или хроническими инфекционными заболеваниями, аутоиммунными состояниями и некоторыми болезнями печени (хронические вирусные гепатиты) и почек (нефротический синдром).
- При симптомах множественной миеломы: патологических переломах или болях в костях, немотивированной слабости, персистирующей лихорадки, рецидивирующих инфекционных заболеваниях.
- При отклонениях в других лабораторных анализах, позволяющих заподозрить множественную миелому: гиперкальциемии, гипоальбуминемии, лейкопении и анемии.
- При подозрении на недостаточность альфа-1-антитрипсина, болезнь Брутона и другие иммунодефициты.
Что означают результаты?
Референсные значения
- Общий белок
Возраст | Референсные значения |
0-7 месяцев | 44 — 76 г/л |
7-12 месяцев | 51 — 73 г/л |
1-3 года | 56 — 75 г/л |
3-18 лет | 60 — 80 г/л |
Больше 18 лет | 64 — 83 г/л |
Компонент | Референсные значения |
Альбумин, % | 55,8 — 66,1 % |
Альфа-1-глобулин, % | 2,9 — 4,9 % |
Альфа-2-глобулин, % | 7,1 — 11,8 % |
Бета-1-глобулин, % | 4,7 — 7,2 % |
Бета-2-глобулин, % | 3,2 — 6,5 % |
Гамма-глобулин, % | 11,1 — 18,8 % |
Причины повышения фракции альбумина:
- беременность;
- дегидратация;
- алкоголизм.
Причины понижения фракции альбумина:
- острая ревматическая лихорадка;
- острый холецистит;
- сахарный диабет;
- воспалительные и опухолевые заболевания ЖКТ;
- нефротический синдром;
- нефритический синдром;
- лейкоз;
- лимфома;
- хроническая сердечная недостаточность;
- макроглобулинемия;
- множественная миелома;
- остеомиелит;
- язвенная болезнь;
- пневмония;
- саркоидоз;
- системная красная волчанка;
- неспецифический язвенный колит;
- прием глюкокортикоидов.
Причины повышения фракции альфа-1-глобулина:
- острые или хронические воспалительные заболевания;
- лимфогранулематоз;
- цирроз печени;
- язвенная болезнь;
- беременность;
- стресс;
- прием пероральных контрацептивов.
Причины понижения фракции альфа-1-глобулина:
- недостаточность альфа-1-антитрипсина;
- острый вирусный гепатит.
Причины повышения фракции альфа-2-глобулина:
- острая ревматическая лихорадка;
- хронический гломерулонефрит;
- цирроз печени;
- сахарный диабет;
- диспротеинемия;
- лимфогранулематоз;
- пожилой и младенческий возраст;
- нефротический синдром;
- остеомиелит;
- язвенная болезнь;
- пневмония;
- узловатый полиартериит;
- ревматоидный артрит;
- саркоидоз;
- стресс;
- системная красная волчанка;
- мальабсорбция;
- неспецифический язвенный колит.
Причины понижения фракции альфа-2-глобулина:
- острый вирусный гепатит;
- гипогаптоглобинемия;
- интраваскулярный гемолиз;
- гипертиреоз;
- мальабсорбция.
Причины повышения фракции бета-глобулина:
- острые воспалительные заболевания;
- сахарный диабет;
- диспротеинемия;
- гломерулонефрит;
- гиперхолестеринемия;
- железодефицитная анемия;
- подпеченочная желтуха;
- макроглобулинемия;
- нефротический синдром;
- беременность;
- ревматоидный артрит;
- саркоидоз;
- прием пероральных контрацептивов.
Причины понижения фракции бета-глобулина:
- аутоиммунные заболевания;
- лейкоз;
- лимфома;
- нефротический синдром;
- системная склеродермия;
- стеаторея;
- системная красная волчанка;
- цирроз печени;
- неспецифический язвенный колит.
Причины повышения фракции гамма-глобулина:
- амилоидоз;
- цирроз печени;
- хронический лимфолейкоз;
- криоглобулинемия;
- муковисцидоз;
- тиреоидит Хашимото;
- ювенильный ревматоидный артрит;
- множественная миелома;
- моноклональная гаммапатия неясного генеза;
- ревматоидный артрит;
- саркоидоз;
- системная склеродермия;
- синдром Шегрена;
- системная красная волчанка;
- макроглобулинемия Вальденстрема.
Причины понижения фракции гамма-глобулина:
- острый вирусный гепатит;
- агаммаглобулинемия;
- гломерулонефрит;
- лейкоз;
- лимфома;
- нефротический синдром;
- мальабсорбция;
- склеродермия;
- стеаторея;
- неспецифический язвенный колит.
Что может влиять на результат?
- Применение пенициллина может приводить к расщеплению полосы альбумина.
- Использование радиоконтрастных веществ, а также недавняя процедура гемодиализа препятствует интерпретации результата исследования.
Важные замечания
- Исследование не позволяет дифференцировать различные классы иммуноглобулинов (IgA, IgM, IgG) между собой и не предназначено для дифференциальной диагностики множественной миеломы и моноклональной гаммапатии неясного генеза.
- У 10 % пациентов с множественной миеломой протеинограмма в норме.
Также рекомендуется
- Альбумин в сыворотке
- Альфа-1-антитрипсин
- Белок общий в сыворотке
- Белок общий в моче
- Кальций ионизированный
- Суммарные иммуноглобулины G (IgG) в сыворотке
- Суммарные иммуноглобулины M (IgM) в сыворотке
Кто назначает исследование?
Врач общей практики, онколог, гематолог.
Литература
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. – Saunder Elsevier, 2008.
- DeVita V.T. Principles and practice of Oncology / V.T. DeVita, Lawrence T.S., Rosenberg S.A; 8th ed. – Lippincott Williams & Wilkins, 2008.
- Fauci et al. Harrison’s Principles of Internal Medicine/A. Fauci, D. Kasper, D. Longo, E. Braunwald, S. Hauser, J. L. Jameson, J. Loscalzo; 17 ed. – The McGraw-Hill Companies, 2008.
Источник
Альбумины. На долю альбуминов приходится более
половины (55–60%) белков плазмы крови человека. Мол. масса альбумина около
70000. Сывороточные альбумины сравнительно быстро обновляются (период
полураспада альбуминов человека 7 дней).
Благодаря
высокой гидрофильности, особенно в связи с относительно небольшим размером
молекул и значительной концентрацией в сыворотке, альбумины играют важную роль
в поддержании онкотического давления крови. Известно, что концентрация
альбуминов в сыворотке ниже 30 г/л вызывает значительные изменения
онкотического давления крови, что приводит к возникновению отеков. Альбумины
выполняют важную функцию транспорта многих биологически активных веществ (в
частности, гормонов). Они способны связываться с холестерином, желчными
пигментами. Значительная часть кальция в сыворотке крови также связана с
альбуминами.
При
электрофорезе в крахмальном геле фракция альбуминов у некоторых людей иногда
делится на две (альбумин А и альбумин В), т.е. у таких людей имеется два
независимых генетических локуса, контролирующих синтез альбуминов. Добавочная
фракция (альбумин В) отличается от обычного сывороточного альбумина тем, что
молекулы этого белка содержат два остатка дикарбоновых аминокислот или более,
замещающих в полипептидной цепи обычного альбумина остатки тирозина или
цистеина. Существуют и другие редкие варианты альбумина (альбумин Ридинг,
альбумин Джент, альбумин Маки). Наследование полиморфизма альбуминов происходит
по аутосомному кодоминантному типу и наблюдается в нескольких поколениях.
Помимо
наследственного полиморфизма альбуминов, встречается преходящая
бисальбуминемия, которую иногда принимают за врожденную. Описано появление
быстрого компонента альбумина у больных, получавших большие дозы пенициллина. После
отмены пенициллина этот компонент вскоре исчезал из крови. Существует
предположение, что повышение электрофоретической подвижности фракции
альбумин–антибиотик связано с увеличением отрицательного заряда за счет
СООН-групп пенициллина.
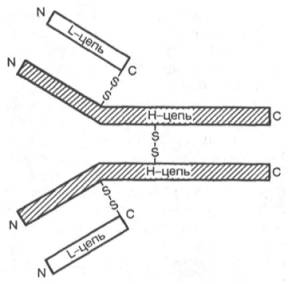
Рис. 17.2. Строение
молекулы иммуноглобулинов (схема). Объяснения в тексте.
Глобулины.
Сывороточные глобулины при высаливании нейтральными солями можно разделить на 2
фракции – эуглобулины и псевдоглобулины. Фракция эуглобулинов в основном
состоит из γ-глобулинов, а фракция псевдоглобулинов включает α-,
β- и γ-глобулины, которые при электрофорезе, особенно в
крахмальном или полиакриламидном геле, способны разделяться на ряд подфракций. α- и
β-Глобулиновые фракции содержат липопротеины, а также белки, связанные с
металлами. Большая часть антител, содержащихся в сыворотке, находится во
фракции γ-глобулинов. При снижении уровня белков этой фракции резко
понижаются защитные силы организма.
Иммуноглобулины,
или антитела , синтезируются В-лимфоцитами или образующимися из них
плазматическими клетками. Известно 5 классов иммуноглобулинов: IgG,
IgA, IgM, IgD и IgE, при этом IgG,
IgA и IgM – основные классы; IgD и
IgE – минорные классы иммуноглобулинов плазмы человека. Молекула
иммуноглобулина состоит из двух идентичных пар полипептидных цепей. Каждая пара
в свою очередь состоит из двух разных цепей: легкой (L) и тяжелой (Н). Иными
словами, молекула иммуноглобулинов состоит из двух легких (L) цепей (мол. масса
23000) и двух тяжелых (Н) цепей (мол. масса 53000–75000), образующих тетрамер (L2H2)
при помощи дисульфидных связей (рис. 17.2). Каждая цепь разделена (может
быть, несколько условно) на специфические домены, или участки, имеющие
определенное структурное и функциональное значение. Половину легкой цепи,
включающую карбоксильный конец, называют константной областью (CL), a
N-концевую половину легкой цепи – вариабельной областью (VL).
Примерно
четвертую часть тяжелой цепи, включающую N-конец, относят к вариабельной области
Н-цепи (VH), остальная часть ее – это
константные области (СН1, СН2, СН3). Участок
иммуноглобулина, связывающийся со специфическим антигеном, формируется
N-концевыми вариабельными областями легких и тяжелых цепей, т.е. VH-
и УL-доменами. У высших позвоночных имеются все 5 классов
антител (IgA, IgD, IgE, IgG и IgM), каждый со
своим классом Н-цепей: α, δ, ε, γ и μ соответственно.
Молекулы IgA содержат α-цепи, молекулы IgG –
γ-цепи и т.д. Кроме того, имеется ряд подклассов иммуноглобулинов IgG и
IgA. Например, у человека существует 4 подкласса IgG:
IgG1, IgG2, IgG3и IgG4,
содержащих тяжелые цепи γ1, γ2,
γ3и γ4соответственно.
Разные Н-цепи придают шарнирным участкам и «хвостовым» областям антител
различную конформацию и определяют характерные свойства каждого класса и
подкласса (подробнее см. руководства по иммунологии).
В клинической
практике встречаются состояния, характеризующиеся изменением как общего
количества белков плазмы крови, так и процентного соотношения отдельных
белковых фракций.
Гиперпротеинемия – увеличение общего содержания белков плазмы. Диарея у
детей, рвота при непроходимости верхнего отдела тонкой кишки, обширные ожоги
могут способствовать повышению концентрации белков в плазме крови. Иными
словами, потеря воды организмом, а следовательно, и плазмой приводит к
повышению концентрации белка в крови (относительная гиперпротеинемия).
При ряде
патологических состояний может наблюдаться абсолютная гиперпротеинемия,
обусловленная увеличением уровня γ-глобулинов: например, гиперпротеинемия
в результате инфекционного или токсического раздражения системы макрофагов;
гиперпротеинемия при миеломной болезни. В сыворотке крови больных миеломной
болезнью обнаруживаются специфические «миеломные» белки. Появление в плазме
крови белков, не существующих в нормальных условиях, принято называть парапротеине-мией. Нередко при этом
заболевании содержание белков в плазме достигает 100–160 г/л.
Иногда при
миеломной болезни аномальные белки плазмы преодолевают почечный барьер и
появляются в моче. Эти белки, представляющие собой легкие цепи
иммуноглобулинов, получили название белков Бенс-Джонса. Явления парапротеинемии
можно наблюдать и при макроглобу-линемии Вальденстрема. Для болезни
Вальденстрема характерно появление в плазме крови белков с большой молекулярной
массой (1000000– 1600000); содержание макроглобулинов может достигать 80% от
общего количества белка, составляющего в этом случае 150–160 г/л.
Гипопротеинемия, или уменьшение общего количества белка в плазме крови,
наблюдается главным образом при снижении уровня альбуминов. Выраженная
гипопротеинемия – постоянный и патогенетически важный симптом нефротического
синдрома. Содержание общего белка снижается до 30–40 г/л. Гипопротеинемия
наблюдается также при поражении печеночных клеток (острая атрофия печени,
токсический гепатит и др.). Кроме того, гипопротеинемия может возникнуть при
резко увеличенной проницаемости стенок капилляров, при белковой недостаточности
(поражение пищеварительного тракта, карцинома и др.). Следовательно, можно
считать, что гиперпротеинемия, как правило, связана с гиперглобулинемией, а
гипопро-теинемия – с гипоальбуминемией.
При многих
заболеваниях очень часто изменяется процентное соотношение отдельных белковых
фракций, хотя общее содержание белка в сыворотке крови
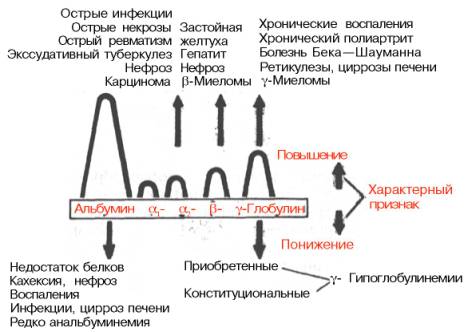
остается в пределах нормы. Такое состояние носит название «диспротеинемия». На рис. 17.3 схематично
представлен характер изменения белковых фракций сыворотки крови при ряде
заболеваний без учета формы и стадии болезни.

Рис. 17.3. Изменения
электрофореграммы белков сыворотки крови при некоторых заболеваниях (по
Эммриху).
В течении
многих болезней, связанных с общим воспалением (инфекционные заболевания,
ревматизм и т.д.), отмечается несколько стадий, что, несомненно, сказывается и
на белковом спектре крови.
Как
отмечалось, α- и β-глобулиновые фракции белков
сыворотки крови содержат липопротеины и гликопротеины. В состав углеводной
части гликопротеинов крови входят в основном следующие моносахариды и их
производные: галактоза, манноза, рамноза, глюкозамин, галактозамин, нейраминовая
кислота и ее производные (сиаловые кислоты). Соотношение этих углеводных
компонентов в отдельных гликопротеинах сыворотки крови различно. Чаще всего в
осуществлении связи между белковой и углеводной частями молекулы гликопротеинов
принимают участие аспа-рагиновая кислота (ее карбоксил) и глюкозамин. Несколько
реже встречается связь между гидроксилом треонина или серина и гексозаминами
или гексозами.
Нейраминовая
кислота и ее производные (сиаловые кислоты) – наиболее лабильные и активные
компоненты гликопротеинов. Они занимают конечное положение в углеводной цепочке
молекулы гликопротеинов и во многом определяют свойства данного гликопротеина.
Гликопротеины
имеются почти во всех белковых фракциях сыворотки крови. При электрофорезе на
бумаге гликопротеины в большом количестве выявляются в α1-
и α2-фракциях глобулинов. Гликопротеины, связанные с
α-глобулиновыми фракциями, содержат небольшое количество фруктозы, а
гликопротеины, выявляемые в составе β- и особенно
γ-глобулиновых фракций, содержат фруктозу в значительном количестве.
Повышенное
содержание гликопротеинов в плазме или сыворотке крови наблюдается при
туберкулезе, плевритах, пневмониях, остром ревматизме, гломерулонефритах,
нефротическом синдроме, диабете, инфаркте миокарда, подагре,
а также при остром и хроническом лейкозах, миеломе, лимфосаркоме и некоторых
других болезнях. У больного ревматизмом увеличение содержания гликопротеинов в
сыворотке соответствует тяжести заболевания. Это объясняется, по мнению ряда
исследователей, деполимеризацией основного вещества соединительной ткани, что
приводит к поступлению гликопротеинов в кровь.

Источник
