Ивл у ребенка синдром ундины
Сибирские врачи провели уникальную операцию чрезвычайной сложности. Ребёнку с так называемым «синдромом проклятия Ундины» вживили аппарат для стимуляции дыхания. Без него девочка Инна могла скончаться в любую секунду.
Любительское видео по просьбе журналистов Первого канала снимали родители 11-летней Инны Шахмаевой. Ей сделали уникальную для России операцию по стимуляции дыхания. Сейчас девочка уже дома. Иммунитет сильно ослаблен, и поэтому к ребенку никого не пускают.
У Инны — очень редкое заболевание — «синдром проклятия Ундины». Суть в том, что ночью в любой момент может произойти нарушение работы дыхательной системы, и ребенок просто перестает дышать. У Инны это впервые случилось, когда ей было три с половиной года. Вечером родители заметили, что девочка начала синеть во сне. Евгения Шахмаева, мама Инны: «Привезли в больницу, здесь нас выходили и отправили домой. Мы три года благополучно дома жили. А потом опять через три года остановка дыхания. И на этот раз уже здесь врачи всяко разно пытались ее опять как-то реабилитировать, чтобы она как-то задышала сама. Уже ничего не получалось».
Почти пять лет Инна Шахмаева прожила в реанимации зонального перинатального центра города Новокузнецка. Врачи не отпускали девочку домой. Остановка дыхания могла произойти в любой момент.
Ирина Каличкина, врач-реаниматолог МЛПУ «Зональный перинатальный центр г.Новокузнецка»: «Непрерывный мониторинг проводился. Постоянно снимались показатели степени насыщения кислородом крови, и при малейшем их снижении нами принимались меры по переводу ребенка на искусственную вентиляцию легких».
Необычное название страшной болезни связано с легендой. Водяная фея Ундина, обманутая мужем, наказала его. Он переставал дышать, как только засыпал. Раньше эту болезнь называли «синдромом внезапной детской смерти». Малыши умирали, как правило, еще в возрасте до года.
У Инны болезнь проявилась позже. Пока дочь лежала в реанимации, ее мама Евгения делала все, чтобы спасти ребенка. Обзванивала больницы, просила помощи на форумах в интернете. Ей посоветовали обратиться в Новосибирск.
Специальный аппарат — стимулятор диафрагмальных нервов — подарил Инне надежду на жизнь вне больничных стен. Суть операции в том, что в организм ребенка вживляют специальные датчики. Они связаны с переносной базой. Где бы Инна ни находилась, эта база везде будет с ней. Радиопередатчик позволяет регулировать силу тока. Импульсы воздействуют на диафрагму, задавая определенную частоту дыхания.
После операции еще три месяца Инна в больнице фактически заново училась дышать.
Евгений Половников, врач-нейрохирург ДКБ 1 г.Новосибирска: «Пациента, как говорится, «раздыхивают». Дышат от нескольких минут до одного-двух часов с последующим увеличением, и доводят до суток».
Главной проблемой для родителей было накопить деньги на аппарат. Он стоит больше миллиона рублей. За полгода собрали почти половину нужной суммы. Как-то вечером Шахмаевым позвонила женщина и спросила, сколько не хватает.
Евгения Шахмаева, мама Инны Шахмаевой: «Самую большую сумму нам внесла женщина, у которой ребенок погиб, не дождавшись лечения. И она пожертвовала большую сумму на лечение. А так бы мы еще долго очень собирали».
Родители понимают, что Инна не стала абсолютно здоровым ребенком. Ей уже 11 лет, а она почти не разговаривает. Приступы кислородного голодания не могли не повлиять на работу нервной системы. Врачи говорят, детей с диагнозом «проклятие Ундины» надо бы оперировать как можно раньше.
Пятилетний Кирилл из Красноярска — следующий после Инны в очереди к нейрохирургам. У него первый приступ остановки дыхания был год назад, и, по мнению докторов, этот ребенок сможет расти и развиваться, как и его сверстники, если с операцией не затягивать.
Елена Николаенко, мама Кирилла: «Вдруг возьмут и вылечат… Чудеса бывают. Так и мы надеемся, что все будет хорошо».
Елена уже купила дорогостоящий стимулятор. Еще нужны деньги на послеоперационную реабилитацию и медикаменты. Пока нет необходимой суммы, Кирилл будет жить в красноярской больнице.
Источник
Синдром Ундины – крайне редкое генетическое заболевание, характеризующееся нарушением автономного дыхания в результате аномальной реакции организма на гиперкапнию во время сна. Основным симптомом этого состояния является апноэ во время фазы глубокого сна, способное привести к летальному исходу, при этом какие-либо патологические изменения со стороны дыхательной, нервной и сердечно-сосудистой систем морфологически отсутствуют. Диагностика синдрома Ундины основывается на результатах электроэнцефалограммы, мониторинга дыхания и сатурации крови больного во время сна, молекулярно-генетических анализов и изучения наследственного анамнеза. Специфического лечения заболевания не существует, используют искусственную вентиляцию легких во время сна и имплантацию стимулятора диафрагмального нерва.
Общие сведения
Синдром Ундины (синдром врожденной центральной гиповентиляции) – очень редкое и относительно тяжелое наследственное заболевание, при котором происходит сначала урежение (брадипноэ), а затем и остановка дыхания во время фазы глубокого сна. Название этой патологии связано с преданием из немецкого фольклора, в котором русалка (ундина) прокляла предавшего ее возлюбленного и обрекла на его на то, что «дыхание покинет тебя, как только ты уснешь». Это весьма похоже на основное проявление синдрома Ундины, которое сводится к остановке дыхания именно во сне. Встречаемость этого состояния на сегодняшний день не определена, всего выявлено порядка трех сотен случаев по всему миру. Механизм наследования синдрома Ундины – аутосомно-доминантный с неполной пенетрантностью, поэтому среди больных преобладают гетерозиготы, но их родители могут быть фенотипически здоровы. Установлено, что в ряде случаев причиной заболевания являются спонтанные мутации.

Синдром Ундины
Причины синдрома Ундины
В настоящее время, несмотря на редкость этого заболевания, врачам-генетикам удалось выяснить молекулярно-генетические основы синдрома Ундины. В подавляющем большинстве случаев причиной этой патологии выступают мутации гена PHOX2B, расположенного на 4 хромосоме. Продуктом его экспрессии является крайне важный транскрипционный фактор, регулирующий эмбриогенез тканей продолговатого мозга и других элементов центральной нервной системы. Суть генетического дефекта при синдроме Ундины заключается в развитии полиаланинового участка в одном из доменов транскрипционного фактора, в результате чего нарушается его способность присоединяться к ДНК и выполнять свою функцию. Обнаружена четкая взаимосвязь между тяжестью проявлений заболевания и величиной участка аномальных полиаланиновых повторов в 3 экзоне гена PHOX2B.
Вышеуказанные генетические аномалии приводят к порокам развития вегетативной нервной системы на молекулярном уровне, в результате чего и возникает синдром Ундины. Доказательством подобных аномалий развития служит частое выявление у больных синдромом врожденной центральной гиповентиляции таких симптомов, как сердечные аритмии, нестабильность артериального давления, замедленная реакция зрачков на свет, нарушения потоотделения. Перечисленные процессы также контролируются вегетативной нервной системой, поэтому их наличие при синдроме Ундины говорит о характере поражения. В редких случаях при этом заболевании отсутствуют изменения в гене PHOX2B, но могут иметься мутации генов RET, EDN3, GDNF и некоторых других.
Синдром Ундины часто сопровождается нейрокристопатиями – патологическими состояниями, обусловленными эмбриональными пороками развития структур нервного гребня. Одним из состояний подобного рода является болезнь Гиршпрунга, проявляющаяся отсутствием клеточных элементов парасимпатической нервной системы в кишечнике. Подобное нарушение имеет место примерно у 15-20% больных синдромом Ундины. Некоторые исследователи выделяют сочетание симптомов болезни Гиршпрунга и врожденной центральной гиповентиляции в отдельную нозологическую единицу – синдром Хаддада, по имени врача, который в 1978 году впервые описал случаи такого сочетанного поражения.
Симптомы синдрома Ундины
Проявления синдрома Ундины зачастую выявляются сразу после рождения больного. В период новорожденности могут обнаруживаться различные нарушения вентиляции в состоянии бодрствования, что требует тщательного наблюдения за ребенком и обуславливает высокий уровень неонатальной смерти при этом заболевании. Впоследствии синдром Ундины характеризуется нормальным дыханием и адекватной вентиляцией в период дневной активности и резким падением глубины дыхательных движений во сне, что приводит к недостаточной оксигенации крови. Затем может возникать брадипноэ и остановка дыхания во сне, что без квалифицированной медицинской помощи может стать причиной смерти больного.
Синдром Ундины также часто сочетается с другими нарушениями вегетативной нервной системы – аритмиями, перепадами артериального давления, возможно снижение перистальтики (в том числе и обусловленное проявлениями болезни Гиршпрунга). В отдельных случаях может выявляться прогрессирование симптомов патологии – от сниженной вентиляции до апноэ во время сна ребенка. В тех случаях, когда синдром Ундины удалось вовремя идентифицировать и принять необходимые лечебные меры, могут присоединиться симптомы сопутствующих заболеваний, обусловленных особенностями лечения таких больных. Это могут быть частые случаи внутрибольничных инфекций из-за практически постоянного пребывания пациентов в стационаре, а также бронхиты и пневмонии, обусловленные применением аппарата для искусственной вентиляции легких.
Диагностика и лечение синдрома Ундины
Диагностика синдрома Ундины производится на основании данных общего осмотра больного ребенка, электроэнцефалограммы, мониторинга дыхательной функции во время сна и бодрствования. Немаловажную роль в определении заболевания может сыграть подробное изучение наследственного анамнеза. Как правило, при рождении дети с синдромом Ундины фенотипически здоровы, изредка наблюдается недоношенность и различные осложнения беременности. При тяжелых формах патологии уже практически в первые дни или даже часы после рождения может возникать выраженный цианоз кожи и нерегулярное дыхание, обуславливающее необходимость особенно тщательного ухода за ребенком. Синдром Ундины также может сопровождаться аритмиями и другими нарушениями, что требует обширного и комплексного медицинского обследования.
На электроэнцефалограмме в случае наличия синдрома Ундины будет определяться пониженная активность структур моста, особенно во время сна. Изучение наследственного анамнеза может выявить сходные нарушения дыхания у родственников больного – особое внимание при этом следует уделить случаям внезапной детской смерти. Отдельные лаборатории производят определение синдрома Ундины при помощи методов современной генетики – посредством выявления полиаланиновых участков в гене PHOX2B. При этом можно установить не только наличие мутации, но и протяженность патологического участка, что позволяет спрогнозировать возможное течение патологии, так как тяжесть заболевания напрямую связана с количеством GCN-повторов в 3-м экзоне гена.
Специфического лечения синдрома Ундины на сегодняшний день не существует, проблема сохранения жизни таким больным представляет собой достаточно трудный вопрос. Чаще всего еще в детском возрасте им накладывают трахеостому для подключения аппарата искусственной вентиляции легких во время сна. Так как в ряде случаев это требует длительного пребывания больного синдромом Ундины в стационаре, значительно повышается риск внутрибольничных инфекций и других осложнений. Поэтому по возможности специальное оборудование устанавливают в доме больного ребенка, а родителей обучают обращению с ним.
Для улучшения качества жизни могут производить имплантацию стимуляторов диафрагмального нерва, которые оценивают частоту дыхательных движений и при необходимости, раздражая нерв, предупреждают развитие бради- и апноэ (аналогичны кардиостимуляторам). На конечных этапах разработки находятся аналогичные приборы, которые оценивают уровень углекислого газа в крови и ее общую сатурацию и при необходимости воздействуют на центральные звенья регуляции дыхания в головном мозге.
Прогноз и профилактика синдрома Ундины
Считается, что прогноз синдрома Ундины или врожденной центральной гипервентиляции скорее неблагоприятный – для этого заболевания характерна относительно высокая неонатальная смертность, в дальнейшем жизнь больного зависит от аппарата искусственной вентиляции легких. Однако в настоящее время многие пациенты с этим заболеванием уже дожили до взрослого возраста, что указывает на отсутствие его прямого влияния на продолжительность жизни или развитие сопутствующих нарушений. Поэтому разработка более совершенных стимуляторов дыхательных движений в будущем позволит обеспечить лицам, страдающим от синдрома Ундины, оптимальный уровень качества жизни. Профилактика заболевания на сегодняшний день не разработана по причине генетической природы и редкости данного состояния.
Источник
Введение
Синдром врожденной центральной гиповентиляции (MIM #209880 синдром проклятия Ундины, Congenital central hypoventilation syndrome, CCHS, Ondine’s curse*) — это редкое генетическое заболевание, проявляющееся первичной альвеолярной гиповентиляцией во время сна (а в более тяжелых случаях — и во время бодрствования), характеризующееся отсутствием автономного контроля над процессом дыхания, снижением чувствительности к гиперкапнии и гипоксемии. В мировой литературе описано всего около 1200 случаев данного заболевания [1]. Частота встречаемости синдрома точно неизвестна, по данным французских авторов, заболевание встречается в 1 случае на 50 000–200 000 новорожденных [2].
Традиционно этот синдром рассматривается в рамках заболеваний, ассоциированных со сном. В таких случаях причиной гиповентиляции являются центральные апноэ. Следует отметить, что у здоровых младенцев возможны короткие центральные апноэ продолжительностью до 20 с при отсутствии существенных изменений газового состава крови. Длительные центральные апноэ во время сна обусловлены нарушением автономной регуляции дыхания [3].
К этой группе заболеваний относятся также поздний синдром центральной гиповентиляции (Late-onset central hypoventilation syndrome — LO-CHS) и синдром ROHHAD. LO-CHS манифестирует в более позднем возрасте приступами цианоза, апноэ во время сна, когнитивными нарушениями, развитием легочного сердца. Синдром ROHHAD, внезапное ожирение с гипоталамической дисфункцией проявляется быстрым увеличением веса с эндокринными расстройствами и центральной гиповентиляцией [4].
В 1962 г. Severinghaus и Mitchell использовали термин «проклятие Ундины» при описании синдрома у 3-х взрослых пациентов после операции на стволе мозга. Им была необходима искусственная вентиляция легких (ИВЛ) в связи с центральными апноэ во время сна, в периоды бодрствования дыхательная функция не нарушалась. В 1970 г. Mellins et al. впервые сообщили о младенце с клиническими особенностями CCHS. В настоящее время известно, что заболевание ассоциировано с мутацией гена РHOX2В в локусе 4p12 (93–100%). Этот ген кодирует транскрипционный фактор, необходимый для развития центральной и периферической нервной системы. В экспериментах на крысах показано, что при дефектах РHOX2В отсутствует ретротрапезоидное ядро в вентролатеральном мозге — центральная часть передачи регуляторных хеморецептивных сигналов дыхания. Мутация в гене-
регуляторе развития автономной нервной системы приводит к снижению чувствительности дыхательного центра к гиперкапнии и гипоксемии. У таких животных фенотип подобен CCHS — апноэ, гиповентиляция и отсутствующая компенсаторная реакция на гиперкапнию. РHOX2В экспрессируется также и в других участках ЦНС, связанных с контролем функции дыхания, а также в периферических хеморецепторах каротидного синуса.
Отсутствие экспрессии РHOX2В в клетках периферической нервной системы объясняет частую ассоциацию синдрома с болезнью Гиршпрунга (около 20% случаев). Другие аномалии (патологическая реакция сердечно-сосудистой системы, зрительного анализатора на стимулы) ассоциированы с нарушением функции РHOX2В на уровне вегетативных ганглиев сердца и ядер черепно-мозговых нервов.
Описаны также редкие мутации других генов (RET, GDNF, EDN3, BDNF, ASCL, PHOX2A, GFRA1, BMP2, ECE1) [5].
Тип наследования при CCHS — аутосомно-доминантный с неполной пенетрантностью, однако в 92% случаев мутации возникают de novo. Описаны семейные случаи данного заболевания.
В большинстве случаев у доношенных детей с неосложненным течением беременности в периоде новорожденности выявляется цианоз, преимущественно во время сна. Несмотря на гипоксемию и гиперкапнию, отсутствует компенсаторное тахипноэ. Возможен судорожный синдром.
Лечение заключается в обеспечении адекватной вентиляции. Предпочтительны неинвазивные методы ИВЛ: вентиляция с постоянным положительным давлением (СРАР), различные виды кислородных масок. При невозможности их использования накладывается трахеостома. Детям старше 18 мес. проводится имплантация стимулятора диафрагмального нерва [6].
Своевременная диагностика и адекватная вентиляция при CCHS изменили прогноз для жизни пациентов. В настоящее время многие из них — старше 20 лет [7].
Мы приводим интересное клиническое наблюдение CCHS у двойни.
Клиническое наблюдение
Мальчик Р. (дата рождения — 12.10.2017) поступил в педиатрическое отделение ДГКБ св. Владимира в возрасте 2 мес. 8 дней в связи с подозрением на аспирацию во время кормления.
Из анамнеза жизни известно, что он родился от I беременности монохориальной диамниотической двойней, наступившей в результате контролируемой стимуляции овуляции. Беременность протекала на фоне фетоплацентарной недостаточности, анемии. Роды первые, оперативные, на сроке 36 нед. Ребенок 2-й из двойни. При рождении масса тела — 2010 г, длина — 44 см, оценка по шкале Апгар — 8/8 баллов. При рождении состояние мальчика расценено как среднетяжелое. С первых суток жизни в течение месяца он находился в отделении патологии новорожденных. ИВЛ не проводилась, однако обращали на себя внимание периодические эпизоды апноэ, купировавшиеся на фоне терапии дыхательными аналептиками. Кроме того, достаточно длительное время ребенок оставался кислородозависимым, что не соответствовало его объективному соматическому статусу и постконцептуальному возрасту. По данным эхокардиографии был диагностирован врожденный порок сердца: дефект межпредсердной перегородки (ДМЖП) в мышечной части размером 3–4 мм без нарушения гемодинамики. Постепенно ребенок перестал нуждаться в дотации кислорода и в возрасте 1 мес. был выписан домой.
Дома мальчик получал сцеженное грудное молоко, к 2-м мес. жизни прибавил 1 кг. Мама отмечала, что ребенок при кормлении периодически поперхивался. В возрасте 2 мес. 8 дней при кормлении снова поперхнулся, закашлялся. Родители отметили цианоз носогубного треугольника, что послужило поводом к госпитализации.
При первичном осмотре состояние средней тяжести. Правильного телосложения, лицевой дисморфизм — умеренная микроретрогения. При осмотре активен, крик громкий. Кожа бледно-розовая, цианоза не отмечено. Сосет сам положенный объем питания, усваивает. Дыхание в легких проводится равномерно во все отделы, хрипов не выслушивается, ЧД 42 в минуту. Тоны сердца отчетливые, ритм правильный, ЧСС 140 в минуту. Живот правильной формы, доступен пальпации. Печень и селезенка не увеличены. Фиксирует взгляд, прослеживает. Мышечный тонус физиологический. Безусловные врожденные рефлексы вызываются по возрасту. Очаговых, менингеальных симптомов нет.
При пульсоксиметрии отмечено снижение сатурации до 86,8%. Были выявлены изменения кислотно-основного состояния (КОС) в виде полностью компенсированного
респираторного ацидоза: рН — 7,4, рСО2 — 60,5 мм рт. ст., рО2 — 49,5 мм рт. ст., сНСО3 — 33,1 ммоль/л, sBE – 12,2 ммоль/л. Отмечались электролитные нарушения в виде гипохлоремии (хлор — 98 ммоль/л).
После инициации кислородотерапии отмечалась некоторая положительная динамика: рН — 7,358, нарастание рО2 до 78,8 мм рт. ст., уменьшение рСО2 до 54,7 мм рт. ст., сНСО3 — 27,8 ммоль/л, ВЕ — 4,8 ммоль/л, sO2 — 91,7%.
В клиническом анализе крови уровень гемоглобина увеличен до 155 г/л, гематокрит — 43,2%, эритроциты — 5,41×1012/л.
По данным рентгенографии органов грудной клетки, изменения легочной ткани отсутствовали, тень средостения была расширена за счет тимуса. Нейросонография не выявила структурных изменений головного мозга. Эхокардиографическое исследование подтвердило наличие гемодинамически незначимого ДМЖП (2–3 мм) в мышечном слое. При УЗИ почек визуализировано умеренное двустороннее расширение чашечно-лоханочной системы.
При динамическом наблюдении отчетливо прослеживалось снижение сатурации без дополнительной дотации кислорода. Во время кормления ребенок быстро засыпал, появлялся периферический цианоз. Признаков респираторной активации для компенсации дыхательной недостаточности в виде увеличения частоты дыхания, участия вспомогательной мускулатуры в акте дыхания с втяжением уступчивых мест грудной клетки не отмечалось.
Через сутки состояние ребенка ухудшилось до тяжелого за счет появления центрального цианоза, усиления кислородозависимости (десатурация до 60% без дотации кислорода, угнетение сознания). Аускультативно в верхних отделах обоих легких дыхание ослаблено. Нарастающие признаки дыхательной недостаточности на фоне гиповентиляции потребовали перевода ребенка в отделение реанимации и начала ИВЛ. В этот момент отмечено выраженное усугубление изменений КОС в виде декомпенсации респираторного ацидоза с высочайшими показателями гиперкапнии: рН — 7,057, рСО2 – 156 мм рт. ст., рО2 — 73,3 мм рт. ст., сНСО3 – 28,9 ммоль/л, sBE — 11,5 ммоль/л. Вскоре после перевода в отделение реанимации мальчик фебрильно залихорадил, затем присоединились явления ринита. Методом ПЦР в отделяемом полости носа обнаружена РНК риновируса.
После купирования симптомов ОРВИ попытки экстубации на фоне применения дыхательных аналептиков дважды приводили к повторному развитию выраженных гиповентиляционных нарушений. В возрасте 3 мес. для дальнейшего обследования и лечения ребенок был переведен в Научно-практический центр специализированной медицинской помощи детям им. В.Ф. Войно-Ясенецкого.
В Центре молекулярной генетики проведено генетическое исследование. Выявлено увеличенное число копий GCA-повторов (20/25) в гене PHOX2B, что подтвердило диагноз синдрома врожденной центральной гиповентиляции.
Через 1 мес. в отделение реанимации и интенсивной терапии ДГКБ св. Владимира был госпитализирован сибс пациента с идентичной клинической картиной. Позже у него также диагностирован CCHS.
Обсуждение
Особенностью представленного наблюдения является поздняя диагностика заболевания у грудного ребенка из двойни с последующим выявлением CCHS у сибса, что позволяет говорить о семейном случае патологии, оставляя на настоящий момент открытыми вопросы о возможном наследовании синдрома или возникновении мутации гена de novo.
По данным литературы, большинство пациентов с CCHS — доношенные дети. Обычно в анамнезе отсутствуют указания на патологическое течение беременности. Заболевание манифестирует в периоде новорожденности: отмечается цианоз, преимущественно во время сна, появляются признаки гиповентиляции и гипоксемии. Изменения подтверждаются снижением сатурации кислорода, повышением pCO2 в крови. Несмотря на гипоксемию и гиперкапнию, отсутствуют признаки респираторного дистресса и компенсаторных реакций, характерных для дыхательной недостаточности другого генеза. Одновременно могут присутствовать признаки болезни Гиршпрунга (около 20% больных), неврологические симптомы. Описаны случаи поздней диагностики синдрома, манифестировавшего у грудных детей с эпизодами цианоза, судорожным синдромом, нарушения дыхания после анестезии, седативных препаратов [1].
Ретроспективно можно говорить о манифестации синдрома у нашего пациента в неонатальном периоде. Ранними признаками нарушения автономной регуляции дыхания были длительная зависимость от кислорода, необычная для такой степени недоношенности необходимость использования дыхательных аналептиков. В таблице 1 представлены клинические проявления CCHS [4]. Дисфункция моторики пищевода в виде периодического поперхивания была также симптомом болезни в описываемом нами случае. 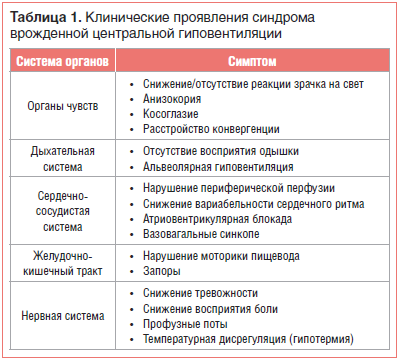
В литературе описаны характерные для пациентов с CCHS лицевые дисморфизмы: уплощенное короткое лицо, изгиб наружной части каймы верхней губы, лицо в форме «коробки», выступающий кончик носа, уменьшенная верхняя часть лица.
При поступлении ребенка в наше отделение поводом для дифференциально-диагностического поиска послужили изменения КОС в виде полностью компенсированного респираторного ацидоза, свидетельствовавшего о полной буферной (снижение количества ионов хлора) и почечной (усиление реабсорбции ионов бикарбоната) компенсации этого нарушения, показателем чего является pH крови. Дотация кислорода в первые сутки госпитализации улучшила показатели КОС. Хронический характер гиповентиляционного синдрома подтверждался изменениями в клиническом анализе крови — повышением уровня гемоглобина, эритроцитов, компенсирующими хроническую гипоксемию.
Гиповентиляция может быть обусловлена нарушением механики дыхания в связи с особенностями строения верхних и нижних дыхательных путей. Однако у пациента отсутствовали клинические проявления обструктивных респираторных нарушений — не отмечалось патологических шумов при дыхании, отсутствовала одышка. Челюстно-лицевой хирург исключил клиническую значимость микроретрогении. При проведении бронхоскопии патологии строения бронхиального дерева выявлено не было. Степень гиперплазии вилочковой железы была умеренной и не могла быть причиной дыхательных расстройств у ребенка. Хронические изменения легочной паренхимы по данным рентгенографии у ребенка также отсутствовали. Диффузионные нарушения проницаемости легочных мембран исключались возможностью повышения сатурации крови на фоне дополнительной оксигенации.
Отсутствие вовлечения дыхательной мускулатуры в качестве компенсаторного механизма было поводом для исключения спинальной мышечной атрофии. Однако нейромышечные заболевания в периоде новорожденности в первую очередь проявляются мышечной гипотонией, синдромом «вялого ребенка» и постепенно прогрессируют. В нашем случае нарушения мышечного тонуса не отмечались.
Взятые вместе данные анамнеза, осмотра, лабораторного и инструментального обследования, не выявившего структурных нарушений головного мозга и, в частности, его ствола как причины органической центральной гиповентиляции, требовали исключения у ребенка ССНS.
Американским торакальным сообществом разработаны следующие критерии диагностики ССНS [2]:
адекватная вентиляция во время бодрствования, гиповентиляция с нормальной частотой дыхания и поверхностное дыхание (сниженный дыхательный объем) во время сна либо во время сна и бодрствования;
отсутствие или ослабление реакции на гиперкапнию/гипоксемию во время бодрствования и сна;
отсутствие нервно-мышечных, легочных, кардиологических заболеваний, а также поражения ствола головного мозга;
наличие мутации в гене РНОХ2В;
наличие симптомов дисрегуляции автономной НС (снижение реакции зрачка на свет, нарушение моторики пищевода, тяжелые запоры даже при отсутствии болезни Гиршпрунга, профузное потоотделение, понижение базальной температуры тела, снижение восприятия тревоги и др.).
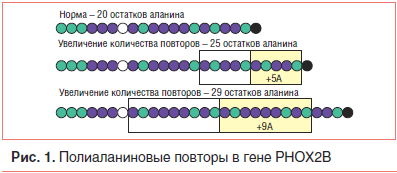
Наиболее частой мутацией, вызывающей врожденный центральный гиповентиляционный синдром, является экспансия полиаланинового тракта в гене РНОХ2В (Paired-like homeobox 2B) хромосомы 4р12 (polyalanine repeat mutation, PARM). В норме у здоровых людей в этом локусе 4-й пары хромосом располагаются по 20 аминокислот, такой генотип обозначается как 20/20 (здоровый). При синдроме врожденной центральной гиповентиляции на данном участке может находиться от 24 до 39 аланиновых повторов, такие генотипы обозначаются как 20/24 и 20/39 соответственно (рис. 1) [8, 10]. 
Выявлена корреляция, отражающая зависимость тяжести вентиляционных нарушений от степени полиаланиновой экспансии, — у пациентов с генотипом до 20/25 нарушение регуляции дыхания отмечается только в состоянии сна, тогда как при генотипах с более длинной экспансией гиповентиляция регистрируется и во время бодрствования [11].
Неполная пенетрантность объясняет возможность носительства мутации, выявленного у некоторых взрослых — родителей пациентов с CCHS.
У нашего больного при генетическом исследовании было выявлено увеличенное число копий GCA-повторов (20/25) в гене PHOX2B, что подтверждает диагноз синдрома врожденной центральной гиповентиляции. Как было указано выше, обычно такое количество повторов ассоциировано с нарушением регуляции дыхания в периоды сна. В нашем случае, с одной стороны, ребенок достаточно долго находился дома и обходился без респираторной поддержки. Вместе с тем гиповентиляция с нормальной частотой дыхания и поверхностное дыхание (сниженный дыхательный объем) и во время сна, и во время бодрствования отмечены у мальчика при наблюдении в отделении при отсутствии типичных эпизодов апноэ. При госпитализации состояние ребенка быстро ухудшилось в течение суток. Триггерным фактором послужила ОРВИ (риновирусная инфекция), на фоне которой в условиях хронической гипоксии развилась декомпенсированная гиповентиляция с необходимостью проведения пролонгированной ИВЛ.
Таким образом, достаточно долгая компенсация респираторного ацидоза, несмотря на присутствие у мальчика и ночной, и дневной гиповентиляции при отсутствии продолжения эпизодов апноэ после выхода ребенка из периода новорожденности в приведенном случае, явилась причиной поздней диагностики синдрома врожденной центральной гиповентиляции.
В США существует общество поддержки пациентов с CCHS «The CCHS Family Network» (https://cchsnetwork.org), целями которого являются просвещение семей и медицинских работников, а также поддержка исследований, связанных с данным заболеванием. При адекватной респираторной поддержке для большинства больных CCHS возможны нормальные качество и продолжительность жизни [10].
Заключение
Представленное наблюдение демонстрирует случай поздней диагностики синдрома врожденной центральной гиповентиляции. Следует помнить о возможности вариабельности клинической картины CCHS.
При рождении ребенка с синдромом CCHS необходимо генетическое консультирование родителей. Это также актуально для расшифровки данного семейного случая синдрома у ребенка из монохориальной диамниотической двойни.
Ранняя диагностика и своевременно начатая респираторная поддержка позволяют избежать хронической гипоксии и обеспечивают адекватное качество жизни пациентам с синдромом врожденной центральной гиповентиляции.
* …Однажды храбрый рыцарь Гульбрандт заблудился в лесу. Приют он нашел в хижине рыбака, где увидел его приемную дочь Ундину и влюбился в нее. Ундина была русалкой, бессмертной дочерью морского владыки. Ради любимого она отказалась от дара бессмертия, согласившись на брак. Перед алтарем жених поклялся ей в верности: ”Дыханье каждого моего утреннего пробуждения будет залогом любви и верности тебе”. Спустя несколько лет, узнав об измене любимого, Ундина сказала: “Ты поклялся мне своим дыханием? Так знай, пока ты бодрствуешь, оно будет при тебе, но как только ты уснешь, дыхание покинет твое тело, и ты умрешь”. С тех пор Гульбрандт мог дышать только, пока помнил об этом…
Источник
