Иммуноглобулины при геморрагической лихорадке с почечным синдромом
Геморрагическая лихорадка с почечным синдромом — зоонозная хантавирусная инфекция, характеризующаяся тромбогеморрагическим синдромом и преимущественным поражением почек. Клинические проявления включают острую лихорадку, геморрагическую сыпь, кровотечения, интерстициальный нефрит, в тяжелых случаях — острую почечную недостаточность. К специфическим лабораторным методам диагностики геморрагической лихорадки с почечным синдромом принадлежат РИФ, ИФА, РИА, ПЦР. Лечение заключается во введении специфического иммуноглобулина, препаратов интерферона, проведении дезинтоксикационной и симптоматической терапии, гемодиализа.
Общие сведения
Геморрагическая лихорадка с почечным синдромом (ГЛПС) — природно-очаговое вирусное заболевание, характерными признаками которого являются лихорадка, интоксикация, повышенная кровоточивость и поражение почек (нефрозонефрит). На территории нашей страны эндемичными районами являются Дальний Восток, Восточная Сибирь, Забайкалье, Казахстан, европейская территория, поэтому ГЛПС известна под различными названиями: корейская, дальневосточная, уральская, ярославская, тульская, закарпатская геморрагическая лихорадка и др. Ежегодно в России регистрируется от 5 до 20 тыс. случаев заболеваний геморрагической лихорадкой с почечным синдромом. Пик заболеваемости ГЛПС приходится на июнь-октябрь; основной контингент заболевших (70-90%) составляют мужчины в возрасте 16-50 лет.

Геморрагическая лихорадка с почечным синдромом
Причины ГЛПС
Возбудителями болезни являются РНК-содержащие вирусные агенты рода Hantavirus (хантавирусы), относящиеся к семейству Bunyaviridae. Для человека патогенны 4 серотипа хантавирусов: Hantaan, Dubrava, Puumala, Seoul. Во внешней среде вирусы относительно долго сохраняют стабильность при отрицательной температуре и малоустойчивы при температуре 37°C. Вирусы имеют сферическую или спиральную форму, диаметр 80-120 нм; содержат одноцепочечную РНК. Хантавирусы обладают тропностью к моноцитам, клеткам почек, легких, печени, слюнных желез и размножаются в цитоплазме инфицированных клеток.
Переносчиками возбудителей геморрагической лихорадки с почечным синдромом служат грызуны: полевые и лесные мыши, полевки, домовые крысы, которые инфицируются друг от друга через укусы клещей и блох. Грызуны переносят инфекцию в форме латентного вирусоносительства, выделяя возбудителей во внешнюю среду со слюной, фекалиями и мочой. Попадание инфицированного выделениями грызунов материала в организм человека может происходить аспирационным (при вдыхании), контактным (при попадании на кожу) или алиментарным (при употреблении пищи) путем. К группе повышенного риска по заболеваемости геморрагической лихорадкой с почечным синдромом относятся сельскохозяйственные и промышленные рабочие, трактористы, водители, активно контактирующие с объектами внешней среды. Заболеваемость человека напрямую зависит от численности инфицированных грызунов на данной территории. ГЛПС регистрируется преимущественно в виде спорадических случаев; реже – в виде локальных эпидемических вспышек. После перенесенной инфекции остается стойкий пожизненный иммунитет; случаи повторной заболеваемости единичны.
Патогенетическую сущность геморрагической лихорадки с почечным синдромом составляют некротизирующий панваскулит, ДВС-синдром и острая почечная недостаточность. После заражения первичная репликация вируса происходит в эндотелии сосудов и эпителиальных клетках внутренних органов. Вслед за накоплением вирусов наступает вирусемия и генерализация инфекции, которые клинически проявляются общетоксическими симптомами. В патогенезе геморрагической лихорадки с почечным синдромом большую роль играют образующиеся аутоантитела, аутоантигены, ЦИК, оказывающие капилляротоксическое действие, вызывающие повреждение стенок сосудов, нарушение свертываемости крови, развитие тромбогеморрагического синдрома с повреждением почек и других паренхиматозных органов (печени, поджелудочной железы, надпочечников, миокарда), ЦНС. Почечный синдром характеризуется массивной протеинурией, олигоанурией, азотемией, нарушением КОС.
Симптомы ГЛПС
Геморрагическая лихорадка с почечным синдромом характеризуется циклическим течением с последовательной сменой нескольких периодов:
- инкубационного (от 2-5 дней до 50 суток — в среднем 2-3 недели)
- продромального (2-3 дня)
- лихорадочного (3-6 дней)
- олигоурического (с 3-6-го по 8-14-й день ГЛПС)
- полиурического (с 9-13 дня ГЛПС)
- реконвалесцентного (раннего – от 3-х недель до 2 месяцев, позднего — до 2-3-х лет).
В зависимости от выраженности симптомов, тяжести инфекционно-токсического, геморрагического и почечного синдромов различают типичные, стертые и субклинические варианты; легкие, среднетяжелые и тяжелые формы геморрагической лихорадки с почечным синдромом.
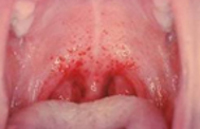
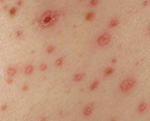
По истечении инкубационного периода наступает короткий продромальный период, во время которого отмечаются утомляемость, недомогание, головные боли, миалгии, субфебрилитет. Лихорадочный период развивается остро, с повышения температуры тела до 39-41°С, озноба и общетоксических симптомов (слабости, головной боли, тошноты, рвоты, расстройства сна, артралгии, ломоты в теле). Характерны боли в глазных яблоках, затуманенное зрение, мелькание «мушек», видение предметов в красном цвете. В разгар лихорадочного периода появляются геморрагические высыпания на слизистых оболочках полости рта, коже грудной клетки, подмышечных областей, шеи. При объективном осмотре выявляется гиперемия и одутловатость лица, инъекция сосудов конъюнктив и склер, брадикардия и артериальная гипотония вплоть до коллапса.
В олигоурический период геморрагической лихорадки с почечным синдромом температура тела снижается до нормы или субфебрильных цифр, однако это не приводит к улучшению состояния пациента. В эту стадию еще более усиливаются симптомы интоксикации и возникают признаки поражения почек: нарастают боли в пояснице, резко снижается диурез, развивается артериальная гипертензия. В моче выявляется гематурия, протеинурия, цилиндрурия. При нарастании азотемии развивается ОПН; в тяжелых случаях — уремическая кома. У большинства больных отмечается неукротимая рвота и диарея. Геморрагический синдром может быть выражен в различной степени и включать в себя макрогематурию, кровотечения из мест инъекций, носовые, маточные, желудочно-кишечные кровотечения. В олигоурический период могут развиваться тяжелые осложнения (кровоизлияния в головной мозг, гипофиз, надпочечники), служащие причиной летального исхода.
Переход геморрагической лихорадки с почечным синдромом в полиурическую стадию знаменуется субъективными и объективными улучшениями: нормализацией сна и аппетита, прекращением рвоты, исчезновением боле в пояснице и т. д. Характерными признаками данного периода служит увеличение суточного диуреза до 3-5 л и изогипостенурия. В период полиурии сохраняется сухость во рту и жажда.
Период реконвалесценции при геморрагической лихорадке с почечным синдромом может затягиваться на несколько месяцев и даже лет. У больных долго сохраняется постинфекционная астения, характеризующаяся общей слабостью, снижением работоспособности, быстрой утомляемостью, эмоциональной лабильностью. Синдром вегетативной дистонии выражается гипотонией, инсомнией, одышкой при минимальной нагрузке, повышенной потливостью.
Специфическими осложнениями тяжелых клинических вариантов ГЛПС могут являться инфекционно-токсический шок, кровоизлияния в паренхиматозные органы, отек легких и головного мозга, кровотечения, миокардит, менингоэнцефалит, уремия и др. При присоединении бактериальной инфекции возможно развитие пневмонии, пиелонефрита, гнойных отитов, абсцессов, флегмон, сепсиса.
Диагностика ГЛПС
Клиническая диагностика ГЛПС основывается на цикличности течения инфекции и характерной смене периодов. При сборе эпидемиологического анамнеза обращается внимание на пребывание пациента в эндемичной местности, возможный прямой или косвенный контакт с грызунами. При проведении неспецифического обследования учитывается динамика изменения показателей общего и биохимического анализа мочи, электролитов, биохимических проб крови, КОС, коагулограммы и др. С целью оценки тяжести течения и прогноза заболевания выполняется УЗИ почек, ФГДС, рентгенография органов грудной клетки, ЭКГ и др.
Специфическая лабораторная диагностика геморрагической лихорадки с почечным синдромом проводится с помощью серологических методов (ИФА, РНИФ, РИА) в динамике. Антитела в сыворотке крови появляются в конце 1-ой недели болезни, к концу 2-й недели достигают максимальной концентрации и сохраняются в крови 5–7 лет. РНК вируса может быть выделена с помощью ПЦР-исследования. ГЛПС дифференцируют с лептоспирозом, острым гломерулонефритом, пиелонефритом и энтеровирусной инфекцией, прочими геморрагическими лихорадками.
Лечение ГЛПС
Больные геморрагической лихорадкой с почечным синдромом госпитализируются в инфекционный стационар. Им назначается строгий постельный режим и диета №4; проводится контроль водного баланса, гемодинамики, показателей функционирования сердечно-сосудистой системы и почек. Этиотропная терапия геморрагической лихорадки с почечным синдромом наиболее эффективна в первые 3-5 суток от начала заболевания и включает введение донорского специфического иммуноглобулина против ГЛПС, назначение препаратов интерферона, противовирусных химиопрепаратов (рибавирина).
В лихорадочном периоде проводится инфузионная дезинтоксикационная терапия (внутривенные вливания глюкозы и солевых растворов); профилактика ДВС-синдрома (введение препаратов-дезагрегантов и ангиопротекторов); в тяжелых случаях применяются глюкокортикостероиды. В олигурическом периоде осуществляется стимуляция диуреза (введение ударных доз фуросемида), коррекция ацидоза и гиперкалиемии, профилактика кровотечений. При нарастающей ОПН показано переведение пациента на экстракорпоральный гемодиализ. При наличии бактериальных осложнений назначается антибиотикотерапия. В полиурическую стадию основной задачей является проведение оральной и парентеральной регидратации. В период реконвалесценции проводится общеукрепляющая и метаболическая терапия; рекомендуется полноценное питание, физиотерапия (диатермия, электрофорез), массаж и ЛФК.
Прогноз и профилактика ГЛПС
Легкие и среднетяжелые формы геморрагической лихорадки с почечным синдромом в большинстве случаев заканчиваются выздоровлением. Резидуальные явления (постинфекционная астения, боли в пояснице, кардиомиопатия, моно- и полиневриты) длительно наблюдаются у половины переболевших. Реконвалесценты нуждаются в ежеквартальном диспансерном наблюдении инфекциониста, нефролога и окулиста на протяжении года. Тяжелое течение сопряжено с высоким риском осложнений; смертность от ГЛПС колеблется в пределах 7-10%.
Профилактика геморрагической лихорадки с почечным синдромом заключается в уничтожении мышевидных грызунов в природных очагах инфекции, предупреждении загрязнения жилищ, водоисточников и продуктов питания выделениями грызунов, дератизации жилых и производственных помещений. Специфической вакцинации против ГЛПС не разработано.
Источник
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое вирусное природно- очаговое инфекционное заболевание с нетрансмиссивным механизмом передачи, регистрируемое на территории России в основном в умеренных широтах европейской части и на Дальнем Востоке. Возбудители ГЛПС – вирусы Пуумала, Добрава, Хантаан, Сеул и Амур – относятся к роду Hantavirus, семейства Bunyaviridae. Вирус Пуумала в основном приурочен к лесным ландшафтам европейской части России, наибольшее число случаев ГЛПС регистрируется в Среднем Поволжье и Приуралье (Республика Башкирия, Челябинская, Оренбургская области). Вирус Добрава в последнем десятилетии XX века и в 2000-е годы регистрируется на территории центральных областей России: Рязанской, Тульской, Воронежской, Липецкой, Тамбовской, Курской, а также в Краснодарском крае – в районе Большого Сочи. В европейской части России заболеваемость регистрируется с марта, нарастает в мае-августе, пик приходится на сентябрь-ноябрь, спад – на декабрь-январь. В очагах вируса Добрава выражена осеннее-зимняя сезонность. Очаги вирусов Хантаан, Сеул и Амур находятся в дальневосточных регионах России. Для вируса Амур характерна весенне-летняя или осенне-зимняя сезонность; для вируса Сеул – весенняя, для вируса Хантаан – осенне-зимняя. Источником заражения ГЛПС являются дикие грызуны, механизм передачи вируса – аэрозольный (воздушно-капельный и воздушно-пылевой). Возможен и алиментарный путь заражения через загрязненные продукты питания и воду. Заражение вирусом Пуумала наиболее часто происходит при посещении леса, во время рыбной ловли, при работе на садовом участке, заражение вирусом Добрава – при уходе за домашними сельскохозяйственными животными, работе с фуражом, сеном. Таким образом в очагах вируса Пуумала 6080% заболевших – городские жители, в очагах ГЛПС, вызываемых хантавирусами Добрава, Амур и Хантаан, среди больных преобладают сельские жители. Иммунитет у переболевших сохраняется пожизненно, повторные случаи заболевания ГЛПС, как правило, исключены.
Клиника ГЛПС характеризуется острым началом, цикличностью течения: выделяют начальный период, длящийся 1-3 дня, олигурический период – 4-11-й дни болезни, полиурический период – 12-30-й дни болезни, период реконвалесценции – с 20-30-го дня болезни. Начальный период характеризуется повышением температуры тела, головной болью, миалгиями и артралгиями, жаждой. Могут появиться абдоминальные боли, тошнота, рвота. Часто развивается гиперемия кожи лица, верхней половины туловища, отмечается инъекция сосудов склер. На 3-4-й дни болезни может начаться развитие олигурического периода, характеризующегося уменьшением суточного диуреза, вплоть до анурии и развития острой почечной недостаточности. Геморрагический синдром может проявляться в виде геморрагической сыпи на коже, кровоизлияниях под кожу, носовыми и желудочно-кишечными кровотечениями, гематурией, кровоизлияниями во внутренние органы, субсклеральные гематомы. Могут развиться отек легких и головного мозга, инфекционно-токсический шок. Переход к полиурии связан с улучшением общего состояния больных, в период реконвалесценции при нормализации диуреза в основном сохраняется только астенический синдром. Наряду с тяжелыми и среднетяжелыми формами ГЛПС регистрируются также легкие и стертые формы.
Дифференциальная диагностика
Инфекционные заболевания: лептоспироз, менингококковая инфекция, инфекционный мононуклеоз, клещевой энцефалит и боррелиоз, острые кишечные инфекции;
соматические заболевания: пиелонефрит, панкреатит, почечная колика, заболевания крови, отравления.
Показания к обследованию Лихорадка с общеинтоксикационным синдромом, возникшая у лиц, в последние 1,5 месяца находившихся на территории, эндемичной по ГЛПС, особенно при наличии симптомов: сухость во рту, жажда, нарушение зрения, геморрагические проявления.
Материал для исследований
- Плазма крови – обнаружение РНК вируса;
- сыворотка крови – определение АТ;
- цельная кровь – изоляция вируса.
Этиологическая лабораторная диагностика включает обнаружение специфических АТ IgM и IgG или суммарных АТ к АГ вируса; обнаружение РНК вируса в крови; изоляцию вируса.
Сравнительная характеристика методов лабораторной диагностики
Диагностическая чувствительность выявления РНК вируса методом ПЦР в крови пациентов, взятой на первой неделе заболевания, составляет 85–100%, на второй неделе заболевания – около 40%. При использовании метода ИФА АТ IgM можно определить начиная с 1-го по 7-й, АТ Ig G – со 2-го по 9-й дни болезни, уровень достигает максимальных значений к 8-25-му дню и через 18-22 дня, соответственно. При определении АТ методом ИФА для лабораторного подтверждения ГЛПС необходимо исследовать образцы крови, взятые с интервалом в одну неделю. При использовании метода непрямого МФА (нРИФ) АТ можно определить со 2-3-го дня болезни, к концу второй недели заболевания их уровень достигает пиковых значений. Для подтверждения диагноза ГЛПС с использованием метода МФА также исследуют образцы крови, взятые в динамике: первый – на 2-4-й день болезни, второй – через 2-3 дня; полученные образцы необходимо исследовать одновременно для выявления диагностически значимого нарастания титров АТ к хантавирусам.
Особенности интерпретации результатов лабораторных исследований
Клинический диагноз ГЛПС считают подтвержденным при выделении инфекционного агента, идентифицированного как патогенный для человека вид хантавируса; при выявлении методом ИФА АТ IgM и роста титров IgG в образцах крови, взятых в динамике; при выявлении методом непрямого МФА (РИФ) нарастания титров АТ в образцах крови, взятых в динамике. Обнаружение РНК хантавирусов в крови пациента является основанием для предварительной постановки диагноза.
Источник
