Гормоны стресс и адаптационный синдром

Оглавление темы «Гормоны почек. Гормоны сердца. Гормоны сосудов. Гормоны при стрессе. Выделение гормонов при повреждении тканей.»: Стресс. Гормоны при стрессе. Общий адаптационный синдром. Гормональное обеспечение общего адаптационного синдрома, или стресса.Примером неспецифического участия эндокринной системы в приспособительных реакциях организма являются изменения ее деятельности при стрессе. Состояние стресса возникает как следствие действия на организм любых сильных, в том числе экстремальных и повреждающих, раздражителей. При действии на организм экстремальных факторов неспецифические реакции стресса прежде всего направлены на стимуляцию энергетического обеспечения приспособительных процессов. Ведущую роль в этих неспецифических реакциях играют катехоламины и глюкокортикоиды, в значительных количествах мобилизуемые в кровь (рис. 6.30). Активируя катабо-лические процессы, эти гормоны ведут к гипергликемии — одной из начальных реакций субстратного энергообеспечения. Как следствие гипергликемии на некоторое время повышается в крови уровень инсулина. Метаболические перестройки при таком гипергормональном профиле связаны, прежде всего, с активацией в печени фосфорилазы и гликогенолизом, а поступающая в кровь глюкоза под влиянием инсулина интенсивно утилизируется тканями, прежде всего скелетными мышцами, что увеличивает их работоспособность и повышает теплообразование в организме. Жиромобили-зующий эффект глюкокор-тикоидов и катехоламинов способствует повышению в крови второго важнейшего энергетического субстрата — свободных жирных кислот. Однако подобный «форсированный» режим функционирования эндокринной системы из-за ограниченности функциональных резервов не может длиться долго, вскоре содержание инсулина в крови уменьшается, что носит название «функциональный транзиторный диабет». Это необходимое условие для усиления жиромобилизующего эффекта глюкокортикоидов и активации глюконеогенеза. Важнейшим источником глюкозы как энергетического материала в этот период становится глюко-неогенез, но на образование глюкозы расходуется дефицитный пластический материал — аминокислоты. Необходимым условием длительно повышенного энергоснабжения является переключение энергетического обмена с углеводного типа на липидный, тем более что углеводные резервы в виде гликогена достаточно быстро оказываются практически исчерпанными. Постепенно снижается продукция глюкокортикоидов, устанавливается новое гормональное соотношение: нерезко повышенный уровень глюкокортикоидов при более значительном снижении уровня инсулина. Этот новый уровень функционирования эндокринной системы способствует восстановлению равновесия между катаболическими и анаболическими процессами, расходы белка на энергетические нужды снижаются. Жиромобилизующий эффект гормональной перестройки и образование транспортной формы эндогенного жира — липопротеинов очень низкой плотности — приводят к тому, что растет использование клетками липидов как источников энергии. Жирные кислоты интенсивно окисляются в скелетных мышцах, миокарде и печени. Образующиеся при этом кетоновые тела усиленно окисляются в мышечной ткани, почках, а также сердце и мозге. Особенно резко ограничивается потребление углеводов мышечной и жировой тканью, что экономит глюкозу для углеводзависимых тканей — головного мозга, кроветворной ткани и эритроцитов, в некоторой степени — миокарда. Таким образом, происходящие при стрессе гормональные и метаболические перестройки обеспечивают длительное неспецифическое повышение энергообеспечения приспособительных процессов.
Стресс как неспецифическая реакция приспособления и компенсации нарушенных функций может при резкой выраженности сопровождаться и активацией гипоталамо-гипофизарно-тиреоидной системы, приводя к росту в крови уровня тиреоидных гормонов. Физиологический стресс, например эмоциональное напряжение, напротив, характеризуется снижением гормональной активности щитовидной железы. Гиперфункция щитовидной железы в ответ на повреждение тканей является неспецифической реакцией компенсации, поскольку тиреоидные гормоны, благодаря стимуляции синтеза белков, способствуют клеточным регенеративным процессам и репарации поврежденных структур. Активация гипоталамо-гипофизарно-тиреоидной системы может носить и черты специфической компенсации, например в условиях холодового стресса, как компенсация термического угнетения метаболизма. Стресс при экстремальных состояниях сопровождается активацией и других гормональных систем — гипоталамо-гипофизарно-андрогенной и гипоталамо-нейрогипофизарной. Повышение активности системы гонадолиберины—гонадотропины—андрогены (одним из проявлений является повышение либидо) и избыточно секретируемые при этом андрогены за счет анаболического эффекта способствуют репаратив-ным процессам. При хирургическом и эмоциональном стрессе повышается секреция вазопрессина. Компенсаторное значение активации секреции вазопрессина заключается в облегчении консолидации процессов памяти, формирования аналгезии, потенцировании эффектов кортиколиберина на секрецию кор-тикотропина, восстановлении нарушенной при кровопотере гемодинамики. Избыточная секреция вазопрессина при травмах является примером опережающей перестройки эндокринных механизмов компенсации, реализующей избыточный гормональный сигнал для предотвращения возможности потери организмом воды при кровотечении. Реакция гипоталамо-нейрогипофизарной системы может быть и специфической компенсацией возникших в организме нарушений водно-солевого и осмотического гомеостазиса (осмотический стресс). — Также рекомендуем «Выделение гормонов при повреждении тканей. Регенерация. Репарации. Гормональная регуляция местных компенсаторных реакций.» |
Источник
Стресс — совокупность всех неспецифических изменений, возникающих в организме под влиянием любых воздействий и включающих, в частности стереотипный комплекс неспецифических защитно-приспособительных реакций (Селье, 1936-1952). Агент, вызывающий стресс, называют стрессором. По существу, стрессором является всякое достаточное сильное (не обязательно экстремальное) воздействие — тепло, холод, эмоциональное воздействие, болевые раздражения, голодание, интоксикация и т.д.
Комплекс неспецифических защитно-приспособительных реакций при стрессе, направленных на создание устойчивости (резистентности) организма к лкюому фактору, обозначается Селье как общий (генерализованный) адаптационный синдром (ГАС), в динамике которого закономерно прослеживаются три стадии, характеризующие резистентность организма в развитии стресса: 1) реакция тревоги: 2) стадия резистентности, 3) стадия истощения (рис. 87).
Адаптационному синдрому предшествует шок. Длительность и выраженность каждой стадии может варьироваться в зависимости от природы и силы стрессорного агента, вида животного и физиологического состояния организма.

Рис 87. Динамика изменения резистентности организма при стрессе (генерализованный адаптационный синдром, ГАС)
Первая стадия синдрома (реакция тревоги) характеризует остро протекающую, активную мобилизацию адаптационных процессов в организме в ответ на всякое смещение гомеостаза при стрессе (на первичный шок). В это время устойчивость организма к воздействиям быстро возрастает. Во второй стадии (стадии резистентности) устанавливается повышенная сопротивляемость к стрессору, которая носит общий, неспецифический характер.
Например, если стресс вызывается холодом, то на стадии резистентности выявляется повышенная устойчивость не только к холоду, но и к действию повышенной температуры, рентгеновских лучей, токсинов и т.д. В случаях когда стресс слишком сильный или длительный, защитно-приспособительные механизмы организма могут истощаться и общий адаптационный синдром переходит в третью стадию (стадию истощения), характеризующуюся снижением резистентности организма к данному стрессору и другим видам стрессорных воздействий. Эта стадия называется также вторичным шоком.
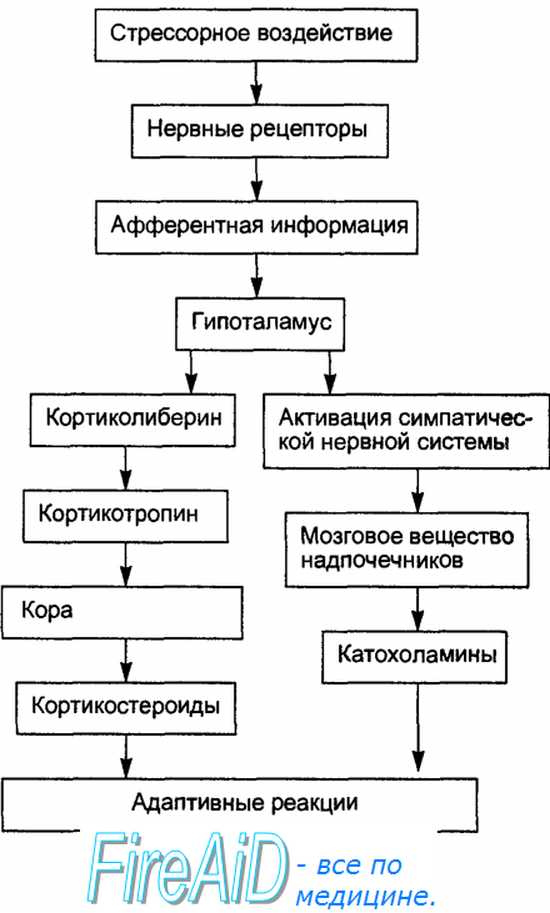
Многочисленные исследования Селье и других авторов показали, что одним из важнейших организаторов реализации общего адаптационного синдрома в организме позвоночных при различных формах стресса является гипоталамо-гипофизарно-надпочечниковая система (рис. 88, 89). Так, при любых воздействиях на организм всегда отмечается быстрое нарастание секреции глюкокортикоидов корой надпочечников, прямо пропорциональное в определенных интервалах силе воздействия. Нарастанию секреции глюкокортикоидов постоянно предшествует усиление секреции КРФ гипоталамусом и АКТГ гипофизом. Активация гипоталамо-гипофизарно-адреналовой системы происходит на стадии тревоги.

Рис 88. Важнейшие гормоны, участвующие в регуляции общего адаптационного синдрома

Рис 89. Концентрация кортикостерона в плазме крови у животных при стрессе
А — в плазме крови самцов крыс при иммобилизации животных в течение 10 мин; Б — в плазме крови самцов мышей при ссаживании в одну клетку шести животных, которые до этого времени содержались поодиночке (стресс формирования сообщества): 1, 2 — стресс интактных животных, 3 — стресс животных, десимпатизированных введением 6-оксидофамина
Гипофизэктомия или разрушение области срединного возвышения гипоталамуса снимает реакцию адреналовой коры на стресс. Эти воздействия, а также адреналэктомия (на фоне введения доз кортикостероидов, поддерживающих жизнь животного в состоянии покоя) предотвращают развитие общего адаптационного синдрома, и, как правило, резко снижают резистентность организма к действию разных стрессоров. И, наоборот, введение природных или синтетических глюкокортикоидных гормонов стрессируемым животным может повышать уровень адаптации к различным воздействиям.
Эти данные позволили применять кортикостероидные препараты в клинической практике при сильных травмах или при длительных хирургических операциях для предупреждения развития вторичного шока (Глинн, 1969). Показано также, что многие патологические процессы разворачиваются на фоне истощения функциональных резервов гипоталамо-гипофизарно-адреналовой системы.
Накоплено много данных о путях и механизмах действия глюкокортикоидных гормонов на организм. Во избежание ненужных повторений мы кратко резюмируем основные данные F и его аналоги вызывают лизис тимико-лимфоидной ткани и острый выброс антител из разрушающихся лимфоидных клеток, но соответственно тормозят новообразование иммунных тел; вызывают также торможение синтеза белка в различных видах соединительной ткани, слизистых оболочках и мышцах; стимулируют синтез общего белка и ряда ферментов обмена аминокислот и глюконеогенеза в печени, усиливая в этом органе синтез глюкозы и ее секрецию в кровь; тормозят синтез ДНК во всех тканях, ингибируют транспорт глюкозы и ее утилизацию в мышцах и жировой ткани; стимулируют липолиз и обусловливают гиперлипацидемию, пермиссируют эффекты адреналина, глюкагона, ЛТГ и некоторых других гормонов на различные органы и ткани; вызывают повышение возбудимости коры и ряда подкорковых структур головного мозга; в определенных дозах снижают проницаемость кровеносных сосудов, тормозят воспаление и развитие аллергических реакций; усиливают задержку Na+ в крови и экскрецию К+, тормозят половую функцию.
Отметим, что при стрессорной активизации системы гипоталамус — гипофиз наряду с усиленным образованием АКТГ и глюкокортикоидов происходит усиленное образование опиоидов, липотропина и МСГ из ПОМК. Опиоиды и МСГ способны оказывать прямые влияния на мозг, вызывая возбуждение и обезболивание, а также на симпатическую нервную систему. АКТГ, липотропины и МСГ обладают жиромобилизующим действием.
Указанные гормоны существенно дополняют эффекты глюкокортикоидов. Однако анализ всех адаптивных влияний глюкокортикоидов и других гормонов данной системы не позволяет составить достаточно убедительную концепцию о сущности самодовлеющего адаптивного действия гормонов коры надпочечников (Селье, 1977). Несомненно, индуцируемые гормонами острый выброс готовых антител лимфоцитами, переключение пластических процессов на энергетические, гипергликемия и гиперлипацидемия, пермиссивные и другие эффекты могут играть защитно-приспособительную роль на определенных этапах развития стресса.
Однако физиологический смысл различных влияний глюкокортикоидов на ткани при стрессе теряется, если их рассматривать изолированно от эффектов других гормонов и нервных механизмов, также участвующих в регуляции неспецифических адаптивных реакций организма. Действительно, трудно представить самостоятельное адаптационное значение торможения кортикостероидами синтеза антител, формирования воспалительных реакций, потребления глюкозы мышцами — процессов, имеющих огромное значение для поддержания гомеостаза.
Очевидно, анализ адаптивного синдрома и механизмов адаптивного действия глюкокортикоидов рационально проводить не изолированно, а в связи и в сопоставлении с динамикой секреции других гормонов и негормональных факторов при стрессе и механизмами их взаимодействия с клетками. Этот вывод вполне согласуется с многочисленными экспериментальными данными, полученными самим Селье и другими эндокринологами (Шёлк, 1969, 1970; Федотов и др., 1972 и др.)
В.Б. Розен
Опубликовал Константин Моканов
Источник
Лекция
1. Определение, понятие, причины и виды стресс-реакции.
2. Характеристика быстрого стресса. Характеристика долговременного стресса, его стадии.
3. Морфологические, биохимические и гематологические изменения при стрессе.
4. Патогенез и патологические формы стресс-реакции.
Стресс — универсальная неспецифическая нейро-гормональная реакция организма на повреждение или сигнал угрозы жизни или благополучия организма, проявляющееся в повышении резистентности организма.
Классификация стрессоров — агентов, вызывающих стресс:
1) все виды агентов, вызывающих такие экстремальные повреждения, как гипоксия, гипотермия, травма, лучевая энергия, отравление — т.е. все экстремальные агенты.
2) сигналы угрозы благополучию жизни организма, вызывающие отрицательные эмоциональные состояния страх, душевный дискомфорт и другие — т.е. все отрицательно эмоциональные агенты.
Классификация видов стресса:
1. в зависимости от причины (стрессора):
а) биологический (физический) стресс, вызываемый экстремальными агентами,
б) эмоциональный стресс, вызываемый отрицательными эмоциями.
2. в зависимости от скорости включения и механизма:
а) срочный (немедленный) стресс — возникает моментально (секунды) — направлен на быстрый выход из опасной ситуации, механизм — возбуждение симпато-адреналовой системы,
б) долговременный стресс — включается позднее (часы), направлен на длительное сопротивление стрессору, в основе механизма — включение в реакцию гормонов гипофиза и коры надпочечников.
Характеристика и патогенез срочного стресса. Срочный стресс — немедленная реакция организма, возникающая в ответ на экстремальные агенты, направленная на кратковременное повышение резистентности, механизм которой связан с активацией симпато-адреналовой системы.
Характеристика: описал Кеннон для вариантов жизни — убежать от опасности или устранить опасность физически (напасть) — это реакция битва-бегство; его суть — быстро предельно усилить мышечную и мозговую деятельность, путем активации систем кровообращения, дыхания.
Адреналин — формирует хаотичный стресс. Норадреналин — формирует срочный стресс через активацию мозговых структур. Однако, срочный стресс не в состоянии обеспечить долговременную адаптацию к стрессору — не хватает симпато-адреналовых ресурсов.
Патогенез срочного стресса:
а) запуск срочного стресса осуществляется через центры гипоталамуса с последующей активацией симпато-адреналовой системы и выбросом катехоламинов: адреналина (мозговая часть надпочечников) и норадреналина (мозговая часть надпочечников и медиатор симпатического возбуждения). Запуская стресс, эти гормоны действуют через усиление кровообращения и метаболизма,
б) механизм гемодинамического обеспечения стресса: тахикардия, увеличение минутного объема сердца, повышение артериального давления, ускорение кровотока, перераспределение крови к мозгу, мышцам, сердцу; усиление свертывания крови; усиление газообмена,
в) механизм метаболического обеспечения стресса:
● образование глюкозы и гликогена под влиянием гормона глюкагона — гипергликемия в мозге, мышцах;
● усиление расщепления жирных кислот с освобождением энергии;
● усиление газообмена, расширение бронхов.
Характеристика и патогенез долговременного стресса — общего адаптационного синдрома (ОАС).
ОАС — это общая неспецифическая нейро-гормональная реакция организма в ответ на действие экстремальных агентов, направлена на долговременное повышение резистентности к ним, механизм которой связан с действием адаптивных гормонов гипофиза и коры надпочечников. Открыл и изучил Ганс Селье.
Стадии ОАС и их характеристика:
● Первая стадия — тревоги (мобилизации), она подразделяется на две фазы: фаза шока и фаза противошока. В фазу шока возникает угроза всем жизненноважным функциям организма, при этом развиваются гипоксия, снижение артериального давления, гипотермия, гипогликемия; а организм оказывается подверженным повреждению и может погибнуть, если не включиться механизм действия адаптивных гормонов.
В фазу противошока начинается активация надпочечников, выброс кортикостероидов, резистентность при этом нарастает и наступает вторая стадия ОАС.
● Вторая стадия (резистентности) — уровень резистентности долгое время держится на высоком уровне, достаточном для сопротивления организма стрессору, и если стрессор прекращает действие, то резистентность возвращается к норме, организм выживает; при этом резистентность повышается неспецифически, т.е. ко всем возможным агентам.
Если стрессор силен и продолжает действовать, то возможно наступление третьей стадии.
● Третья стадия (истощение) характеризуется всеми признаками, характерными для фазы шока, резистентность падает, организм подвержен повреждающему действию стрессоров вплоть до гибели.
Морфологическая триада при стрессе:
а) инволюция тимико-лимфатического аппарата уменьшение в размерах тимуса, лимфоузлов, селезенки,
б) кровоточащие язвы желудочно-кишечного тракта,
в) гипертрофия надпочечников.
Гематологические изменения при стрессе:
а) лимфопения — лизис лимфоцитов и их уход в ткани; распад лимфоцитов обеспечивает выброс из них энергетических и пластических (РНК, ДНК, белок) субстанций, выход лимфоцитов в ткани — обеспечение иммунной защиты,
б) эозинопения — признак защиты, эозинофилы уходят в ткани, обеспечивают там разрушение гистамина и таким образом уменьшают повреждение в тканях,
в) нейтрофильный лейкоцитоз — выброс в циркуляцию из костного мозга имеющегося запаса нейтрофилов — этим обеспечивается неспецифическая защита от бактерий.
Биохимические изменения при стрессе:
а) изменяется общий обмен:
● первая фаза — катаболическая — (распад белков, жиров, углеводов, распад и лизис клеток в очаге повреждения и по всему организму) — при одномоментном действии стрессора продолжается не более 3-х суток,
● вторая фаза — анаболическая — в стадию резистентности: усиливается синтез белка, активизируется пролиферация, замещение погибших клеток на новые,
б) гипергликемия — в результате глюконеогенеза синтез новой глюкозы из белков — действие гормонов коры надпочечников,
в) распад жиров с освобождением энергии и использовании ее в метаболизме, питании клеток;
г) задержка воды и натрия в организме.
Патогенез общего адаптационного синдрома: пусковые факторы: 1) адреналин; 2) кора мозга; 3) хеморецепторы гипофиза → ретикулярная формация → возбуждение центров гипоталамуса и выброс релизинг-факторов → активация передней доли гипофиза и выброс тропных гормонов (АКТГ, СТГ) → усиление секреции гормонов коры надпочечников (глюко- и минералокортикоидов) → повышение резистентности организма опосредованно через действие гормонов на все виды обмена.
Характеристика адаптивных гормонов передней доли гипофиза и коры надпочечников:
а) АКТГ (адренокортикотропный гормон) — пептидный, катаболический; запускает выброс глюко- и минералокортикоидов,
б) глюкокортикоиды — стероидные гормоны (кортикостерон, кортизон, гидрокортизон и другие, их более 10) катаболического действия:
● регулируют белковый и углеводный обмен,
● активизируют глюконеогенез,
● стабилизируют мембраны — уменьшают их проницаемость, предупреждая повреждение клеток,
в) минералкортикоиды (ДОК — дезоксикортикостерон, альдостерон) — стероиды, регулируют водно-солевой обмен — задерживают натрий, выводят калий, задерживают в организме воду.
Влияние на воспаление: глюкокортикоиды — противоспалительные, т.е. снижают воспаление; минералокортикоиды — провоспалительные — усиливают воспаление.
Лечебное применениеадаптивных гормонов (глюкокортикоидов):
а) при патологическом течении воспаления,
б) для борьбы с аллергией, с целью иммунодепрессии,
г) для усиления защиты при экстремальных состояниях.
Формы стресса:
Эустресс — оптимальное протекание ОАС — точное соответствие реакции уровню повреждения.
Дистресс — неблагоприятное течение ОАС, с ним необходимо бороться.
Формы дистресса:
1. эмоциональный дистресс — стрессоры действуют длительно, возникают тяжелые соматические заболевания (гипертоническая болезнь, атеросклероз, ишемическая болезнь сердца, язвенная болезнь желудка и 12-перстной кишки, бронхиальная астма и другие аллергические заболевания, особенно кожи) или неврозы (психосоматические заболевания),
2. дистресс, связанный с патологией гормональных механизмов, имеется три вида этого дистресса:
а) глюкокортикоидная недостаточность: при экстремальных состояниях глюкокортикоидов не хватает особенно в стадию тревоги — возникает их дефицит; при экстремальных состояниях глюкокортикоидов много, но рецепторы к ним на клетках не чувствительны; после длительной терапии глюкокортикоидами синтез собственных глюкокортикоидов снижен; врожденная глюкокортикоидная недостаточность — у детей часто, сопровождается тимико-лимфатическим статусом (status thymicolymphaticus) — увеличены тимус и лимфоузлы.
Глюкокортикоидная недостаточность проявляется в снижении резистентности, в невозможности отвечать реакцией стресс, в снижении функции организма, вплоть до шока.
б) избыточная глюкокортикоидная активность проявляется в виде истощения, снижения резистентности к инфекции, артериальной гипертензии, гипергликемии — сахарный диабет; возникает: при избыточной секреции глюкокортикоидов; при медленном их разрушении; при избыточной чувствительности рецепторов к глюкокортикоидам; при терапии этими гормонами — в период их назначения,
в) избыточная минералокортикоидная активность проявляется в виде активации воспаления (артриты, миокардиты, периартерииты, склерозирование сосудов-нефросклероз, артериальная гипертензия); возникает: в условиях, усугубляющих усиленное действие минералокортикоидов — охлаждение, избыточное потребление хлористого натрия и белков, перенесенные другие заболевания.
Методы определения реакции стресс:
1. Определение содержания гормонов АКТГ, глюко- и минералокортикоидов в крови.
2. Определение продуктов метаболизма гормонов в моче — 17-оксикетостероидов.
3. Исследование динамики веса (особенно у детей) — в стадии тревоги вес падает, в стадию резистентности вес растет.
4. Определение содержания эозинофилов в крови — эозинопения.
5. Проба Торна — введение АКТГ вызывает при нормальном функционировании коры надпочечников падение числа эозинофилов в крови в 2 раза.
6. Определение степени эмоционального стресса по тонусу мышц — чем выше тонус, тем выше степень стресса.
7. Определение содержания катехоламинов.
Источник