Глаукома или синдром сухого глаза

Может ли проактивное выявление ССГ влиять на прогрессирование глаукомы?

Голубев Сергей Юрьевич
К.м.н., врач-офтальмолог, филиал Военно-медицинской академии им С.М. Кирова, представитель TFOS* в России.

Бржеский Владимир Всеволодович
Д. м. н., завведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава Росии
*TFOS: Tear Film & Ocular Surface Society — Международное общество исследователей слезной пленки
Глаукома – группа заболеваний со схожими признаками, включающими поражение головки зрительного нерва и сужение поля зрения.
Причиной глаукомы чаще всего является повышенное внутриглазное давление. Исход глаукомы в отсутствие лечения – прогрессирующее сужение поля зрения и слепота.
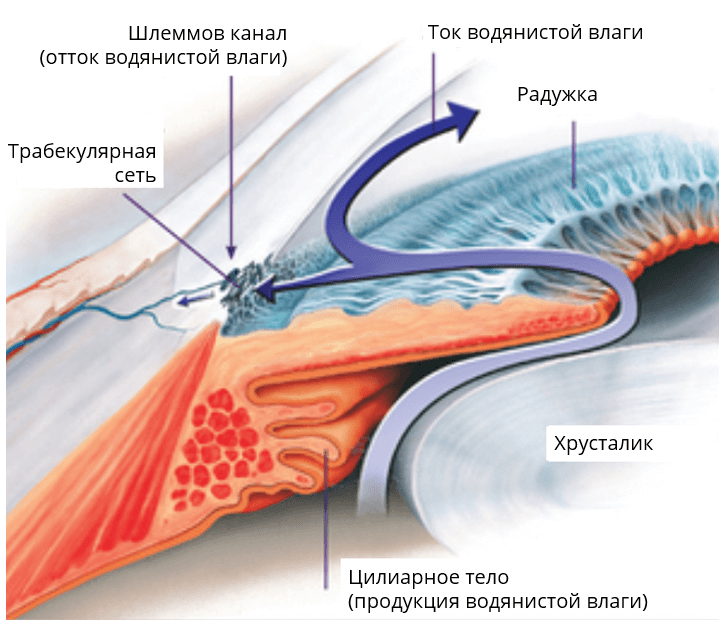
Лечение глаукомы основано на снижении внутриглазного давления для профилактики или задержки необратимых изменений зрительного нерва. Для этого в арсенале современного специалиста имеется несколько вариантов – медикаментозная терапия, лазерное или хирургическое вмешательство.
Методом первого выбора является использование местных антиглаукомных препаратов. На амбулаторном приеме задача специалиста в ведении этой группы пациентов – отслеживать эффективность назначенной терапии, соблюдение пациентом рекомендаций и динамику зрительных функций1.
Как проактивный подход к оценке состояния глазной поверхности может помочь улучшить качество жизни и способствовать сохранению зрительных функций пациентов с глаукомой?
Распространенность ССГ среди пациентов с глаукомой
И глаукома, и синдром сухого глаза (ССГ) – заболевания, чаще встречающиеся у «возрастных» пациентов. Однако если в исследованиях среди пациентов старше 50 лет частота ССГ варьирует от 3,9 до 34% , то по результатам многоцентрового эпидемиологического исследования, включившего более 20000 пациентов с глаукомой синдром сухого глаза был выявлен у 52.6%2,3.
В чем причина ССГ у пациентов с глаукомой?
Лечение глаукомы – постоянное использование антиглаукомных капель с кратностью закапывания от одного до нескольких раз в сутки, иногда – комбинации нескольких препаратов, на протяжении многих лет.
При этом и действующее вещество, и сопутствующие компоненты могут негативно влиять на слезную пленку и глазную поверхность4. В списке препаратов, способных индуцировать или ухудшать симптоматику ССГ, практически все группы антиглаукомных капель. При этом компонентом, наиболее тесно связанным с развитием ССГ, исследования называют консервант5.
В статье Hollo et al ССГ, сопутствующий глаукоме, определяется следующим образом:
дисбаланс гомеостаза глазной поверхности, вызванный токсическим эффектом длительного применения местных препаратов, что ведет к нарушению стабильности слезной пленки, повреждению эпителия и воспалению глазной поверхности4
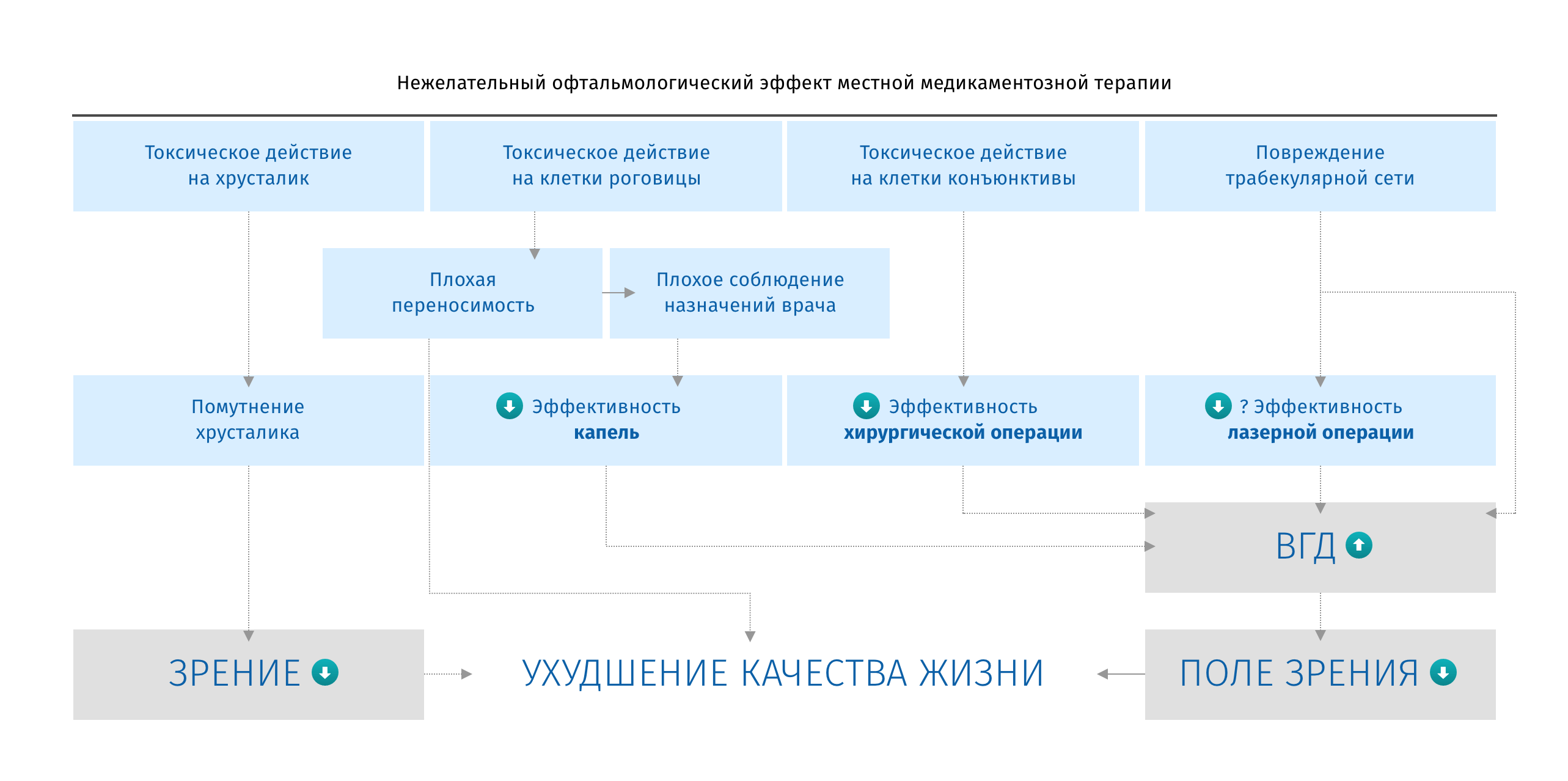
Нежелательные офтальмологические эффекты местной медикаментозной терапии глаукомы. Источник: Preservative-free Treatment in Glaucoma Is a Sensible and Realistic Aim for the Future. Marina Hopes, David Broadway. European Ophthalmic Review, 2010
Консерванты в глазных каплях: осторожно, БАХ!
Наличие консерванта в глазных каплях предотвращает микробную контаминацию содержимого флакона. Чаще всего в офтальмологических препаратах используется Бензалкония Хлорид (БАХ), который обладает высокой активностью в отношении большинства патогенных микроорганизмов в достаточно низкой концентрации, однако способен оказывать токсическое воздействие на клетки поверхности глаза, особенно при частом и длительном применении6.
Механизм негативного воздействия БАХ на ткани поверхности глаза связывают в непосредственным токсическим воздействием на клетки эпителия, а также с его детергентными свойствами,способствующими разрушению липидного слоя слезной пленки6.
Кроме того, ряд исследований связывает БАХ с токсическим действием на клетки трабекулярной сети и эпителия хрусталика7,8.
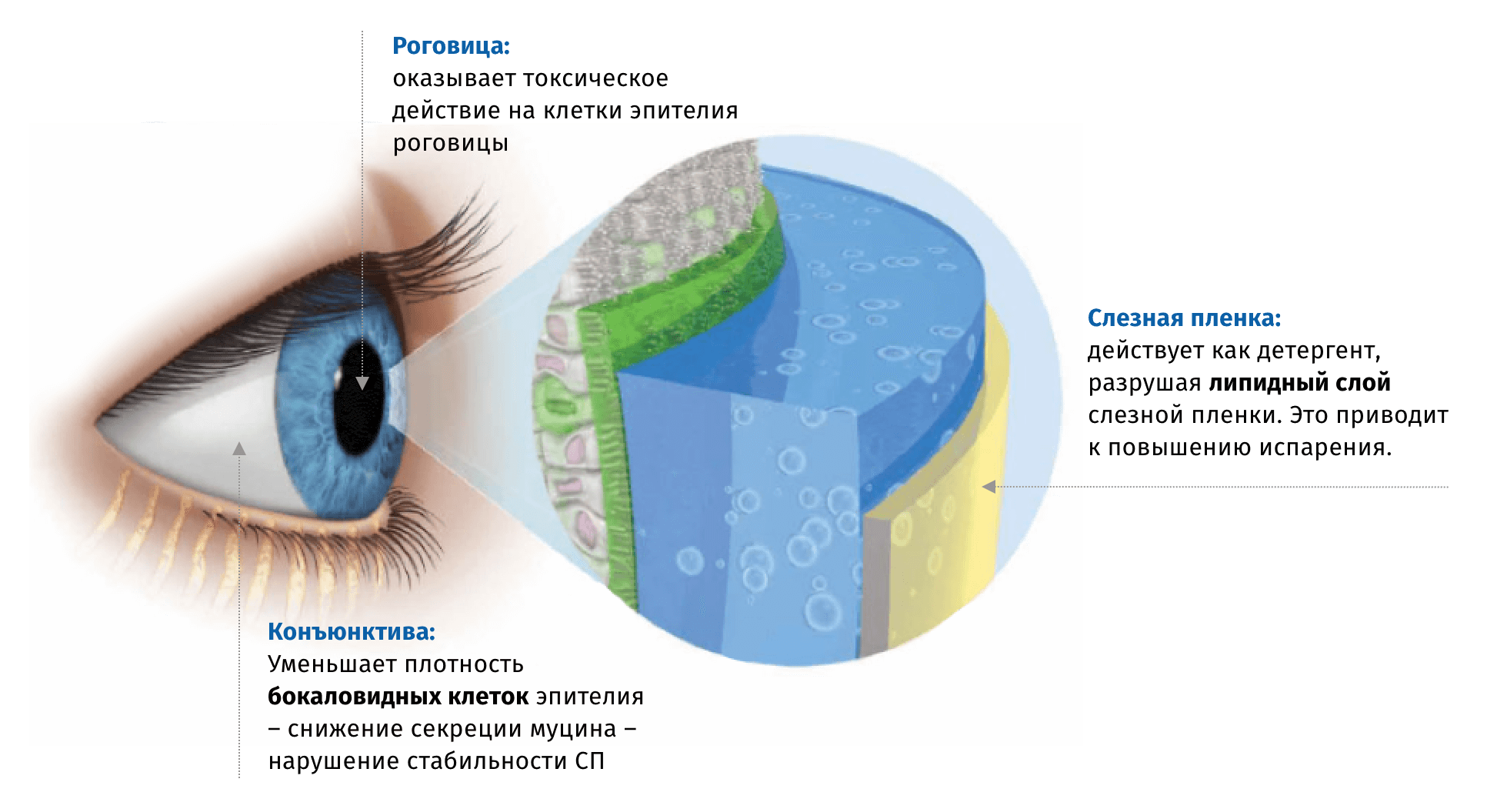
Выраженность негативного действия БАХ на ткани глаза зависит от кратности и продолжительности закапывания. Степень тяжести симптомов ССГ напрямую связана с количеством применяющихся местных препаратов. Исследование Rossi et al. показало зависимость частоты ССГ от количества применяемых препаратов: использование в схеме лечения 3х препаратов – 43%, 2 – 39%, 1 – 11%9.
Следует учитывать, что многие местные препараты, назначаемые специалистом дополнительно – слезозаменители, кератопротекторы — также могут содержать БАХ в качестве консерванта, что увеличивает токсическую нагрузку.
Бесконсервантные формы
В исследованиях прослеживается зависимость между частотой ССГ и наличием консерванта в используемых пациентом препаратах. Например, по данным мультицентрового кросс-секционального эпидемиологического исследования в 4 странах Европы с участием 9658 пациентов с глаукомой переход на бесконсервантную форму препарата позволяет уменьшить нежелательную симптоматику10:

На сегодняшний день существуют препараты выпускаемые в бесконсервантной форме — одноразовые тюбик-капельницы (монодозы), или многодозовые флаконы со специальной системой защиты от контаминации (особая мембрана или клапан). Однако выпуск препарата в форме монодоз увеличивает его стоимость, а перечень антиглаукомных препаратов в многодозовых флаконах без консерванта пока ограничен.
Альтернативные консерванты
Помимо бесконсервантных форм, у современному специалисту доступен целый ряд альтернативных консервантов, позволяющих уменьшить негативное влияние на глазную поверхность даже при частых закапываниях.
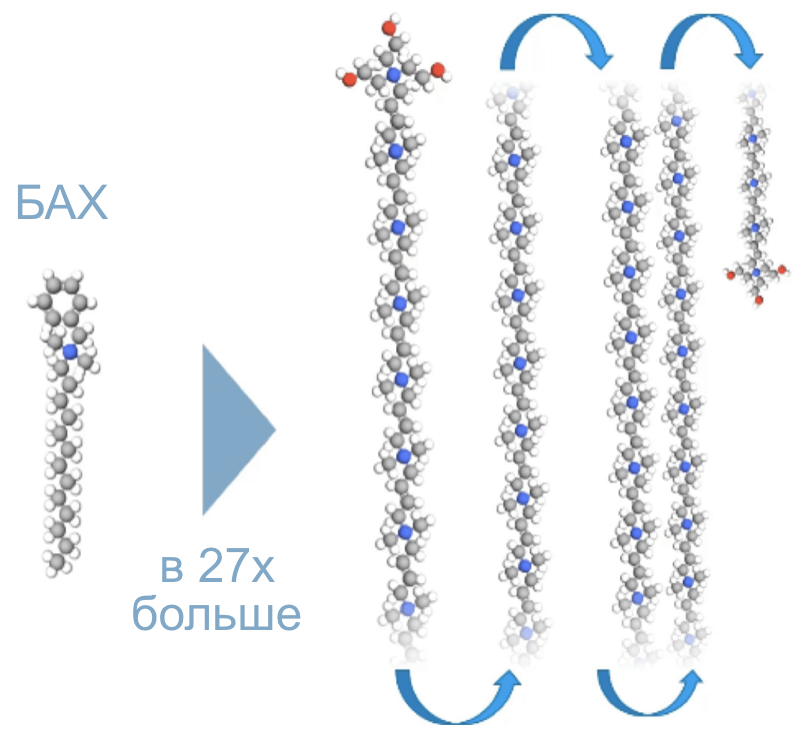
Поликватерниум (Поликвад) – консервант, широко используемый в растворах для контактных линз, в слезозаменителях и в препаратах для лечения глаукомы. По своей структуре поликватерниум представляет полимерное соединение четвертичного аммония. Размер молекулы примерно в двадцать семь раз больше молекулы БАХ.
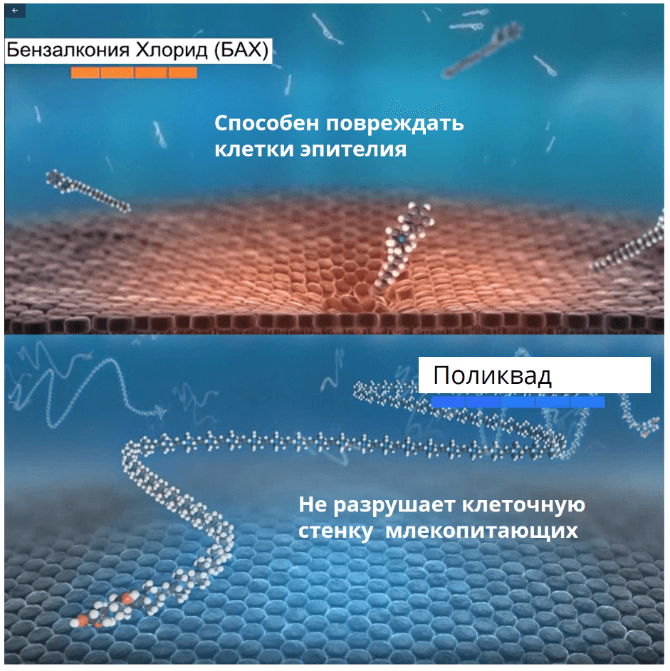
Макромолекула поликватерниума не оказывает токсического действия на клетки млекопитающих. Кроме того, молекула не обладает детергентными свойствами и не разрушает липидный слой, что это сводит к минимуму нежелательные эффекты на глазную поверхность6.
Целый ряд клинических исследований подтвердил безопасность применения офтальмологических растворов с поликвадом для тканей глазной поверхности6,13,14,15
Еще одна группа консервантов, активно использующаяся в препаратах для лечения глаукомы и ССГ — окислительные консерванты, распадающиеся при контакте со слезой.
Перборат натрия, является консервантом окислительного типа, который изменяет синтез белка в бактериальных клетках через окислительные механизмы. При попадании в глаза присутствующие в слезе энзимы (каталаза) разлагают консервант с образованием кислорода и воды6.
Стабилизированный Оксихлорокомплекс (СОК) состоит из хлорита, хлората натрия и диоксида хлора, распадается под действием света6.
Исследование Manlong et al. Позволило сравнить действие различных консервантов, используемых в слезозаменителях, на клетки эпителия роговицы человека.
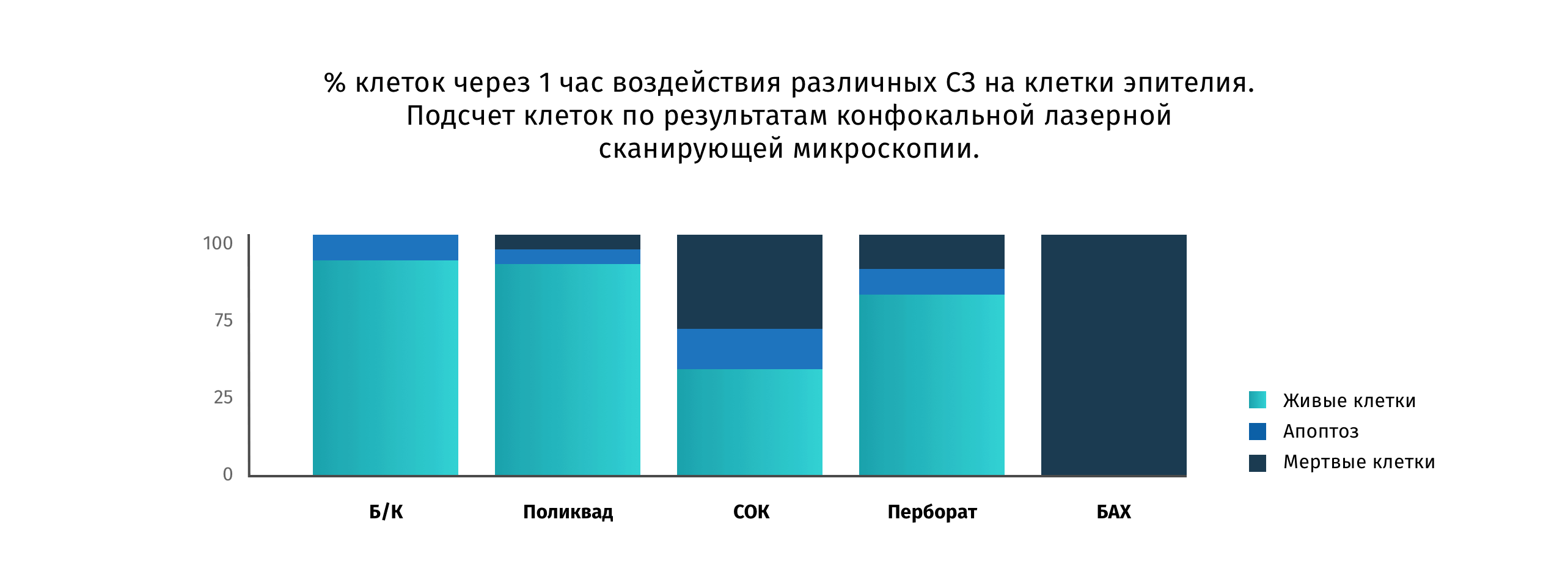
После воздействия различных слезозаменителей на монослой эпителиальных клеток жизнеспособность оценивалась с помощью конфокальной микроскопии. Альтернативные консерванты и бесконсервантные формы продемонстрировали клинически значимую разницу в сравнении с БАХ11.
Влияние ССГ на прогрессирование глаукомы
Проблема нежелательных явлений в терапии глаукомы волнует многих специалистов, и не только с точки зрения ССГ. Исследование Philippe Denis выявило связь между наличием симптомов ССГ, связанных с использованием антиглаукомных препаратов, и течением глаукомы. Данные исследования показывают, что присутствие нежелательных симптомов увеличивает риск прогрессирования глаукомы в 3,3 раза!12
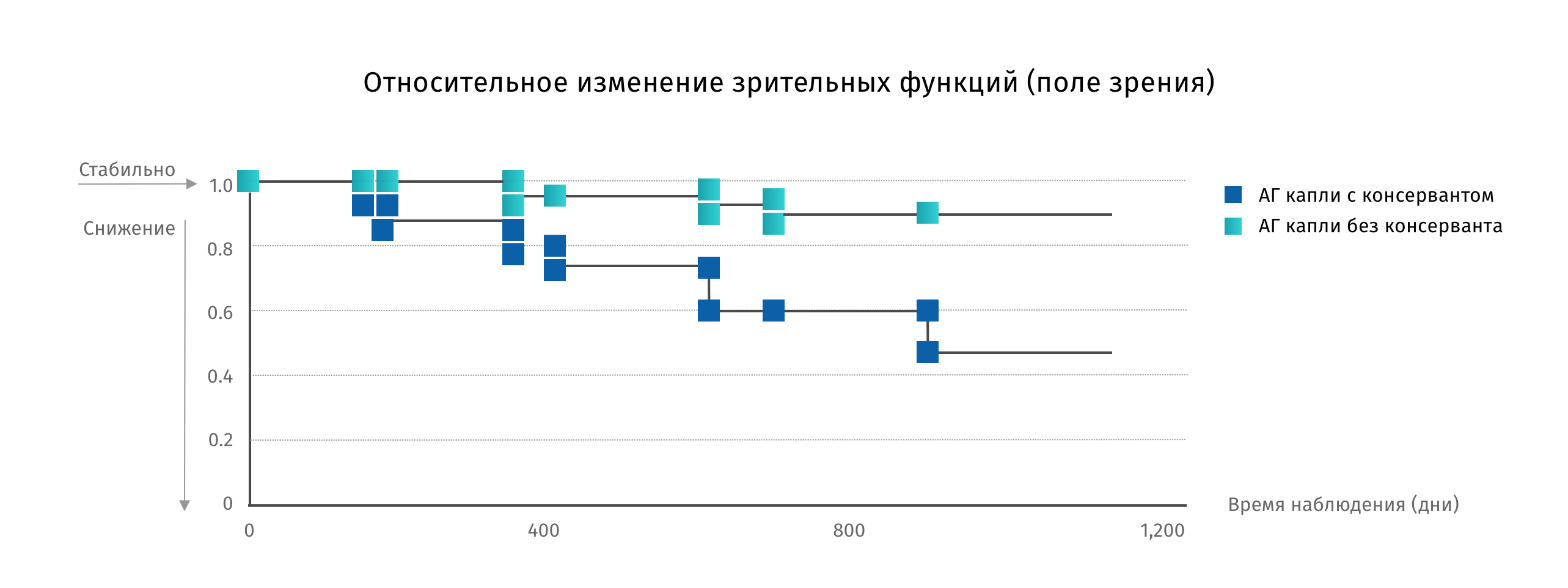
Причина достаточно проста – дискомфорт, связанный с нежелательными явлениями, снижает комплаентность пациентов. А нарушение режима ведет к прогрессированию атрофии зрительного нерва и необратимому снижению зрительных функций. Нежелательные явления, связанные с местным применением антиглаукомных препаратов, могут оказать неблагоприятное воздействие на соблюдение рекомендаций пациентом12.
Ведение пациентов с ССГ в практике глаукомного приема
Ведение пациентов с глаукомой в случае выявления ССГ имеет некоторые особенности: требуется корректировка схемы применения антиглаукомных препаратов с целью уменьшения токсической нагрузки.

Минимизмация кратности закапывания (использование комбинированных препаратов, пролонгированных форм)

Переход с БАХ на альтернативные консерванты с минимальной токсичностью или бесконсервантные формы

В случае выраженной симптоматики ССГ и повреждения глазной поверхности можно рассматривать также возможности лазерного и хирургического лечения2.
Выбор слезозаменителей для пациентов с глаукомой
Для защиты глазной поверхности, а также для уменьшения симптоматики у данных пациентов применяют слезозаменители. Однако если слезозаменитель в качестве консерванта также содержит БАХ – итоги такого лечения могут быть сомнительны. Токсичность БАХ зависит от дозировки – вероятность ее увеличивается с каждым закапыванием препарата. Это важно учитывать при назначении дополнительных препаратов для местного применения.
Сегодня все больше слезозаменителей выпускается с альтернативными консервантами, обладающими минимальной токсичностью в отношении слезной пленки и эпителия глазной поверхности. Среди них – поликвад, оксид, пурит, окупур6.
Также все более популярными становятся препараты без консерванта – монодозы и препараты в особых мультидозных флаконах-контейнерах.
Ключевыми факторами при выборе слезозамещающей терапии у пациентов с глаукомой являются2:

Безопасный консервант или его отсутствие. Бесконсервантные формы выпускаются в форме монодоз или в специальных мультидозных флаконах.
Альтернативные консерванты, например, поликвад, не оказывают токчического действия на глазную поверхность и не нарушают стабильность слезной пленки6.

Длительность действия. Вязкие, гелеобразные препараты имеют более продолжительное действие, пример — препараты на основе карбомера.
Препараты с трансформационным эффектом при закапывании имеют низкую вязкость, а на поверхности глаза вязкость увеличивается, обеспечивая более длительную защиту — таким действием обладают препараты на основе гидроксипропилгуара.
Источник
Макаров Р.А.
Саттелитный симпозиум компании «Аллерган» на тему «Глаукома и синдром «сухого глаза» – современные «эпидемии» в офтальмологии» открыл профессор Егоров В.А. с докладом «Оптимальные подходы при выборе медикаментозной терапии у пациентов с первичной открытоугольной глаукомой». Он подчеркнул значимость гипотензивной терапии как «фундамента» лечения глаукомы, при которой очень важно стремиться к 30% снижению внутриглазного давления (ВГД) от исходного уровня или ВГД меньше 18 мм рт.ст. (Pо), наряду с минимальным колебанием ВГД в течение суток. При подборе лечения для оптимального гипотензивного препарата является первостепенным критерием – эффективное снижение внутриглазного давления с длительным эффектом и минимально возможными побочными эффектами.
Один из таких комбинированных препаратов, содержащих биматопрост, является Ганфорт, который воздействует как на снижение продукции ВГД, так и на увеосклеральный отток. Особенностью данного препарата является то, что биматопрост находится в разведенной в 2 раза концентрации, что обеспечивает минимальные проявления гиперемии, часто встречающейся у пациентов после закапывания. При сравнении Ганфорта с другими фиксированными комбинациями (с травапростом, латанопростом) первый показал значительно большую эффективность в снижении внутриглазного давления (рис. 1).
Докладчиком было отмечено, что важным моментом является не только снижение
ВГД, но и улучшение глазного кровотока. Фиксированные комбинации играют в данном случае важную роль, и комбинация бримонидина) с тимололом (Комбиган) показала не только более эффективное снижение давления по сравнению с комбинацией дозоламида с тимололом (рис 2), но и сопоставимое улучшение глазного кровотока по данным цветной доплерографии (рис. 3).
По словам докладчика, при достижении нужного ВГД важную роль играет нейропротекторное действие препарата. В частности, к таким препаратам относится Бримонидин, который в сравнительном анализе с Тимололом показал значительно меньший процент больных с ухудшением полей зрения (рис. 4)
С целью снижения влияния бримонидина на эпителий роговицы был создан препарат Альфаган P, содержащий нетоксичный и быстроразлагающийся в конъюнктивальной полости консервант Purite С и карбоксиметилцеллюлозу, имеющую высокую мукоадгезивность и смазывающий эффект (рис 5). Помимо этого, при использовании Альфагана Р отмечалось значительное снижение аллергических реакций по сравнению с Бримонидином 0,2% (рис 6).
В заключении профессор Егоров В.А. отметил, что в лечении глаукомы важно поддерживать зрительные функции больных глаукомой за счёт комплексного подхода, заключающегося в эффективном поддержании ВГД, глазного кровотока, а также ретинопротекции.
Второй доклад был представлен доктором Петровым С.Ю. на тему «Фиксированные комбинации в лечении псевдоэксфолиативной глаукомы», где подчеркнул, что псевдоэксфолиативный синдром (ПЭС) является одной из наиболее частых причин возникновения первичной открытоугольной глаукомы (ПОУГ). Данное заболевание является системным, и ПОУГ по данным этого доклада у таких больных развивается до 20 раз чаще с более высоким уровнем ВГД и большей амплитудой его колебания в течение дня.
При выборе лечения таких больных предпочтение отдается простагландинам ввиду их высокой эффективности. Так при применении препарата Ганфорт у пациентов с псевдоэксфолиативной глаукомой (ПЭГ) наблюдалось эффективное снижение давление в утреннее и вечернее время (рис. 7) с хорошей переносимостью и минимальным эффектом гиперемии.
По влиянию на ВГД в сроке 6 месяцев Ганфорт показал более эффективное снижение давления, чем фиксированная комбинация (ФК) травопрост/тимолол и имел минимальные явления конъюнктивальной гиперемии, а также высокий процент переносимости (рис. 8, 9).
В заключении он отметил, что зачастую пациенты приходят с уже поздними стадиями глаукомы и назначение такой фиксированной комбинации является оправданным назначением в лечении глаукомы, и в частности ПЭГ.
Третий доклад на тему «Тонкие струны в сложном механизме» представил доктор Селезнёв А.В. и отметил, что на данный момент проблема глаукомы и синдрома «сухого глаза» является наиболее интересуемой как для врачей, так и для пациентов. Помимо этого, единственным модулируемым фактором в развитии глаукомной оптической нейропатии (ГОН) является уровень внутриглазного давления. По озвученным докладчиком данным («Научный авангард» 2011-2015гг.), при первичном назначении пациентам β-блокаторов и давлении выше 25 мм.рт.ст. наблюдалось в течение 5 лет прогрессирование ГОН со снижением зрительных функций, и только у тех пациентов, у кого внутриглазное давление было ниже 20 мм.рт.ст., наблюдался положительный эффект. Давление цели, которое необходимо поддерживать на определенном уровне для каждой степени глаукомы (Рис. 10), зачастую не достигается у пациентов, что приводит к её дальнейшему прогрессированию.
На рис. 11 представлена тактика лечения с назначением препаратов в зависимости от их эффективности во временных промежутках.
На данной схеме показано, что лечение нужно начинать либо с аналогов простагландинов, либо при их неэффективности сразу переходить к фиксированным комбинациям, которые, по данным докладчика, имеют преимущества по сравнению с монотерапией в более редком режиме закапывания, а, следовательно, и меньшим количеством поступления консервантов. Наиболее острой проблемой применения препаратов, содержащих бензалкония хлорид (БАХ), является то, что он вызывает развитие синдрома «сухого глаза». И в решении данной проблемы автором предлагалось несколько возможных тактик: таких как снижение концентрации БАХ, применение менее токсичных фиксированных комбинаций или полный отказ от консервантов.
Так, использование более мягкого консерванта Purite в препарате Альфаган по сравнению с БАХ позволило отметить его меньшее влияние на эпителий роговицы (рис. 12).
Помимо этого, в лечении синдрома «сухого глаза» при глаукоме предпочтение отдаётся циклоспорину А (Рестасис), при котором в сравнении с препаратами искусственной слезы при одинаковом времени применения происходило значительное увеличение времени разрыва слёзной плёнки и показателей теста Ширмера (рис. 13, 14).
В заключении он отметил, что Циклоспорин А (Рестасис) эффективен не только в лечении ССГ, но и при дисфункции мейбомиевых желёз, которая часто встречается у больных глаукомой на фоне применения антиглаукоматозных препаратов.
Профессор Бржеский В.В. представил доклад на тему «Проблема синдрома «сухого глаза» и оптимальные возможности её терапии и отметил, что на данный момент наблюдается высокие показатели зависимости синдрома сухого глаза (ССГ) от применения антиглаукомных препаратов вследствие содержания в них консервантов. По представленным докладчиком данным, наиболее часто используемый консервант в препаратах искусственной слезы, снижающих давление и противовоспалительных – бензалкония хлорид.
Исходя из патогенеза ССГ, к одним из важных направлениям его лечения относятся: восполнение дефицита влаги и снижение осмолярности слёзной плёнки, наряду с купированием воспалительного процесса и иммунокоррекцией. В восполнении дефицита влаги важным моментом является использование слезозаместителей и стимулирование компонентов слезной пленки. Применение слезозаместителей при лечении глаукомы требует отсутствия в них консерванта или консервата, разлагающегося в конъюнктивальной полости, так как он будет только усугублять явления ССГ. Среди параметров, определяющих в данном случае назначение препаратов «искуственной слезы», важными являются такие как патогенетический тип ССГ и степень тяжести ксероза глазной поверхности наряду с индивидуальной переносимостью препарата. В терапии ССГ одновременное увлажнение за счёт содержания карбоксиметилцеллюлозы (КМЦ) и глицерола и осуществление осмопротекции наблюдается у препарата Оптив, который позволяет воздействовать сразу на 2 патогенетических механизма. Он применяется в первую очередь в случае гиперосмолярности слёзной плёнки с дисфункцией мейбомиевых желёз и первичным снижением слезопродукции, а также и в лечении других форм ССГ.
Рис. 15 показывает патогенетическую терапию ксеротического процесса. По данным докладчика, важную роль в ней играют препараты Циклоспорина А (Рестасис). Применение Циклоспорина А (Рестасис) позволяло значительно снизить частоту закапывания слезозаместителей у пациентов с глаукомой (рис. 16).
В связи с тем, что наряду с высокой эффективностью Циклоспорин А (Рестасис) может иногда вызывать раздражение в первые месяцы применения, оправдано его сочетание со слезозаместителями для нивелирования данного эффекта. Применение бесконсервантного слезозаместителя (Оптив) с Циклоспорином А (Рестасис) показало значительное снижение у пациентов субъективных симптомов в первые месяцы (Рис. 17).
Завершая свой доклад профессор Бржевский В.В. отметил, что важным является комплексный подход лечения ССГ, направленный на все патогенетические звенья данного процесса у больных с глаукомой.
Следующий доклад представила Авдеева О.Н.на тему «Патогенетическая терапия синдрома слёзной дисфункции», отметив актуальность проблемы ССГ в связи с высокими показателями его распространенности по всему миру. По данным докладчика, ведущая роль в патогенезе ССГ отводится повышению осмолярности слёзной плёнки и наличию воспаления поверхности глазного яблока.
В исследовании, представленном докладчиком, была проведена оценка применения препарата Оптив у 20 пациентов с ССГ легкой степени, где один глаз являлся контрольным, а во второй производили инстилляции препарата. Через 7 дней после применения препарата Оптив наблюдалось увеличение времени разрыва слёзной плёнки по сравнению с контрольной группой (рис. 18). Помимо этого, у данных пациентов наблюдалось снижение показателей pH слёзной жидкости (рис. 19), и концу первой недели на фоне увеличения пробы Норна – уменьшение осмолярности слёзной плёнки.
По данным, представленным в докладе, ССГ на данный момент является воспалительным заболеванием и называется уже как синдром «слёзной дисфункции», в связи с тем, что важной характеристикой является не только количество слезы, но и её качество.
В лечении воспалительного процесса при синдроме слёзной дисфункции применяются стероиды и/или циклоспорин А (Рестасис), являющийся иммуномодулирующим агентом. Данный препарат показан тем пациентам, у кого имеется хроническое течение ССГ и необходимость частого закапывания слёзозаместителей, а также тем, у кого имеется нарушение функции слёзной железы.
Далее докладчиком был продемонстрирован ряд клинический случаев пациентов с разными формами и степенями ССГ.
В первом клиническом примере пациентка с ССГ (рис. 22) получала Рестасис в течение 6 месяцев.
После 6 месяцев применения Рестасис отмечалась значительное повышение показателей пробы Норна и теста Ширмера.
В другом клиническом примере пациент с ССГ на фоне токсикоаллергического конъюктивита получал лечения Рестасиса в течение 2,5 месяцев с положительной динамикой проб норма и теста Ширмера (рис. 21).
В заключении докладчик дала ряд практических рекомендаций по применению препарата Рестасис с целью уменьшения жалоб на жжение: закапывание холодного раствора циклоспорина А – уменьшение жжения в 75% случаев, закапывание слезозаместителей за 10 мин. до или после применения Рестасиса и использование на старте терапии стероидов за 10 мин до Рестасиса.
Последний доклад был представлен доктором Белецкой И.С. на тему «Опыт ведения пациентов с тяжелым течением синдрома «сухого глаза», которая отметила, что немаловажное место в сложном патогенезе ССГ отводится воспалительным явлениям, и в связи с этим актуальность приобретает применение препаратов, которые помимо воспалительного эффекта имеют иммуномодулирующее действие, к которому и относится циклоспорин А (Рестасис). По данным, приведенным в докладе, противовоспалительный эффект достигается путём иммуносупрессивного действия препарата за счёт препятствия активации, пролиферации и миграции Т – лимфоцитов, а также уменьшения продукции противовоспалительных цитокинов. При его системном применении происходит повышение плотности бокаловидных клеток бульбарной конъюнктивы и увеличение секреции муцинов, а, следовательно, и нормализация слёзных желёз.
Эффективность данного препарата была подтверждена в данном сообщении серией клинических случаев.
В первом клиническом случае пациент обратился с ССГ после перенесенного блефароконъюнктивита с низкими показателями теста Ширмера, наряду с наличием хронических заболеваний ЖКТ (Рис. 22).
После назначения пациенту циклоспорина А (Рестасис) наблюдалось значительное повышение показателей пробы Норна на обоих глазах (рис. 23) и теста Ширмера.
Во втором клиническом примере представлена пациентка с частыми проявлениями конъюнктивита на фоне каждого перенесенного ОРВИ, а также аденовирусных конъюнктивитов с симптомами ССГ. В дальнейшем у пациентки диагностировали открытоугольную глаукому, компенсируемую каплями, и после чего она начала отмечать появление симптомов конъюнктивита. В связи с низкими показателями пробы Норна, на фоне применения лубрикантов ей было решено назначить препарат Рестасис.
Через 8 месяцев наблюдалось значительно повышение показателей пробы Норна, и стихание воспалительного процесса конъюнктивы.
В заключении доктор Белецкая Е.С. отметила, что препарат Рестасис, обладая противовоспалительным и иммуносупрессивным эффектами, позволяет тем самым у данных групп больных избавить от необходимости применения системных иммуносупрессоров. По её мнению, данный препарат у больных с выраженными проявлениями ССГ значительно снижает их жалобы на чувство инородного тела, обеспечивает стабилизацию времени разрыва слёзной плёнки и снижает кратность закапывания слезозаместителей.
Источник
