Гист желудка код по мкб
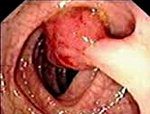
Гастроинтестинальные стромальные опухоли
Гастроинтестинальные стромальные опухоли (ГИСО, GIST (англ.); код по МКБ-10:
С15 – С20; С48) — группа редких мезенхимальных опухолей желудочно-кишечного
тракта, преимущественно поражающая желудок и тощую кишку (иногда опухоль находят
в 12-перстной кишке, еще реже в пищеводе и прямой кишке). Из всех опухолей взрослых
людей составляют лишь 1 % независимо от пола. Болеет 10–15 человек из 1 млн [3].
Основные методы лечения: таргетная («прицельная») терапия ингибиторами
тирозинкиназ при появлении отдаленных метастазов и хирургический метод при
небольших вариантах опухолей и возможности «экономного» вмешательства.
До 1983 года термина ГИСО не существовало, а большинство опухолей,
впоследствии отнесенных к этой группе, считались доброкачественными. Термин
«стромальная опухоль» был впервые почти одновременно использован двумя группами
ученых: Майклом Мазуром (Michael T. Mazur) и Генри Кларком (Henry B. Clark) в 1983 г.,
а также Джоном Шелденбрандом (John D. Schaldenbrand) и Генри Эпплмэном (Henry D.
Appleman) в 1984 г. Однако термин не был признан, и лишь в 1989 г. группа этих
опухолей с ярко выраженной вегетативной симптоматикой была выделена в
самостоятельную нозологическую единицу под названием «гастроинтестинальная
опухоль автономной иннервации» (GANT). И только в середине 1990-х годов благодаря
развивающимся иммуногистохимическим методам заболевание получило свое
современное рабочее название [7].
Распространенность и тип наследования
Заболевание считается редким и возникает в 10–15 случаях на 1 млн человек. Все
формы гастроинтестинальных стромальных опухолей составляют в общем 1 % от числа
онкологических заболеваний желудочно-кишечного тракта. Наследственный характер
заболевания не прослеживается. Учитываются случаи возникновения у родственников
первой линии других онкологических диагнозов, но в рамках рутинной врачебной
практики.
Специфические симптомы, позволяющие с точностью поставить диагноз «ГИСО»
без дополнительной диагностики, отсутствуют. Пациента, в зависимости от локализации
первичной опухоли, может беспокоить затрудненное глотание твердой пищи, боль в
животе, снижение массы тела — симптомы, характерные для многих заболеваний этой
области, в том числе не онкологических (гастрит, язвенная болезнь и т. п.). По
результатам диспансеризации у пациентов можно обнаружить кровь в анализе кала,
образования с нечеткими контурами при проведении УЗИ брюшной полости и
забрюшинного пространства, анемию в общем анализе крови и т. п. Следует отметить, что
выявление ГИСО на ранней стадии зачастую является либо результатом планового
осмотра, либо случайной находкой. Обычно пациенты обращаются за медицинской
помощью в тех случаях, когда помимо оперативного лечения необходима лекарственная
терапия.
Особый интерес представляют специфические наследственные заболевания, при
которых ГИСО является одним из синдромов. К примеру, состояние, называемое
«триадой Карнея», это сочетание нескольких опухолей в разных органах у женщин
молодого возраста и детей: ГИСО в желудке, хондромы или гамартохондромы лёгкого и
экстраадреналовой параганглиомы [1]. Таким образом, при выставлении диагноза ГИСО у
этих групп пациентов нельзя исключать наличия вышеописанной триады.
Особое место в диагностике генетического «портрета» ГИСО занимает анализ на
наличие мутаций в генах C-KIT и PDGFRA. Эти мутации можно выявить в одном анализе.
Мутации гена C-KIT встречаются у 85 % пациентов c гастроинтестинальными
стромальными опухолями. Наличие мутаций в гене C-KIT может иметь решающее
значение при выборе метода лечения. Например, мутация в 816-м домене (D816V) делает
опухоль резистентной к ингибитору рецепторной тирозинкиназы C-KIT.
Мутации в гене PDGFRA встречаются в 5 % случаев ГИСО (обычно в 12 и 18
экзонах). Эти полиморфизмы (за исключением мутации D842V), наоборот, ассоциированы
с чувствительностью опухоли к ингибиторам тирозинкиназы.
При обнаружении опухоли на той стадии, когда размеры менее 1-2 см, возможно
динамическое наблюдение. Однако следует помнить, что при увеличении размеров до 2
см, необходимо выполнение хирургического вмешательства. Опухоль удаляют,
руководствуясь принципом «экономной» резекции (захватывая минимальное количество
здоровой ткани), проводят тщательный осмотр операционного поля. Затем оцениваются
риски прогрессирования заболевания: при высоком риске проводится терапия
ингибиторами тирозинкиназы, при низком риске — динамическое наблюдение.
Обязательным аспектом лечения является поиск мутаций в генах C-KIT и PDGFRA,
которые существенно влияют на выбор терапии: при наличии определенных мутаций
назначают таргетную терапию ингибиторами тирозинкиназы, при отсутствие мутаций в
этих генах возможно применение классической химиотерапии.
Иногда с целью уменьшения размера первичной опухоли перед операцией
пациенту предварительно могут быть назначены ингибиторы тирозинкиназы, и лишь
потом будет проведена резекция опухоли.
Большинство авторов сходится во мнении, что основной генетической
особенностью данной группы опухолей является наличие онкогенных мутаций C-KIT или
PDGFRA [4]. Оба этих гена кодируют рецепторные тирозинкиназы. Мутации, приводящие
к избыточной активности этих рецепторов, усиливают пролиферацию клеток опухоли.
Важно отметить, что рецептор С-KIT присутствует на поверхности
интерстициальных клеток Кахаля, отвечающих за сокращение полых органов
пищеварительной системы, и других клеток организма. Однако C-KIT есть и в других
клетках. Большинство (90 %) всех мутаций гена С-KIT происходит в той его части,
которая кодирует внутриклеточный домен белка. Мутации приводят к повышенной
частоте деления клеток и их геномной нестабильности. К настоящему времени
определены экзоны наиболее вероятных мутаций: 9, 11, 13, 17.
Другие варианты ГИСО имеют мутации в гене PDGFRA. Большинство этих
мутаций связаны с аминокислотной заменой во втором тирозинкиназном домене белка,
что придает клеткам опухоли устойчивость к стандартным препаратам — ингибиторам
тирозинкиназы.
Большинство ГИСО у детей и незначительная часть у взрослых не несет мутаций в
экзонах С-KIT и PDGFRA. Тогда у врачей возникают трудности с первоначальной
тактикой (в этом случае можно пробовать другое полихимиотерапевтическое лечение в
условиях стационара, которое в обычной ситуации не сработало бы. Однако такое лечение
не определено в стандартах оказания медицинской помощи по ГИСО и чаще всего
является результатом творческого подхода коллектива врачей к вопросам лечения
конкретного пациента) [2, 8].
Другими кандидатами на ключевую роль в возникновении и развитии ГИСО можно
считать гены ETV1 [5], BRAF [4], SDH и DOG1 [6]
- Алексеева Т.Р. Триада Карнея: литературные данные и опыт наблюдения / Т.Р.
Алексеева, А.И. Карселадзе, Б.И. Долгушин, Е.О. Осипян, Н. Ц.-Д. Цымжитова // Вестник
РОНЦ им. Н. Н. Блохина РАМН. – 2011. — Т. 22, № 3. — С. 103—109 - Бойчук С.В. Механизмы химиочувствительности клеточных линий
гастроинтестинальных стромальных опухолей in vitro / С.В. Бойчук, Б.Р. Рамазанов, А.Р.
Галембикова, И.Г. Мустафин, А. Дусинг // Гены и клетки. – 2014. – Т. 9, № 4. – С. 116-120. - Никулин М.П. Практические рекомендации по лекарственному лечению
гастроинтестинальных стромальных опухолей / М.П. Никулин, П.П. Архири, Л.Ю.
Владимирова, А.С. Жабина, Д.А. Носова, И.С. Стилиди и др. // Злокачественные опухоли:
Практические рекомендации RUSSCO #3s2. – 2018. – Т. 8. – С. 421–429.
[DOI:10.18 027 / 2224–5057–2018–8–3s2–421–429] - Boichuk S., Galembikova A., Dunaev P. et al. A Novel Receptor Tyrosine Kinase Switch
Promotes Gastrointestinal Stromal Tumor Drug Resistance // Molecules. – 2017. – V. 22, I. 12. –
P. 2152. [DOI:10.3390/molecules22122152] - Ran L., Chen Y., Sher J. et al. FOXF1 Defines the Core-Regulatory Circuitry in
Gastrointestinal Stromal Tumor // Cancer Discov. – 2018. – V. 8, I. 2. – P. 234–251.
[DOI:10.1158/2159-8290.CD-17-0468] - Wu C.E., Tzen C.Y., Wang S.Y., Yeh C.N. Clinical Diagnosis of Gastrointestinal Stromal
Tumor (GIST): From the Molecular Genetic Point of View // Cancers (Basel). – 2019. – V. 11, I. 5. – P. 679. [DOI:10.3390/cancers11050679] - Zhao X., Yue C. Gastrointestinal stromal tumor // J Gastrointest Oncol. – 2012. – V. 3, I. 3. –
P. 189-208. [DOI: 10.3978/j.issn.2078-6891.2012.031] - Zook P., Pathak H.B., Belinsky M.G. et al. Combination of Imatinib Mesylate and AKT
Inhibitor Provides Synergistic Effects in Preclinical Study of Gastrointestinal Stromal Tumor //
Clin Cancer Res. – 2017. – V. 23, I. 1. – P. 171–180. [DOI:10.1158/1078-0432.CCR-16-0529]
Источник
Гастроинтестинальные стромальные опухоли – новая разновидность сарком желудочно-кишечного тракта. В статье расскажем о симптомах и разновидностях заболевания, опишем лечение и профилактику
Это опухоли зрелого возраста, до 40 лет они встречаются очень редко, преобладают мужчины в середине седьмого десятка жизни.
Предполагается, что заболеваемость не растет, просто диагностика стала лучше.
Перед вами фрагмент клинической рекомендации из Медицинской экспертной системы Консилиум. Развернуть рекомендацию полностью вы можете в системе. Если вы не подписчик, воспользуйтесь пробным доступом.
Диагнозы по МКБ:
C15 Злокачественное новообразование пищевода
C16 Злокачественное новообразование желудка
C17.0 Злокачественное новообразование двенадцатиперстной кишки
C17.2 Злокачественное новообразование подвздошной кишки
C17.3 Злокачественное новообразование дивертикула Меккеля
C18 Злокачественное новообразование ободочной кишки
C19 Злокачественное новообразование ректосигмоидного соединения
C20 Злокачественное новообразование прямой кишки
C48.0 Злокачественное новообразование забрюшинного пространства
C48.1 Злокачественное новообразование уточненных частей брюшины
Жалобы и анамнез
Для выявления факторов, которые могут повлиять на выбор тактики лечения, необходим тщательный сбор жалоб и анамнеза у пациента
Физикальное обследование
Тщательный физикальный осмотр с оценкой нутритивного статуса.
Лабораторная диагностика
- развернутые клинический и биохимический анализы крови
- исследование свертывающей системы крови
- анализ мочи
Инструментальная диагностика
Предоперационное обследование включает следующие методы:
- клинические
- рентгенологические
- эндоскопические
Основными инструментальными методами в диагностике ГИСО являются эндоскопическое исследование и компьютерная томография (КТ) с в/в контрастированием.
Патоморфологический диагноз устанавливается на основании гистологического и обязательного иммуногистохимического исследования (CD117 и/или DOG1) биоптата или хирургически удаленной опухоли.
В CD117 и/или DOG1 негативных опухолях необходим анализ мутационного статуса опухоли.
- Эзофагогастродуоденоскопия (ЭГДС) при локализации опухоли в желудке и двенадцатиперстной кишке
- Тотальная колоноскопия – при гастроинтестинальной стромальной опухоли ободочной кишки
- УЗИ брюшной полости, забрюшинного пространства и малого таза для оценки распространенности опухолевого процесса.
- КТ органов брюшной полости и малого таза с внутривенным контрастированием.
КТ органов брюшной полости является стандартом диагностики у больных стромальными опухолями.
На практике данные исследования могут быть заменены УЗИ органов брюшной полости и малого таза у пациентов с небольшой местной распространенностью опухолевого процесса.
Рентгенография грудной клетки
МРТ органов брюшной полости и малого таза с в/в контрастированием при локализации опухоли в малом тазу или подозрении на ГИСО прямой кишки.
Магнитно-резонансная томография (МРТ) используется как уточняющий метод у пациентов с опухолевым поражением желудка или прямой кишки, а также для определения объема поражения печени (в частности, у больных с противопоказаниями к использованию рентгеноконтрастных препаратов).
Позитроно-эмиссионная томография (ПЭТ)
Позитронно-эмиссионная томография выполняется для оценки метаболического эффекта лечения, а также может применяться при сомнительных результатах компьютерной томографии.
Биопсия опухоли под контролем УЗИ/КТ для морфологической верификации опухоли
Чрескожная пункционная биопсия (core-биопсия) опухоли под контролем УЗИ нежелательна, поскольку может привести к разрыву капсулы опухоли и диссеминации по брюшине и по ходу пункционного канала.
Однако у больных с гигантскими размерами опухоли и/или местно-распространенным процессом core-биопсия допустима для гистологической верификации диагноза с целью определения показаний к предоперационной терапии иматинибом.
ЭКГ
При подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям следует проводить дополнительное обследование:
- ЭхоКГ;
- холтеровское мониторирование сердечной деятельности;
- исследование функции внешнего дыхания;
- УЗДГ сосудов шеи и нижних конечностей;
- консультации кардиолога, эндокринолога, невропатолога и т.п.
Профилактика
Периодичность наблюдения после завершения лечения
В первые 1–2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяцев.
На сроке 3–5 лет – 1 раз в 6–12 месяцев.
После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб.
У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Объем обследования
- Анамнез и физикальное обследование.
- ФГДС или колоноскопия при гастроинтестинальной стромальной опухоли желудка и двенадцатиперстной кишки или ободочной и прямой кишки каждые 3–6 месяцев в зависимости от риска прогрессирования;
- УЗИ органов брюшной полости и малого таза каждые 3–6 месяцев в зависимости от риска прогрессирования;
- Рентгенография органов грудной клетки каждые 12 месяцев;
- КТ органов грудной и брюшной полости с в/в контрастированием каждые 6–12 месяцев в зависимости от риска прогрессирования.
Задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала таргетной терапии и хирургического лечения резектабельных метастатических очагов на фоне эффективного лекарственного лечения.
Полезные инструменты
Открыть справочники:
Стадирование гастроинтестинальных стромальных опухолей по системе TNM7 (2010)
Скачать критерии качества:
Материал проверен экспертами Актион Медицина
Критерии качества специализированной медицинской помощи взрослым при злокачественном новообразовании желудка
Критерии качества специализированной медицинской помощи взрослым при злокачественном новообразовании ободочной кишки, ректосигмоидного соединения, прямой кишки
Критерии качества специализированной медицинской помощи взрослым при злокачественном новообразовании пищевода
Алгоритмы лечения, протоколы первичного приема, новые формы ИДС, памятки для пациентов и врачей — читайте и скачивайте материалы на www.provrach.ru
Источник
Содержание
- Описание
- Дополнительные факты
- Классификация
- Причины
- Симптомы
- Диагностика
- Лечение
Названия
Название: Доброкачественные опухоли желудка.

Доброкачественные опухоли желудка
Описание
Доброкачественные опухоли желудка. Группа новообразований эпителиального и неэпителиального гистогенеза, исходящих из разных слоев желудочной стенки, характеризующихся медленным развитием и относительно благоприятным прогнозом. Опухоли могут проявляться болями в эпигастрии, симптомами желудочного кровотечения, тошнотой, рвотой. Основными методами диагностики доброкачественных опухолей являются рентгенография желудка и фиброгастроскопия, гистологическое исследование опухолевой ткани. Лечение доброкачественных опухолей желудка заключается в их удалении эндоскопическим методом или хирургическим путем.
Дополнительные факты
Доброкачественные опухоли желудка составляют в гастроэнтерологи 2-4% от общего числа всех опухолевых новообразований органа. Опухоли желудка могут исходить из его слизистого, подслизистого, мышечного или подсерозного слоя; из эпителиальных, нервных, сосудистых, жировых структур. По типу роста различают эндогастральные новообразования (растущие в сторону просвета желудка), экзогастральные (растущие в сторону соседних органов) и интрамуральные (с внутристеночным ростом).
Классификация
В зависимости от происхождения доброкачественные опухоли желудка разделяются на эпителиальные и неэпителиальные. Среди эпителиальных опухолей встречаются единичные или множественные аденоматозные и гиперпластические полипы, диффузный полипоз. Полипы представляют собой опухолевидные эпителиальные выросты в просвете желудка с ножкой или широким основанием, шаровидной и овальной формы, с гладкой или грануляционной поверхностью, плотной или мягкой консистенцией. Полипы желудка чаще всего возникают у лиц мужского пола в возрасте 40-60 лет, обычно располагаются в пилороантральном отделе. Ткани полипа представлены разросшимся покровным эпителием желудка, железистыми элементами и соединительной тканью, богатой сосудами.
Аденоматозные полипы желудка — истинные доброкачественные опухоли из железистого эпителия состоят из папиллярных и/или тубулярных структур с выраженной клеточной дисплазией и метаплазией. Аденомы опасны в плане малигнизации и часто приводят к развитию рака желудка. До 75% доброкачественных эпителиальных опухолей желудка составляют гиперпластические (опухолеподобные) полипы, возникающие вследствие очаговой гиперплазии покровного эпителия, имеющие относительно низкий риск озлокачествления (около 3%). При диффузном полипозе желудка выявляются и гиперпластические, и аденоматозные полипы.
Редко встречающиеся неэпителиальные доброкачественные опухоли желудка формируются внутри желудочной стенки — в ее подслизистом, мышечном или подсерозном слое из различных элементов (мышечной, жировой, соединительной тканей, нервов и сосудов). К ним относятся миомы, невриномы, фибромы, липомы, лимфангиомы, гемангиомы, эндотелиомы и их смешанные варианты. Также в желудке могут наблюдаться дермоиды, остеомы, хондромы, гамартомы и гетеротопии из тканей поджелудочной железы, дуоденальных желез. Неэпителиальные доброкачественные опухоли желудка чаще возникают у женщин и иногда могут достигать значительных размеров. Они имеют четкие контуры, обычно округлую форму, гладкую поверхность.
Причины
Причины развития доброкачественных опухолей желудка окончательно не выяснены. С точки зрения дисрегенераторной теории, развитие полипов может быть связано с нарушением регенерации слизистой оболочки желудка, дискоординацией процессов пролиферации и дифференцировки ее клеток при хроническом гастрите. Аденомы желудка возникают на фоне атрофического гастрита в результате перестройки желез и покровного эпителия, появления кишечной метаплазии. Гиперпластические полипы развиваются при нарушении обновления и увеличения продолжительности жизни клеток, из-за избыточной регенерации покровно-ямочного эпителия. Также отмечено, что чаще всего полипы желудка возникают в зонах со сниженной секрецией соляной кислоты (нижняя треть желудка), у больных с гипо- и ахлоргидрией.
Источником неэпителиальных доброкачественных опухолей желудка может быть гетеротопированная эмбриональная ткань, сохранившаяся в слизистой оболочке при нарушении внутриутробного развития.
Симптомы
В половине случаев полипы желудка протекают без клинических проявлений. Симптомы полипов желудка в основном определяются фоновым заболеванием (хроническим гастритом) и осложнениями (изъязвлением верхушки полипа, кровотечением, пролапсом полипа в двенадцатиперстную кишку и непроходимостью привратника).
Боли при полипах желудка обусловлены воспалительным процессом в окружающей его слизистой оболочке, локализуются в эпигастральной области и имеют тупой, ноющий характер. Сначала они возникают после приема пищи, затем становятся постоянными. Могут наблюдаться жалобы на горечь во рту, тошноту и отрыжку. При развитии непроходимости привратника — появляется рвота, при ущемлении полипа – начинаются схваткообразные боли в подложечной области и по всему животу. Изъязвление полипа приводит к умеренному желудочному кровотечению; при этом может выявляться кровь в рвотной массе, дегтеобразный стул, недомогание, бледность кожных покровов, анемия. Малигнизация полипов, как правило, происходит незаметно, поэтому подозрение должны вызвать отсутствие аппетита, похудание, нарастание общей слабости, диспепсические расстройства.
Клинические признаки неэпителиальных доброкачественных опухолей желудка зависят от их локализации, характера и скорости роста, наличия изъязвления поверхности. Чаще всего неэпителиальные опухоли желудка сопровождаются кратковременными и постоянными болями, возникающими натощак, после приема пищи, при изменении положения тела. При невриномах болевой синдром сильный, жгучего характера. Изъязвление опухоли (особенно, гемангиомы) может вызывать скрытые или обильные желудочные кровотечения с угрозой для жизни больного.
Недомогание. Отрыжка. Отсутствие аппетита. Рвота. Рвота пищей. Рвота с кровью. Тошнота. Тошнота после еды.
Диагностика
Диагностировать опухоли желудка позволяют данные анамнеза, рентгенологического и эндоскопического исследований. На наличие полипов при рентгенографии желудка может указывать дефект наполнения, повторяющий очертания опухоли: четкие, ровные контуры, круглую или овальную форму, его смещаемость при наличии ножки или неподвижность – при полипе с широким основанием. В случае полипоза желудка выявляют большое число разных по величине дефектов наполнения. Перистальтика стенок желудка при этом сохраняется. Признаки отсутствия перистальтики, увеличение размера, изменение формы, появление нечеткости контуров дефекта наполнения при динамическом наблюдении могут говорить о малигнизации полипа.
Диагноз уточняется при фиброгастродуоденоскопии (ФГДС), которая позволяет провести визуальный осмотр состояния слизистой оболочки желудка, распознавание и дифференциацию полипов от других заболеваний. Визуальная дифференциация доброкачественного полипа от малигнизированного затруднена. Обычно об озлокачествлении могут свидетельствовать наличие полипа размером более 2 см, с бугристой дольчатой поверхностью, неправильными изъеденными контурами. Для точного определения характера полипа во время ФГДС выполняется биопсия подозрительных участков с морфологическим исследованием биоптатов.
Диагноз неэпителиальной доброкачественной опухоли желудка в большинстве случаев можно установить только после операции и морфологического исследования данного новообразования. Наличие клинических проявлений (например, кровотечения) указывает на возможность опухолевого процесса. ФГДС более информативна при эндогастральном росте неэпителиальных опухолей желудка. При интрамурально или экзогастрально расположенных опухолях при эндоскопическом исследовании определяется сдавление желудка извне.
Рентгенография желудка при неэпителиальных доброкачественных опухолях помогает обнаружить округлые или неправильные контуры дефекта наполнения с сохранением перистальтики и складок на подслизистом слое; экзогастральный рост новообразования с оттягиванием стенки желудка; изъязвление с образованием ниши на верхушке опухоли и тд Для обнаружения экзогастральных опухолей желудка могут быть использованы УЗИ и КТ брюшной полости.
Лечение
Лечение доброкачественных опухолей желудка — только хирургическое; метод оперативного вмешательства зависит от вида, характера опухоли и ее локализации. В отсутствии надежных критериев малигнизации доброкачественных опухолей желудка, необходимо проводить удаление всех выявленных новообразований. Основными методами удаления доброкачественных опухолей желудка в настоящее время являются малоинвазивная эндоскопическая электроэксцизия (или электрокоагуляция), энуклеация, резекция желудка, редко – гастрэктомия.
Эндоскопическая полипэктомия проводится при небольших одиночных полипах, локализующихся в различных отделах желудка: при размере менее 0,5 см — прижиганием с помощью точечного коагулятора, при размере от 0,5 до 3 см — методом электроэксцизии. При крупных одиночных полипах желудка на широком основании выполняют хирургическую полипэктомию (иссечение в пределах слизистой оболочки или со всеми слоями стенки желудка) с предварительной гастротомией и ревизией желудка.
При множественных полипах или подозрении на малигнизацию выполняют ограниченную или субтотальную резекцию желудка. После полипэктомии и резекции существует риск неполного удаления, рецидива и малигнизации опухоли, возможно развитие послеоперационных осложнений и функциональных расстройств. Гастрэктомия может быть показана при диффузном полипозе желудка.
Во время удаления неэпителиальных опухолей желудка проводится срочное гистологическое исследование опухолевых тканей. Небольшие доброкачественные новообразования, растущие в направлении просвета желудка, удаляют эндоскопически; инкапсулированные опухоли вылущивают методом энуклеации. Большие, труднодоступные эндо- и экзогастральные доброкачественные опухоли желудка удаляют методом клиновидной или парциальной резекции, при подозрении на малигнизацию — резекцию производят с соблюдением онкологических принципов.
После удаления доброкачественных опухолей желудка показано динамическое диспансерное наблюдение гастроэнтеролога с обязательным эндоскопическим и рентгенологическим контролем.
Источник
