Гипоталамический синдром с артериальной гипертензией
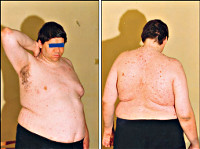
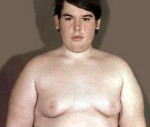
Гипоталамический синдром – комплекс эндокринных, обменных, вегетативных расстройств, обусловленных патологией гипоталамуса. Характеризуется изменением (чаще увеличением) массы тела, головными болями, неустойчивостью настроения, гипертензией, нарушением менструального цикла, повышенным аппетитом и жаждой, усилением или снижением либидо. Для диагностики гипоталамического синдрома проводится расширенное гормональное исследование, ЭЭГ, МРТ головного мозга, при необходимости УЗИ щитовидной железы, надпочечников. Лечение гипоталамического синдрома заключается в подборе эффективной стимулирующей или ингибирующей гормональной терапии, проведении симптоматического лечения.
Общие сведения
Гипоталамический синдром – комплекс эндокринных, обменных, вегетативных расстройств, обусловленных патологией гипоталамуса. Характеризуется изменением (чаще увеличением) массы тела, головными болями, неустойчивостью настроения, гипертензией, нарушением менструального цикла, повышенным аппетитом и жаждой, усилением или снижением либидо. Прогноз зависит от тяжести поражения гипоталамуса: от возможности полного выздоровления до прогрессирования заболевания (развитие выраженного ожирения, стойкой гипертонии, бесплодия и т. д.).
Патология гипоталамической области часто встречается в эндокринологической, гинекологической, неврологической практике, вызывая сложности в диагностике из-за многообразия форм проявления. Гипоталамический синдром чаще развивается в подростковом (13-15 лет) и репродуктивном (31-40 лет) возрасте, преобладая у лиц женского пола (12,5–17,5% женщин).
Проблема медицинской и социальной значимости гипоталамического синдрома определяется молодым возрастом пациентов, быстро прогрессирующим течением заболевания, выраженными нейроэндокринными нарушениями, нередко сопровождающимися частичным снижением или полной утратой трудоспособности. Гипоталамический синдром вызывает серьезные нарушения репродуктивного здоровья женщины, вызывая развитие эндокринного бесплодия, поликистоза яичников, акушерские и перинатальные осложнения.

Гипоталамический синдром
Причины развития гипоталамического синдрома
Гипоталамический отдел головного мозга отвечает за регуляцию гуморальных и нервных функций, обеспечивающих гомеостаз (стабильность внутренней среды). Гипоталамус выполняет роль высшего вегетативного центра, регулирующего обмен веществ, терморегуляцию, деятельность кровеносных сосудов и внутренних органов, пищевое, половое поведение, психические функции. Кроме того, гипоталамус управляет физиологическими реакциями, поэтому при его патологии нарушается периодичность тех или иных функций, что выражается вегетативным кризом (пароксизмом).
Вызывать нарушения деятельности гипоталамуса и развитие гипоталамического синдрома могут следующие причины:
- опухоли головного мозга, сдавливающие гипоталамическую область;
- черепно-мозговые травмы с прямым повреждением гипоталамуса;
- нейроинтоксикации (токсикомания, наркомания, алкоголизм, производственные вредности, экологическое неблагополучие и т. д.);
- сосудистые заболевания, инсульт, остеохондроз шейного отдела позвоночника;
- вирусные и бактериальные нейроинфекции (грипп, ревматизм, малярия, хронический тонзиллит и др.);
- психогенные факторы (стрессы, шоковые ситуации, умственные нагрузки);
- беременность и сопряженные с ней гормональные перестройки;
- хронические заболевания с вегетативными компонентами (бронхиальная астма, гипертония, язвы желудка и двенадцатиперстной кишки, ожирение);
- конституциональная недостаточность гипоталамической области.
Классификация гипоталамического синдрома
Клиническая эндокринология насчитывает большое число исследований по изучению гипоталамического синдрома. Результаты этих исследований легли в основу современной расширенной классификации синдрома.
По этиологическому принципу гипоталамический синдром подразделяется на первичный (вследствие нейроинфекций и травм), вторичный (вследствие конституционального ожирения) и смешанный.
По ведущим клиническим проявлениям выделяют следующие формы гипоталамического синдрома:
- вегетативно-сосудистую;
- нарушения терморегуляции;
- гипоталамическую (диэнцефальную) эпилепсию;
- нейротрофическую;
- нервно-мышечную;
- псевдоневрастеническую и психопатологическую;
- расстройство мотиваций и влечений;
- нейроэндокринно-обменные расстройства.
Выделяют клинические варианты гипоталамического синдрома с преобладанием конституционального ожирения, гиперкортицизма, нейроциркуляторных нарушений, герминативных расстройств.
Тяжесть проявления гипоталамического синдрома может быть легкой, средней и тяжелой формы, а характер развития – прогрессирующий, стабильный, регрессирующий и рецидивирующий. В пубертатном периоде гипоталамический синдром может протекать с задержкой или ускорением полового созревания.
Симптомы гипоталамического синдрома
Проявления гипоталамического синдрома зависят от зоны поражения гипоталамуса (передний или задний отделы) и вызванных нейрогуморальных расстройств в гипоталамо-гипофизарной области. В проявлениях гипоталамического синдрома чаще преобладают следующие нарушения:
- вегетативно-сосудистые – 32%,
- эндокринно-обменные – 27%,
- нервно-мышечные – 10%,
- нарушения терморегуляции и др. — 4% и т. д.
Гипоталамический синдром проявляется общей слабостью, повышенной утомляемостью, физическим и психическим истощением, плохой переносимостью смены метеорологических условий, покалываниями в сердце, склонностью к аллергическим реакциям, неустойчивым стулом, чувством нехватки воздуха, эмоциональными расстройствами (тревогой, приступами панического страха), нарушениями сна, повышенной потливостью. Объективно выявляются тахикардия, асимметрия артериального давления со склонностью к его повышению, тремор пальцев и век.
У большей части пациентов гипоталамический синдром протекает пароксизмально (приступообразно), чаще в виде вагоинсулярных и симпатико-адреналовых кризов. Вазоинсулярные кризы при гипоталамическом синдроме сопровождаются чувством жара, прилива к лицу и голове, головокружением, удушьем, неприятными ощущениями в эпигастрии, тошнотой, замиранием сердца, потливостью, общей слабостью. Может наблюдаться усиленная перистальтика кишечника с послаблением стула, учащенное и обильное мочеиспускание, повторные позывы в туалет. Возможно развитие аллергических проявлений в форме крапивницы и даже отека Квинке. Частота сердечных сокращений урежается до 45-50 уд. в мин., АД снижается до 90/60-80/50 мм рт. ст.
Симпатико-адреналовые кризы при гипоталамическом синдроме могут провоцироваться эмоциональным напряжением, изменением метеоусловий, менструацией, болевыми факторами и др. Пароксизмы обычно возникают внезапно вечером или ночью, иногда им предшествуют предвестники: головная боль, изменение настроения, покалывание в области сердца, вялость. Во время приступа появляется озноб, тремор, «гусиная кожа», сердцебиение, похолодание и онемение конечностей, подъем АД до 150/100-180/110 мм рт. ст., тахикардия до 100-140 уд. в мин. Иногда симпатико-адреналовые кризы сопровождаются повышением температуры до 38-39°С, возбуждением, беспокойством, страхом смерти (паническими атаками).
Продолжительность криза может быть от 15 мин. до 3 и более часов, после чего на протяжении нескольких часов сохраняется слабость и страх повторения подобного приступа. Часто при гипоталамическом синдроме кризы носят смешанный характер, сочетая симптомы вагоинсулярного и симпатико-адреналового кризов.
Нарушение терморегуляции при гипоталамическом синдроме сопровождается развитием гипертермического криза, характеризующегося внезапным скачком температуры тела до 39-40 °С на фоне длительного субфебрилита. Для терморегуляционных нарушений типично утреннее повышение температуры и ее снижение к вечеру, отсутствие эффекта от приема жаропонижающих препаратов. Расстройства терморегуляции чаще наблюдаются в детском и юношеском возрасте и зависят от физического и эмоционального напряжения. У подростков они нередко связаны со школьными занятиями и исчезают в каникулярный период.
Проявлениями терморегуляционных нарушений при гипоталамическом синдроме могут служить постоянная зябкость, непереносимость сквозняков и низких температур. Такие пациенты постоянно кутаются, носят одежду не по погоде, даже в теплое время не открывают форточки и окна, избегают принимать ванну. Расстройство мотиваций и влечений при гипоталамическом синдроме характеризуется эмоционально-личностными нарушениями, различными фобиями, изменением либидо, патологической сонливостью (гиперсомнией) или бессонницей, частой сменой настроения, раздражительностью, гневом, слезливостью и т. д.
Нейроэндокринно-обменные расстройства при гипоталамическом синдроме проявляются нарушением белкового, углеводного, жирового, водно-солевого обмена, булимией, анорексией, жаждой. Нейроэндокринные нарушения могут сопровождаться синдромами Иценко-Кушинга, несахарного диабета с полиурией, полидипсией и низкой относительной плотностью мочи, акромегалией, ранним климаксом у молодых женщин, изменениями в щитовидной железе. Могут наблюдаться дистрофия костей и мышц, нарушения трофики кожи (сухость, зуд, пролежни), изъязвления слизистых внутренних органов (пищевода, 12-перстной кишки, желудка). Для гипоталамического синдрома характерно хроническое или длительное течение с рецидивами и обострениями.
Осложнения гипоталамического синдрома
Диагностика гипоталамического синдрома
Полиморфная клиника гипоталамического синдрома представляет немалые трудности в его диагностике. Поэтому ведущими критериями диагностики гипоталамического синдрома служат данные специфических тестов: сахарной кривой, термометрии в трех точках, ЭЭГ головного мозга, трехдневной пробы Зимницкого.
Глюкозу крови при гипоталамическом синдроме исследуют натощак и с нагрузкой 100 г сахара, определяя уровень глюкозы через каждые 30 минут. При гипоталамическом синдроме встречаются следующие варианты сахарной кривой:
- гипергликемический (подъем уровня глюкозы выше нормы);
- гипогликемический (содержание глюкозы ниже нормы);
- двугорбовый (снижение уровня глюкозы чередуется с новым подъемом);
- торпидный (небольшой подъем глюкозы фиксируется в одной точке).
Термометрию при гипоталамическом синдроме проводят в трех точках: обеих подмышечных впадинах и в прямой кишке. Термометрические нарушения могут выражаться в изотермии (равной температуре в прямой кишке и подмышечных областях, при норме в прямой кишке на 0,5-1°С выше); гипо- и гипертермии (в подмышечных впадинах температура ниже или выше нормы); термоинверсии (температура в прямой кишке ниже, чем в подмышечных впадинах).
Электроэнцефалография выявляет изменения, затрагивающие глубинные структуры мозга. В трехдневной пробе по Зимницкому у пациентов с гипоталамическим синдромом изменяется соотношение выпитой и выделяемой жидкости, ночного и дневного диуреза. Методом МРТ головного мозга при гипоталамическом синдроме выявляется повышенное внутричерепное давление, последствия гипоксии и травм, опухолевые образования.
Обязательным критерием диагностики гипоталамического синдрома является определение гормонов (пролактина, ЛГ, эстрадиола, ФСГ, тестостерона, кортизола, ТТГ, Т4 (свободного тироксина), адренотропного гормона в крови и 17-кетостероидов в суточной моче) и биохимических показателей для выявления эндокринно-обменных нарушений. Дифференцировать гипоталамический синдром с органическим поражением других систем позволяет УЗИ надпочечников, УЗИ щитовидной железы и внутренних органов. При необходимости дополнительно проводится МРТ или КТ надпочечников.
Лечение гипоталамического синдрома
Комплекс мероприятий по лечению гипоталамического синдрома должен осуществляться совместными усилиями эндокринолога, невролога и гинеколога (у женщин). Подбор методов лечения гипоталамического синдрома всегда индивидуален и зависит от ведущих проявлений. Целью терапии гипоталамического синдрома является коррекция нарушений и нормализация функции гипоталамических структур головного мозга.
На первом этапе лечения проводят устранение этиологического фактора: санацию инфекционных очагов, лечение травм и опухолей и т. д. При интоксикациях алкоголем, наркотиками, инсектицидами, пестицидами, тяжелыми металлами проводится активная дезинтоксикационная терапия: внутривенно вводятся солевые растворы, тиосульфат натрия, глюкоза, физиологический раствор и др. Для профилактики симпатико-адреналовых кризов назначаются пирроксан, алкалоиды красавки + фенобарбитал, сульпирид, тофизопам, антидепрессанты (тианептин, амитриптилин, миансерин и др.).
Нейроэндокринные нарушения корректируются заместительными, стимулирующими или тормозящими гормональными препаратами, назначением диеты и регуляторов нейромедиаторного обмена (бромокриптин, фенитоин) курсом до полугода. При развитии посттравматического гипоталамического синдрома проводят дегидратирующую терапию, цереброспинальную пункцию. При нарушениях обмена назначается диетотерапия, анорексанты, витамины.
При гипоталамическом синдроме назначаются средства, улучшающие мозговое кровообращение (пирацетам, гидрализат головного мозга свиней, винпоцетин), витамины группы В, аминокислоты (глицин), препараты кальция. В лечение гипоталамического синдрома включают рефлексотерапию, физиопроцедуры, лечебную гимнастику. В структуре лечения гипоталамического синдрома важная роль отводится нормализации режима отдыха и работы, диете, нормализации массы тела, курортотерапии.
Прогноз и профилактика гипоталамического синдрома
Гипоталамический синдром может приводить к снижению и утрате работоспособности в случаях часто повторяющихся вегетативных пароксизмов. Таким пациентам с учетом их профессиональной деятельности может устанавливаться инвалидность III группы. Резко выраженные нейроэндокринно-обменные формы гипоталамического синдрома также могут приводить к потере трудоспособности с установлением III или II группы инвалидности.
Поскольку кризы при гипоталамическом синдроме, как правило, возникают в определенное время и при изменениях метеоусловий, значительных эмоциональных и физических перенапряжениях, их профилактика заключается в предупреждающем приеме седативных средств, антидепрессантов, транквилизаторов. Также, по возможности, необходимо исключить провоцирующие приступы факторы, нервно-психические и физические нагрузки, работу в ночные смены.
Источник
Сибирский медицинский журнал, 2010, Том 25, №2, Выпуск 1
нием эффекторных клеток интимы сосудов и крови (повышение содержания малонового диальдегида в и анти-оксидантной активности плазмы крови, вероятность изменения показателей (Р) составляет 0,57-0,76, коэффициент детерминации (R2) — 0,55-0,61). Установлено истощение резервов адаптации антиокислительной системы по развитию интоксикации (увеличение содержания дельта-аминолевулиновая кислота в моче, Р=0,87, R2=0,75; тенденция к снижению содержания общего белка, Р=0,77, R2=0,45). Доказано прямое нейротоксическое действие бензола на ЦНС, обуславливающее нарушение синтеза гормонов, контролируемых гипоталамо-гипофи-зарной осью, в результате чего развивается нейроэндок-ринная дисрегуляция (повышение содержания тиреот-ропного гармона и кортизола, снижение Т4своб Р=0,62-0,78, R2=0,44^0,66) и, как следствие, электролитный дисбаланс в организме (понижение содержания калия, R2=0,56^0,62), обуславливающий нарушение внутрисер-дечной проводимости и дисрегуляцию сердечных сокращений.
Таким образом, установлены патогенетические звенья развития ВСД у детей, характеризующиеся истощением антиоксидантной и нейроэндокринной систем, обусловленным негативным воздействием повышенной контаминации биосред углеводородами.
ОСОБЕННОСТИ ТЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ ПРИ ГИПОТАЛАМИЧЕСКОМ СИНДРОМЕ У ПОДРОСТКОВ
Зурбанова Л.В., Долгих В.В., Рычкова Л.В., Погодина А.В.
Учреждение РАМН Научный центр проблем здоровья семьи и репродукции человека СО РАМН, Иркутск
Цель исследования: изучение влияния гипоталамичес-кой дисфункции на течение артериальной гипертензии (АГ) в подростковом возрасте.
Материал и методы. В течение двух лет на базе Клиники НЦ ПЗС РЧ СО РАМН проводилось динамическое наблюдение за 125 подростками (86 мальчиков и 39 девочек) в возрасте от 12 до 16 лет, страдающими АГ. Все подростки были распределены на 2 группы: I группу (n=82) составили подростки с избыточной массой тела, в том числе с ожирением I—III ст. (индекс массы тела > 25,1). Во II группу (n=43) вошли больные без признаков гипо-таламического синдрома (ГС), не имеющие избыточной массы тела. У всех детей I группы по клиническим признакам была диагностирована гипоталамическая дисфункция в активной фазе, имеющая прогрессирующее течение. Оценка объективного клинического статуса детей проводилась с применением методов физикального обследования. По результатам суточного мониторирования АД (СМАД) лабильная АГ (ЛАГ) диагностировалась, если средние цифры систолического и диастолического АД (САД и ДАД соответственно) в течение суток не были повышены, индекс времени гипертензии (ИВГ) находился в пределах 25-50%. Стабильная АГ (САГ) диагностировалась при повышении средних цифр АД, ИВГ более 50%. Дополнительно для исключения симптоматических АГ проводилось допплерографическое исследование сосудов почек, эхокардиография, МРТ-головного мозга,
консультации невропатолога, эндокринолога, окулиста, нефролога. Лабораторные исследования включали в себя развернутый биохимический анализ, оценку электролитного состава и гормонального спектра крови. Статистическую обработку данных проводили с использованием пакета программ «^аИБЙеа». Различия считались статистически значимыми при р<0,05.
Результаты. При первом обследовании как в I, так и во II группе преобладали подростки с жалобами на тран-зиторное повышение уровня АД и жалобами общевегетативного характера, т.е. подростки с нейроциркулятор-ной дистонией (НЦД) по гипертензивному типу. В I группе данный характер повышения АД был диагностирован у 50 (61,0%) подростков, во II группе у 27 (62,8%) подростков. Лабильная АГ была диагностирована у 21 (25,6%) подростка I группы и у 9 (20,9%) подростков II группы. Количество подростков, у которых при первичном обследовании по данным СМАД было выявлено стабильное повышение уровня АД, в обеих группах было невысоким и составило 11 (13,4%) детей в I группе и 7 (16,3%) детей во II группе. При анализе полученных данных мы не получили статистически значимых различий (%2 = 0,433; р=0,805) по характеру повышения АД в исследуемых группах.
В ходе проведения первичного обследования среди биохимических показателей крови у подростков с АГ и ГС выявлено достоверно (р<0,05) более высокое содержания в сыворотки крови общего холестерина (ОХ) 4,09+0,71 ммоль/л и триглицеридов (ТГ) 0,87+0,18 ммоль/л в сравнении со II группой (3,58+0,61 ммоль/л и 0,78+0,13 ммоль/л соответственно). Также обнаружено, что уровень мочевой кислоты сыворотки крови у всех больных I группы достоверно (р<0,05) превышал аналогичные значения у подростков II группы (292,63+118,27 и 203,84+83,37 мкмоль/л соответственно). При оценке уровня ЛПВП было выявлены более низкие его значения у подростков I группы, по сравнению со второй (1,16+0,22 и 1,22+0,14 ммоль/л соответственно), без достоверных различий.
Нарушение толерантности к глюкозе было выявлено у 24,4% детей с ГС, что в 3,5 раза больше, чем во II группе — 7,0%.
При оценке гормонального статуса подростков в обследуемых группах было выявлено статистически достоверное повышение в сыворотке крови у подростков I группы уровня пролактина 561,26+259,19 мЕД/мл, в то время как во II группе уровень данного гормона составил 342,11+139,29 мЕД/мл. Также у подростков I группы отмечается повышенная секреция кортизола в сравнении с подростками II группы (р<0,05). Содержание кортизола в I группе составило 610,34+226,34 нМ/л, во II группе -405,91+155,89 нМ/л. Уровень тиреотропного гормона (ТТГ) и тиреоидных гормонов у детей в обследуемых группах не превышал нормативных значений, но уровень свободного тироксина (12,28+3,19 пМ/л) в I группе был достоверно ниже, чем во II группе (14,59+3,53 пМ/л).
Через два года динамического наблюдения в группе подростков с ГС нормализация АД произошла в 14 (17,1%) случаев, диагноз НЦД по гипертензивному типу был оставлен у 27 (32,9%) пациентов, у 12 (14,6%) и 29 (35,4%) подростков сформировалась ЛАГ и САГ соответственно. В то же время во II группе АД нормализовалось у 16 (37,2%) детей, у 15 (34,9%) остались признаки НЦД по
Материалы Международной конференции «Современная кардиология: эра инноваций»
гипертензивному типу, ЛАГ была диагностирована у 5 (11,6%) подростков, а стабилизация повышенного уровня АД по результатам СМАД произошла у 7 (16,3%) пациентов. При статистическом анализе полученных данных были выявлены значимые различия между двумя исследуемыми группами (х2 = 8,553; р=0,046).
Заключение. Результаты исследования показали, что подростки с АГ, возникающей на фоне ГС, имеют ряд нарушений в биохимическом, электролитном и гормональном статусах, которые прогностически неблагоприятно влияют на течение АГ. Таким образом, нельзя недооценивать гипоталамическую дисфункцию, которая играет важную роль в прогнозировании течения АГ в подростковом возрасте, т.к. является одним из основных факторов риска формирования САГ у подростков.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ШКАЛ РИСКА РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОВ С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ
Зыков М.В.
Учреждение РАМН НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН, Кемерово
С целью прогнозирования летальных исходов инфаркта миокарда (ИМ) в настоящее время предложено множество шкал. В 2000 году с целью стратификации стратификации риска 30-дневной летальности для пациентов с острым коронарным синдромом с подъёмом сегмента ST (ОКСпБТ), подвергшихся тромболитической терапии (ТЛТ), предложена шкала TIMI risk score, включающая в себя такие показатели, как возраст, уровень систолического артериального давления (САД), частоту сердечных сокращений (ЧСС), класс острой сердечной недостаточности (ОСН) по классификации Killip, локализация ИМ или блокада левой ножки пучка Гиса (ЛНПГ), масса тела, время от момента заболевания до начала лечения, наличие в анамнезе стенокардии, артериальной гипертензии (АГ), сахарного диабета (СД). Показатель диагностической значимости (С-статистика) шкалы TIMI составил 0,78. В 2004 году в клиниках Португалии разработана модель определения риска смертельного исхода инфаркта миокарда PAMI у пациентов, подвергшихся ангиопластике. Она включает в себя бальную оценку следующих параметров: наличие анемии, возраст пациентов, трёхсо-судистое поражение коронарного русла, частоту сердечных сокращений, класс ОСН по Killip, наличие переднего ИМ или блокады ЛНПГ, СД. Опубликованная в 2005 году шкала CADILLAC также предполагает её использование у пациентов, подвергшихся процедуре реваскуля-ризации симптом зависимого поражения коронарных артерий, в дополнение учитывает фактор возраста, класс ОСН по Killip, наличие почечной дисфункции и снижение фракции выброса левого желудочка (ФВ ЛЖ) по Эхо-кардиографии (ЭхоКГ). Относительно недавно в кардиологическую практику вошла шкала GRACE, созданная на выборке в 22 120 пациентов. Данная шкала продемонстрировала очень хорошие прогностические возможности: показатель С-статистика в отношении стратификации риска смерти в течение 6 месяцев составил 0,81, а госпи-
тальной летальности — 0,82, что подтвердилось при ва-лидизации данной модели на базе данных GUSTO IIb. Данная шкала учитывает фактор возраста и класс ОСН по Killip, показатели гемодинамики (ЧСС и САД), уровень креатинина крови, а также наличие нарушения проводимости, повышение кардиоспецифических ферментов и элевацию сегмента ST на электрокардиограмме при поступлении пациента в клинику. Однако ни одна из представленных выше моделей не даёт точного прогноза, кроме того, только шкала GRACE учитывает несмертельные осложнения острого коронарного синдрома. Тем не менее, в математической статистике существуют методы, позволяющие оценить как диагностическую значимость моделей, так и вероятность возникновения исследуемых событий. Следует предположить различную диагностическую ценность данных методик определения риска летального исхода в зависимости от особенностей лечения пациентов в клиниках с учётом разных демографических факторов. Так, например, в исследовании Lev E.I. показано, что для пациентов Израиля наибольшей точностью прогноза обладает шкала CADILLAC, а наименьшей — GRACE. Цель исследования: провести сравнительную оценку известных шкал риска неблагоприятного исхода у пациентов с острым коронарным синдромом с подъёмом сегмента ST (ОКС^Т) на популяции г. Кемерово и создать собственную модель прогноза (Kem-Score). Материал и методы исследования: В 2008 году в регистр OK&ST Кемеровскоого кардиологического диспансера (ККД) включили 529 пациентов. Всем больным проведена оценка клинико-анамнестических данных, результатов рутинных методов обследования и лечения, подсчитаны баллы по шкалам TIMI и GRACE, а 243 пациентам, которым проводили первичное чрескожное коронарное вмешательство (ЧКВ), — по шкалам CADILLAC и PAMI. Через 6 и 12 месяцев у 354 пациентов оценили объём принимаемой медикаментозной терапии и прогноз. Статистическая обработка осуществлялась в программе SPSS Statistics 17.0 (США). Анализ прогностических моделей провели с помощью регрессии по Коксу. В последующем рассчитывали Хи-квадрат, отражающий зависимость между ожидаемыми и наблюдаемыми частотами, и значение площади под ROC-кривой (С-стати-стика), определяющий диагностическую ценность исследуемых шкал. По данным литературы диагностически значимым является показатель превышающий 0,70. Результаты и их обсуждение: Все оцениваемые шкалы учитывают фактор возраста и класс тяжести ОСН по Killip. В отношении стратификации риска 30-дневной летальности получены следующие значения площади под ROC-кривой: для CADILLAC 0,63 (0,43;0,83), для PAMI 0,63 (0,49;0,78), для TIMI 0,69 (0,61;0,77) при этом критерий Хи-квадрат составил 14,8, 27,5 и 84,3 соответственно для каждой шкалы при р<0,001. Таким образом, все используемые модели характеризуются низкими показателями диагностической ценности, несколько лучше для пациентов города Кемерово показала себя шкала TIMI, применение которой изначально предполагалось только для пациентов подвергшихся ТЛТ. Данный факт, возможно, объясняется использованием в ней наибольшего количества параметров (10 против 5 и 8 у CADILLAC и PAMI соответственно). В отношении прогнозирования риска госпитальной летальности наибольшей диагностической значимостью обладает шкала GRACE, так площадь под
Источник
