Гемолитико уремический синдром при беременности
В статье приводится описание клинического наблюдения развития атипичного гемолитико-уремического синдрома у молодой женщины в третьем триместре беременности с резким ухудшением состояния после родоразрешения.
Атипичный гемолитико-уремический синдром (аГУС) – это орфанное системное заболевание, обусловленное неконтролируемой активацией комплемента из-за генетического дефекта белков – регуляторов активности комплемента (фактор H, фактор I, мембранный кофакторный протеин – MCP, фактор B и др.) или образования антител к фактору H. Следствием неконтролируемой активации комплемента является тромботическая микроангиопатия (ТМА) – образование тромбов и повреждение эндотелия в микроциркуляторном русле различных органов, преимущественно почек и головного мозга, клиническими проявлениями которого являются тромбоцитопения, микроангиопатическая гемолитическая анемия, почечное повреждение и поражение других органов-мишеней [1]. Таким образом, аГУС является комплемент-опосредованной ТМА. Однако существуют и другие формы ТМА: типичный ГУС, ассоциированный с шига-токсином E. coli, тромботическая тромбоцитопеническая пурпура (ТТП), обусловленная дефицитом металлопротеазы ADAMTS13, расщепляющей сверхкрупные мультимеры фактора фон Виллебранда, а также вторичные ТМА, связанные с аутоиммунными заболеваниями (например, катастрофический антифосфолипидный синдром), применением некоторых лекарственных препаратов или беременностью (HELLP-синдром – крайне тяжелая форма преэклампсии с гемолизом, повышением печеночных ферментов и тромбоцитопенией).
ТМА представляет собой важную причину острого почечного повреждения (ОПП) при беременности, составляя не менее 9% всех причин акушерского ОПП и являясь при этом наряду с другими факторами предиктором развития хронической болезни почек [2]. Необходимо помнить, что ОПП при беременности имеет очень серьезный прогноз: летальность плода/новорожденного достигает 39%, материнская летальность – 20% [3].
Беременность сама по себе является триггером развития ТМА. Например, по данным французских авторов, из 100 взрослых женщин с аГУС клинический дебют заболевания был связан с беременностью у 21 пациентки, при этом развитие симптоматики в послеродовом периоде отмечено у 79% этих больных [4]. Физиологически протекающая беременность сопровождается умеренной активацией системы комплемента, но плацента обладает локальными механизмами защиты против эффектов комплемента, ведущим из которых является экспрессия на поверхности трофобласта белка DAF (decay accelerating factor), а также MCP (membrane cofactor protein) и молекулы CD59 [5]. После родов устранение механизма антикомплементарной защиты, связанного с плацентой, кровотечение, инфекционные осложнения могут стать триггером неконтролируемой активации комплемента у женщин с мутациями генов-регуляторов комплемента, именно поэтому манифестация аГУС так часто наблюдается именно в послеродовом периоде [6]. Однако развитие аГУС возможно и во время беременности: в отечественной и зарубежной литературе описаны случаи манифестации этого заболевания в третьем, втором и даже в первом триместрах [4, 7, 8], поэтому срок беременности или послеродовый период не является определяющим фактором дифференциальной диагностики аГУС и других ТМА.
Первой линией терапии аГУС является лечение свежезамороженной плазмой (СЗП) в режиме плазмообмена (ПО) и/или инфузий, но акушерский аГУС отличается тяжелым течением с нередкой резистентностью к плазмотерапии или только частичным ответом на лечение СЗП. Исходы аГУС, ассоциированного с беременностью, у пациенток, получавших плазмотерпию, нельзя назвать удовлетворительными: у 62% больных терминальная хроническая почечная недостаточность развивается в первый месяц болезни, у 76% – при последующем наблюдении [4]. С другой стороны, растет число публикаций с описаниями клинических наблюдений весьма эффективного применения при акушерском аГУС экулизумаба – препарата моноклональных антител против С5-компонента комплемента. В большинстве этих наблюдений сначала проводилась плазмотерапия с частичным ответом и только последующее лечение экулизумабом вызывало полную гематологическую ремиссию аГУС, существенное улучшение функции почек и положительную динамику со стороны других пораженных органов [9–11].

Представляем собственное клиническое наблюдение.
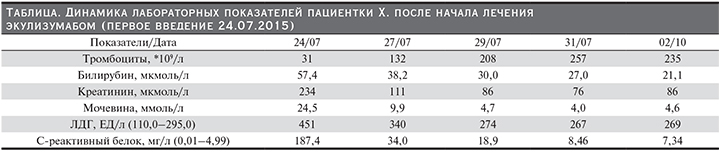
Б о л ь н а я Х. 1991 г.р. (23 года) 13.07.2015 поступила в Московский областной перинатальный центр при сроке беременности 35–36 недель с жалобами на плохое самочувствие, головную боль, повышение АД. Из анамнеза было известно, что женщина ранее считала себя здоровой. Данная беременность первая, наступила спонтанно, первый и второй ее триместры протекали без осложнений. При сроке беременности 28 недель отмечено появление небольшой протеинурии (0,3–0,5 г/сут). При сроке 32–33 недели получала лечение в дневном стационаре по месту жительства по поводу фетоплацентарной недостаточности.
В перинатальном центре проведено экстренное обследование. Общее состояние средней тяжести. Сознание ясное. Пер…
1. Noris M., Remuzzi G. Atypical hemolytic-uremic syndrome. N. Engl. J. Med. 2009; 361:1676–1687.
2. Gopalakrishnan N., Dhanapriya J., Muthukumar P., Sakthirajan R., Dineshkumar T., Thirumurugan S., Balasubramaniyan T. Acute kidney injury in pregnancy – a single center experience. Ren. Fail. 2015;37(9):1476–1480.
3. Prakash J., Niwas S.S., Parekh A., Pandey L.K., Sharatchandra L., Arora P., Mahapatra A.K. Acute kidney injury in late pregnancy in developing countries. Ren. Fail. 2010;32:309–313.
4. Fakhouri F., Roumenina L., Provot F., Sallée M., Caillard S., Couzi L., Essig M., Ribes D., Dragon-Durey M.A., Bridoux F., Rondeau E., Frémeaux-Bacchi V. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J. Am. Soc. Nephrol. 2010;21:859–867.
5. Girardi G., Bulla R., Salmon J.E., Tedesco F. The complement system in the pathophysiology of pregnancy. Mol. Immunol. 2006;43(1–2):68–77.
6. Fakhouri F., Vercel C., Frémeaux-Bacchi V. Obstetric nephrology: AKI and thrombotic microangiopathies in pregnancy. Clin. J. Am. Soc. Nephrol. 2012;7(12):2100–2106.
7. Козловская Н.Л., Меркушева Л.И., Кирсанова Т.В., Рунихина Н.К. Особенности течения и исхода атипичного гемолитико-уремического синдрома при беременности. Клиническая нефрология. 2012;3:44–49.
8. Коротчаева Ю.В., Козловская Н.Л., Бондаренко Т.В., Веселов Г.А. «Акушерский» атипичный гемолитико-уремический синдром: трудный диагноз? Архив акушерства и гинекологии им. В.Ф. Снегирева. 2015;2:36–41.
9. Ardissino G., Wally Ossola M., Baffero G.M., Rigotti A., Cugno M. Eculizumab for atypical hemolytic uremic syndrome in pregnancy. Obstet. Gynecol. 2013;122:487–489.
10. Kourouklaris A., Ioannou K., Athanasiou I., Panagidou A., Demetriou K., Zavros M. Postpartum thrombotic microangiopathy revealed as atypical hemolytic uremic syndrome successfully treated with eculizumab: a case report. J. Med. Case Rep. 2014;8:307–311.
11. Mussoni M.P., Veneziano F.A., Boetti L., Tassi C., Calisesi C., Nucci S., Rigotti A., Panzini I., Ardissino G. Innovative therapeutic approach: sequential treatment with plasma exchange and eculizumab in a pregnant woman affected by atypical hemolytic-uremic syndrome. Transfus. Apher. Sci. 2014;51(2):134–136.
12. Berrya E.L., Iqba S.N. HELLP syndrome at 17 weeks gestation: a rare and catastrophic phenomenon. J. Clin. Gynecol. Obstet. 2014;3(4):147–150.
13. Fang C.J., Richards A., Liszewski M.K., Kavanagh D., Atkinson J.P. Advances in understanding of pathogenesis of aHUS and HELLP. Brit. J. Haematol. 2008;143:336–348.
14. Демьянова К.А., Козловская Н.Л., Шилов Е.М., Боброва Л.А., Козлов Л.В., Сорокин Ю.Д., Рощупкина С.В., Никифорова Н.В., Добросмыслов И.А., Романова М.Д., Киреева В.А., Кучиева А.М. Изменения в системе комплемента у больных с «катастрофическим» антифосфолипидным синдромом. Тер. архив. 2014;6:30–37.
15. Cataland S.R., Wu H.M. How I treat: the clinical differentiation and initial treatment of adult patients with atypical hemolytic uremic syndrome. Blood. 2014;123(16):2478–2484.
16. Fang C.J., Fremeaux-Bacchi V., Liszewski M.K., Pianetti G., Noris M., Goodship T.H., Atkinson J.P. Membrane cofactor protein mutations in atypical hemolytic uremic syndrome (aHUS), fatal Stx-HUS, C3 glomerulonephritis, and the HELLP syndrome. Blood. 2008;111(2):624–632.
17. Burwick R.M., Feinberg B.B. Case report eculizumab for the treatment of preeclampsia/HELLP syndrome. Placenta. 2013;34:201–203.
18. Zikos T.A., Sokolove J., Ahuja N., Berube C. Eculizumab induces sustained remission in a patient with refractory primary catastrophic antiphospholipid syndrome. J. Clin. Rheumatol. 2015;21(6):311–313.
19. De Sousa Amorim E., Blasco M., Quintana L. Eculizumab in pregnancy-associated atypical hemolytic uremic syndrome: insights for optimizing management. J. Nephrol. 2015;28(5):641–645.
Информация об авторах:
Прокопенко Е.И. – профессор кафедры трансплантологии, нефрологии
и искусственных органов ФУВ МОНИКИ им. М.Ф. Владимирского, д.м.н.
E-mail: renalnephron@gmail.com
Лихванцев В.В. – профессор, руководитель отделения реаниматологии МОНИКИ им. М.Ф. Владимирского, д.м.н.
Ватазин А.В. – профессор, руководитель отдела трансплантологии, нефрологии и хирургической гемокоррекции МОНИКИ им. М.Ф. Владимирского, д.м.н.
Лопатин А.Ф. – доцент кафедры анестезиологии и реаниматологии ФУВ, старший научный сотрудник отделения реаниматологии МОНИКИ им. М.Ф. Владимирского, к.м.н.,
Гурьева В.М. – ведущий научный сотрудник акушерского физиологического отделения МОНИИАГ, д.м.н.
Островский Е.И. – заведующий отделением кардиопульмонологии МОНИКИ им. М.Ф. Владимирского, к.м.н.
Фомин А.М. – профессор, заведующий отделением хирургической гемокоррекции и детоксикации МОНИКИ им. М.Ф. Владимирского, д.м.н.
Улиткина О.Н. – врач-анестезиолог-реаниматолог отделения реаниматологии МОНИКИ им. М.Ф. Владимирского
Источник
Известно, что развитие атипичного гемолитико-уремического синдрома (аГУС) может быть связано с беременностью, являющейся триггерным фактором для дебюта наследственной болезни системы комплемента. Однако при беременности возможно развитие тяжелого осложнения гестоза – HELLP-синдрома, также представляющего собой тромботическую микроангиопатию (ТМА). Нередко возникают трудности в дифференциальной диагностике HELLP-синдрома и аГУС во время беременности и в послеродовом периоде.
Автором делается попытка осмыслить патогенез двух патологических состояний и представить критерии дифференциальной диагностики.
Если в случае аГУС заинтересованность альтернативного пути активации комплемента не вызывает сомнений, то при преэклампсии и HELLP-синдроме активация системы комплемента хоть и происходит, но не единственный и уж точно главный патогенетический путь развития патологического процесса. Однако включение именно данного пути существенно сближает клиническую картину аГУС и HELLP-синдрома.
Одним из аргументов в пользу дифференциальной диагностики служит то обстоятельство, что HELLP-синдром после родов в большинстве случаев полностью нивелируется, тогда как большинство случаев аГУС манифестирует в течение первых 3 месяцев после родов. Вместе с тем наибольшие трудности возникают в ситуациях, когда аГУС развивается в третьем триместре и протекает с поражением печени, напоминая клинические проявления HELLP-синдрома, а HELLP-синдром возникает в послеродовом периоде или, возникнув во время беременности, не купируется в послеродовом периоде.
Процесс дифференциальной диагностики может быть также затруднен в случаях развития поражения печени при аГУС. Возможности терапии аГУС, ассоциированного с беременностью, с применением экулизумаба позволяет эффективно контролировать заболевание у данной категории пациентов.
Известно, что развитие атипичного гемолитико-уремического синдрома (аГУС) может быть связано с беременностью, являющейся триггерным фактором для дебюта наследственной болезни системы комплемента. Отмечено, что аГУС примерно в 10–15% случаев манифестируется у женщин во время беременности и в послеродовом периоде [1, 2].
Однако при беременности возможно развитие тяжелого осложнения гестоза – HELLP-синдрома, также представляющего собой тромботическую микроангиопатию (ТМА). Таким образом, в основе патогенеза обоих заболеваний лежит один и тот же патологический процесс при разнице причинных факторов. Нередко возникают трудности в дифференциальной диагностике HELLP-синдрома и аГУС во время беременности и в послеродовом периоде [3–5].
Отмечается нечастое развитие ТМА во время беременности, регистрируется 1 случай на 25 тыс. беременностей [6], а распространенность HELLP-синдрома при беременности колеблется от 0,2 до 0,8%, в случае развития преэкламспии повышается до 10–20% [7–9]. Вместе с тем высокий удельный вес тяжелых осложнений и исходов этого патологического процесса требует эффективной дифференциальной диагностики и лечения.
Автором делается попытка осмыслить патогенез двух патологических состояний и представить критерии дифференциальной диагностики.
Генетическая составляющая этиологии аГУС и HELLP-синдрома
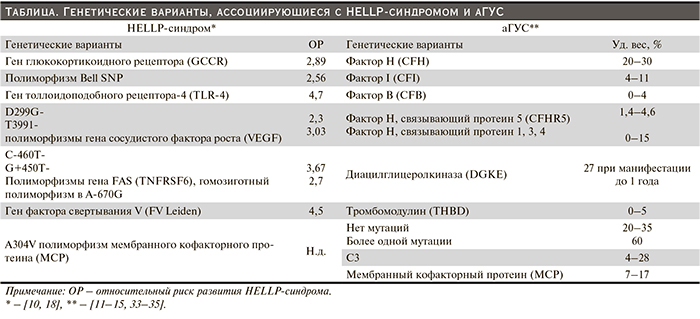
Несмотря на разницу генетических профилей аГУС и HELLP-синдрома (табл. 1), следует отметить, что 30–50% случаев при аГУС генетическая аномалия вообще не обнаруживается, что свидетельствует скорее о наличии еще не изученных аномалий, нежели о приобретенном характере заболевания. При HELLP-синдроме такой статистики вообще не имеется.
В ряде генетических исследований, после того как из анализа исключался риск развития преэклампсии, не было показано ассоциации генетических полиморфизмов с риском развития HELLP-синдрома. В частности, указывалось, что в большинстве случаев HELLP-синдром протекает на фоне преэкслампсии и выделение случаев синдрома без преэклампсии приводило к следующему выводу: генетические аномалии ассоциируются с преэклампсией, а не с HELLP-синдромом [16, 17].
Более того, в 10% случаев обнаружены мутации генов, свойственные аГУС, при HELLP-синдроме [18, 19], что позволяет думать о наличии как минимум двух объяснений данной находке – либо аГУС принят ошибочно за HELLP-синдром, либо существуют сочетанные формы или трансформационные варианты этой патологии. Последнее было оформлено предположением в статье H.-M. Tsai (2014), по мнению которого существует возможность старта патологии с HELLP-синдрома во время беременности с последующей трансформацией в аГУС в послеродовом периоде [20].
Патогенетическая составляющая общности и различий аГУС и HELLP-синдрома
Активация системы комплемента при беременности может рассматриваться как физиологически обусловленная. При физиологической беременности сывороточные уровни С3 и С4, а также общий гемолитический комплемент (СН50) повышаются на 10–50% от нормальных величин, что рассматривается как физиологическая легкая гиперактивность системы комплемента [21, 22].
Несмотря на то что при беременности отмечается повышение активности факторов активации компонентов комплемента в крови [23], в мембране трофобласта наблюдается повышенная экспрессия регуляторных белков, снижающих активность системы комплемента, что позволяет реализовать ее нормальное функционирование во время физиологической беременности [24]. К их числу относятся DAF (decay accelerating protein – фактор ускорения распада), МСР (мембранный кофакторный белок) и CD59. Как известно, DAF и МСР регулируют (ингибируют) активность С3-компонента комплемента, а CD59 предотвращает сборку мембранатакующего комплекса (МАС) [25].
При преэклампсии наблюдается более выраженная, чем при физиологической беременности, активация системы комплемента по классическому и альтернативному путям, отмечается повышение в крови уровней С3а, С4d, растворимого С5b-9. Также активация комплемента происходит и при HELLP-синдроме [26–28].
R. Rampersad и соавт. (2008) обнаружили ассоциацию компонентов С5b-9 МАС на трофобласте с фибриновыми депозитами в поврежденных ворсинах нормальной плаценты, но гораздо выраженнее процесс наблюдался при преэклампсии [29]. Вместе с тем, несмотря на явные признаки гиперактивности системы комплемента при преэклампсии и HELLP-синдроме, в исследованиях нет четкого ответа на вопрос: является ли активация системы комплемента причиной, или следствием плацентарного повреждения…
- Besbas N., Karpman D., Landau D., Loirat C., Proesmans W., Remuzzi G., Rizzoni G., Taylor C.M., Van de Kar N., Zimmerhackl L.B.; European Paediatric Research Group for HUS.A classification of hemolytic uremic syndrome and thrombotic thrombocytopenic purpura and related disorders. Kidney Int. 2006;70:423–31.
- Noris M., Remuzzi G. Atypical hemolytic-uremic syndrome. N. Engl. J. Med. 2009;361:1676–87.
- Козловская Н.Л., Меркушева Л.И., Кирсанова Т.В., Рунихина Н.К. Особенности течения и исхода атипичного гемолитико-уремического синдрома при беременности. Клиническая нефрология. 2012;3:44–9.
- Noris M., Remuzzi G. Genetics and genetic testing in hemolyticuremic syndrome/thrombotic thrombocytopenic purpura. Semin. Nephrol. 2010;30:395–408.
- Owens M.Y., Martin Jr. J.N., Wallace K., Keiser S.D., Parrish M.R., Tam Tam K.B., Martin R.W. Postpartum thrombotic microangiopathic syndrome. Transfusion and Apheresis Science. 2013;48:51–7.
- Dashe J.S., Ramin S.M., Cunningham F.G. The long-term consequences of thrombotic microangiopathy (thrombotic thrombocytopenic purpura and hemolytic uremic syndrome) in pregnancy. Obstet. Gynecol. 1998;91:662–8.
- Sibai B.M. Diagnosis, controversies, and management of the syndrome of hemolysis, elevated liver enzymes, and low platelet count. Obstet. Gynecol. 2004;103:981–9.
- Haram K. The HELLP syndrome: clinical issues and management. A review. BMC Pregnancy Childbirth. 2009;9(1):8.
- Steegers E.A., von Dadelszen P., Duvekot J.J., Pijnenborg R. Pre-eclampsia. Lancet. 2010;376(9741):631–44.
- Abildgaard U., Heimdal K. Pathogenesis of the syndrome of hemolysis, elevated liver enzymes, and low platelet count (HELLP): a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 2013;166:117–23.
- Fremeaux-Bacchi V., Fakhouri F., Garnier A. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide french series comparing children and adults. Clin. J. Am. Soc. Nephrol. 2013;8:554–62.
- Maga T.K., Nishimura C.J., Weaver A.E. Mutations in alternative pathway complement proteins in American patients with atypical hemolytic uremic syndrome. Hum. Mutat. 2010;31:1445–60.
- Westra D., Vernon K.A., Volokhina E.B. Atypical hemolytic uremic syndrome and genetic aberrations in the complement factor H-related 5 gene. J. Hum. Genet. 2012;57:459–64.
- Greenbaum L.A. Atypical Hemolytic Uremic Syndrome. Adv. Pediatr. 2014;61:335–56.
- Abarrategui-Garrido C., Melgosa M., Peña-Carrión A., de Jorge E.G., de Córdoba S.R., López-Trascasa M., Sánchez-Corral P. Mutations in Proteins of the Alternative Pathway of Complement and the Pathogenesis of Atypical Hemolytic Uremic Syndrome. Am. J. Kidney Dis. 2008;52:171–80.
- Conde-Agudelo A., Villar J., Lindheimer M. World Health Organization systematic review of screening tests for preeclampsia. Obstet. Gynecol. 2004;104:1367–91.
- Buimer M., Keijser R., Jebbink J.M. Seven Placental Transcripts Characterize HELLP-syndrome. Placenta. 2008;29:444–53.
- Fang C.J., Fremeaux-Bacchi V., Liszewski M.K. Membrane cofactor protein mutations in atypical hemolytic uremic syndrome (aHUS), fatal Stx-HUS, C3 glomerulonephritis, and the HELLP syndrome. Blood. 2008;111:624–32.
- Salmon J.E., Heuser C., Triebwasser M. Mutations in complement regulatory proteins predispose to preeclampsia: a genetic analysis of the PROMISSE cohort. PLoS Med. 2011;8:e1001013.
- Tsai H.-M. A Mechanistic Approach to the Diagnosis and Management of Atypical Hemolytic Uremic Syndrome Transfusion. Med. Reviews. 2014;28:187–97.
- Abramson S.B., Buyon J.P. Activation of the complement pathway: comparison of normal pregnancy, preeclampsia, and systemic lupus erythematosus during pregnancy. Am. J. Reprod. Immunol. 1992;28(3e4):183–7.
- Richani K., Soto E., Romero R. Normal pregnancy is characterized by systemic activation of the complement system. J. Matern. Fetal. Neonatal. Med. 2005;17(4):239–45.
- Wells M., Bennett J., Bulmer J.N. Complement component deposition in uteroplacental (spiral) arteries in normal human pregnancy. J. Reprod. Immunol. 1987;12(2):125–35.
- Tedesco F., Narchi G., Radillo O. Susceptibility of human trophoblast to killing by human complement and the role of the complement regulatory proteins. J. Immunol. 1993;151(3):1562–70.
- Lynch A.M., Salmon J.E. Dysregulated Complement Activation as a Common Pathway of Injury in Preeclampsia and Other Pregnancy Complications. Placenta. 2010;31:561–7.
- Рогов В.А., Шилов Е.М., Козловская Н.Л. Состояние эндотелия и тромбоцитов у беременных с хроническим гломерулонефритом и лечебные возможности ацетилсалициловой кислоты и дипиридамола. Тер. архив. 2004;76(12):58–64.
- Buurma A., Cohen D., Veraar K. Preeclampsia is characterized by placental complement dysregulation. Hypertension. 2012;60(5):1332–7.
- Dennya K.J., Coultharda L.G., Finnellc R.H. Elevated complement factor C5a in maternal and umbilical cord plasma in preeclampsia. J. of Reprod. Immun. 2013;97:211–6.
- Rampersad R., Barton A., Sadovsky Y., Nelson D.M. The C5be9 membrane attack complex of complement activation localizes to villous trophoblast injury in vivo and modulates human trophoblast function in vitro. Placenta. 2008;29(10):855–61.
- Lynch A.M., Murphy J.R., Byers T. Alternative complement pathway activation fragment Bb in early pregnancy as a predictor of preeclampsia. Am. J. Obstet. Gynecol. 2008;198(4):385–9.
- Holers V.M., Girardi G., Mo L. Complement C3 activation is required for antiphospholipid antibodyinduced fetal loss. J. Exp. Med. 2002;195(2):211–20.
- Girardi G., Berman J., Redecha P. Complement C5a receptors and neutrophils mediate fetal injury in the antiphospholipid syndrome. J. Clin. Invest. 2003;112(11):1644–54.
- Fakhouri F., Roumenina L., Provot F. Pregnancy-Associated Hemolytic Uremic Syndrome Revisited in the Era of Complement Gene Mutations. J. Am. Soc. Nephrol. 2010;21:859–67.
- Noris M., Caprioli J., Bresin E. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. Clin. J. Am. Soc. Nephrol. 2010;5:1844–59.
- Atypical Hemolytic-Uremic Syndrome. Pagon R.A., Adam M.P., Ardinger H.H. GeneReviews (Seattle, WA): University of Washington, 2014. P. 8–38.
- Sep S., Verbeek J., Koek G. Clinical differences between early-onset HELLP syndrome and early-onset preeclampsia during pregnancy and at least 6 months postpartum. Am. J. Obstet. Gynecol. 2010;202(271):1–5.
- Habli M., Eftekhari N., Wiebracht E. Long-term maternal and subsequent pregnancy outcomes 5 years after hemolysis, elevated liver enzymes, and low platelets (HELLP) syndrome. Am. J. Obstet. Gynecol. 2009;201(385):1–5.
- Michael M., Elliott E.J., Ridley G.F. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura. Cochrane Database Syst. Rev. 2009;1:CD003595.
- Kappler S., Ronan-Bentle S., Graham A. Thrombotic Microangiopathies (TTP,HUS, HELLP). Emerg. Med. Clin. N. Am. 2014;32:649–71.
- Mussoni M.P., Veneziano F.A., Boetti L. Innovative therapeutic approach: Sequential treatment with plasma exchange and eculizumab in a pregnant woman affected by atypical hemolytic-uremic syndrome. Transfus. Apher. Sci. 2014;51(2):134–6.
- Mackaness C., Fleszler F. Eculizumab in the successful treatment of postpartum atypical hemolytic uremic syndrome – a case report. NKF 2014 Spring Clinical Meetings Abstracts. Am. J. Kidney Dis. 2014;63(5):75.
- Kourouklaris A., Ioannou K., Athanasiou I. Postpartum thrombotic microangiopathy revealed as atypical hemolytic uremic syndrome successfully treated with eculizumab: a case report. J. Med. Case Rep. 2014;8:307.
- Burwick R.M., Feinberg B.B. Eculizumab for the treatment of preeclampsia/HELLP syndrome. Placenta. 2013;34:201–3.
- Appenzeller S., Souza F.H.C., Wagner Silva de Souza A. HELLP Syndrome and Its Relationship with Antiphospholipid Syndrome and Antiphospholipid Antibodies. Semin Arthritis Rheum. 2011;41:517–23.
Информация об авторе:
Батюшин М.М. – профессор кафедры внутренних болезней с основами общей физиотерапии № 2 ГБОУ ВПО РостГМУ МЗ РФ
E-mail: nephr-roon@rambler.ru
Источник
