Гемолитический уремический синдром у детей
ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ (ГУС) является одной из частых причин острой почечной недостаточности (ОПН) у детей.
ТРИАДА СИМПТОМОВ:
- Гемолитическая анемия (снижение уровня гемоглобина и эритроцитов в крови, с наличием фрагментированных эритроцитов – шизоцитов)
- Тромбоцитопения – снижение уровня тромбоцитов в крови
- Острая почечная недостаточность
У большинства (90-95%) детей отмечается так называемый типичный или постдиарейный ГУС (Д+ГУС).
Другая форма ГУС, называемая атипичный (аГУС), встречается гораздо реже (5-10 % всех случаев) и является результатом аномалии (чаще генетической) белков, регулирующих процесс активации комплементов.
Д+ГУС ИЛИ ПОСТДИАРЕЙНЫЙ ГУС
Д+ГУС развивается вследствие кишечной инфекции вызванная Е coli (кишечная палочка) которая продуцируют токсин – шигатоксин (STEC).
тмечается в основном в возрасте до 3 лет и редко до 6 месяцев.
Симптомы
- диарея (разжиженный стул, понос) в течение нескольких дней (у 90-95%). Иногда бывает кровь в стуле. ЕСЛИ ВЫ ЗАМЕТИЛИ КРОВЬ В СТУЛЕ, НЕЗАМЕДЛИТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ.
- рвота (у 30-60%) и боли в животе
Манифестация ГУС начинается в среднем через 6 (в среднем 2-14) дней. Бледность, общее недомогание, слабость, изменение поведения, небольшая желтушность, уменьшение количества мочи после (кровавой) диареи должны насторожить врача в отношении ГУС.
ЕСЛИ У ВАШЕГО РЕБЕНКА КИШЕЧНАЯ ИНФЕКЦИЯ И ЧЕРЕЗ НЕСКОЛЬКО ДНЕЙ ВЫ ЗАМЕТИЛИ ТЕМНУЮ МОЧУ (КРАСНУЮ) С УМЕНЬШЕНИЕМ ЕЕ КОЛИЧЕСТВА, ИЛИ ЗАМЕТИЛИ ПАСТОЗНЫЕ ВЕКИ ИЛИ ОТЕК ЛИЦА, БЛЕДНОСТЬ С ЖЕЛТУШНОСТЬЮ НЕ ЗАМЕДЛЕТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ!
РАЗВЕРНУТАЯ КАРТИНА ГУС
- гемолитическая анемия (снижение гемоглобина, шизоциты)
- тромбоцитопения
- лейкоцитоз
ОПН с повышением уровня сывороточного креатинина и азота мочевины. Приблизительно половина пациентов имеют тяжелую олигурию (снижение количества мочи) или анурию (полное отсутствие мочи), 50-60% нуждаются в остром диализе. При наличии хоть какого-нибудь количества мочи постоянно определяются микро- или макрогематурия (кровь в моче) и протеинурия (белок в моче).
ВНЕПОЧЕЧНЫЕ ОСЛОЖНЕНИЯ
- поражение центральной нервной системы
- поражение желудочно-кишечного тракта (воспаление толстого кишечника – колит и др.)
- отек поджелудочной железы
- поражение печени
- сердечные осложнения
Для уточнения диагноза срочно должны быть проведены соответствующие лабораторные исследования и незамедлительно начать лечение.
ПРОГНОЗ
В большинстве случаев в течение менее чем 1-2х недель исчезают гемолитическая анемия и тромбоцитопения, нормализуется диурез. 10% детей в среднем в течение 4-х месяцев достигают терминальной ХПН. Смертность в основном в результате поражения ЦНС (центральной нервной системы).
СОВЕТЫ РОДИТЕЛЯМ
ПРЕДОТВРАЩЕНИЯ ИНФИЦИРОВАНИЯ STEC (кишечная палочка содержащий шигатоксин) и развития ГУС
- рубленая говядина должна быть хорошо прожарена до приобретения на разрезе серого цвета
- дети до 3 лет не должны употреблять непастеризованные продукты (молоко, сыр, фруктовые соки)
- до приготовления пищи, особенно после манипуляций с рубленой говядиной, необходимо мыть руки
- дети, которые прикасались к крупному рогатому скоту и другим животным, должны после этого умыться, а также перед едой.
- для предотвращения контаминации мяса кишечным содержимым необходим контроль убоя скота. Важен надлежащий надзор и уход за водоснабжения
- антибиотики? Многочисленные исследования показали, что антибиотикотерапия в период диареи увеличивает риск развития ГУС, возможно в связи с освобождением шигатоксина в результате лизиса бактерий. Тем не менее, этот риск пока не доказан.
Для получения больше информации звоните врачам отделения: + 7(499) 134-07-43
Источник
Гемолитико-уремический синдром (ГУС) у детей характеризуется триадой симптомов: микроангиопатической гемолитической анемией, тромбоцитопенией, острым почечным повреждением (ОПП) [1, 2]. ГУС привлекает внимание специалистов разных специальностей: педиатров, нефрологов, терапевтов, инфекционистов, акушеров-гинекологов, клинических генетиков в связи с тем, что остается основной причиной ОПП в детском возрасте и имеет неблагоприятный прогноз формирования хронической болезни почек (ХБП) у 18% больных [3, 4]. У 25% детей после перенесенного типичного ГУС отмечаются остаточные изменения в виде снижения скорости клубочковой фильтрации, формирования артериальной гипертензии и (или) протеинурии [5]. Несмотря на внедрение новых методов диагностики и лечения ГУС у детей, сохраняется высокий риск летального исхода, особенно при ГУС, ассоциированным с диареей, — 8–12%, при атипичном ГУС до 25% [6–9].
С момента первого описания ГУС были исследованы роль шиготоксина в его инициации, расшифровка его структуры, механизма патологического воздействия шиготоксина на эндотелий сосудов, описаны специфические рецепторы к шиготоксину (глоботриаозилцерамид), выявлена роль системы комплемента в развитии атипичного ГУС, обнаружены мутации в генах, кодирующих белки системы комплемента. По данным С. В. Байко в остром периоде типичного ГУС отмечается снижение уровня С3 фракции комплемента у 80% детей, отражая активацию альтернативного пути системы комплемента [10]. Имеются работы, посвященные роли ингибиторов комплемента в лечении ГУС, генетических аспектах формирования ГУС у детей, опыту трансплантации почек при этой патологии. Современные научно-практические исследования проводятся в отношения изучения избыточной активации системы комплемента, разработки методов диагностики, профилактики и лечения ГУС.
Пересмотрены прежние представления о тромбоцитопенической пурпуре (ТТП). Ранее ГУС и ТТП рассматривали как единое заболевание. В связи с обнаружением и внедрением в педиатрическую практику определения активности протеазы ADAMTS 13 эти патологии стали разделять на две отдельные нозологические формы [11, 12]. Опубликованы работы, посвященные изменению активности протеазы ADAMTS 13 при типичном ГУС, выявлен умеренный дефицит активности ADAMTS 13 и прямая корреляционная связь с тяжестью течения типичного ГУС [13].
Внедрены методы выделения основного возбудителя кишечной инфекции, приводящей к инициации ГУС, E. coli О157:Н7, обнаружение шиготоксина в кале с помощью полимеразной цепной реакции или в сыворотке крови, выявление антител в сыворотке крови к липополисахариду наиболее распространенного в данном регионе серотипа E. coli, появились экспресс-методы диагностики шиготоксина в кале. Существуют методы определения активности протеазы ADAMTS 13, уровня основных белков системы комплемента, наличия антител к фактору Н, генетическое исследование на выявление мутаций основных белков системы комплемента. Применение этих методов принципиальным образом улучшило диагностику ГУС у детей, в том числе грудного возраста.
Выявление роли системы комплемента в развитии ГУС у детей способствовало разработке и внедрению новых лечебных методов, таких как плазмотерапия и плазмообмен [14, 15]. Накапливаются данные по эффективному применению ингибитора комплемента — препарата экулизумаб при атипичном ГУС.
Вместе с тем остаются недостаточно изученными причинно-значимые факторы, обусловливающие рост ГУС у детей в последние годы. Отсутствуют сведения о региональных особенностях ГУС у детей. Таким образом, ГУС остается одной из актуальных проблем современной педиатрии и нефрологии.
Материалы и методы исследования
Цель исследования — определить особенности гемолитико-уремического синдрома у детей Оренбургской области. Проведен ретроспективный анализ 51 истории болезни детей, госпитализированных с ГУС в анестезиолого-реанимационное отделение Государственного бюджетного учреждения здравоохранения «Оренбургская областная детская клиническая больница» за период с 2000 г. по 2015 г.
Результаты исследования
По данным госпитализированной заболеваемости за период c 2000 г. по 2015 г. в Оренбургской области зарегистрирован 51 случай ГУС у детей. В структуре заболевания 98% составлял типичный ГУС, у 1 ребенка был зарегистрирован атипичный ГУС. С 2008 г. отмечается ежегодный прирост пациентов с ГУС в Оренбургской области. С 2000 г. по 2007 г. было зарегистрировано 6 случаев ГУС, тогда как за период с 2007 г. по 2015 г. — 45 случаев (рис. 1).
.gif)
ГУС диагностировался во все сезонные периоды. Пик заболеваемости ежегодно приходится на май и июнь (рис. 2).
.gif) В половой структуре заболевания преобладали девочки — 53% (n = 27) по сравнению с мальчиками — 47% (n = 24). В возрастной структуре ГУС преобладали дети грудного и раннего возраста — 82,3% (n = 42) (табл. 1).
В половой структуре заболевания преобладали девочки — 53% (n = 27) по сравнению с мальчиками — 47% (n = 24). В возрастной структуре ГУС преобладали дети грудного и раннего возраста — 82,3% (n = 42) (табл. 1).
При анализе клинических показателей детей с ГУС установлено, что в продромальном периоде развитию заболевания у 98% больных (n = 50) предшествовал синдром диареи, у 40% из них развился гемоколит (n = 20). У 70,6% детей (n = 36) отмечалась рвота, у 62,7% детей (n = 32) повышение температуры тела. В 60% случаев (n = 31) наблюдался абдоминальный болевой синдром.
Клинические признаки в период разгара ГУС характеризовались классической триадой: неиммунная гемолитическая анемия (с присутствием в мазке крови шизоцитов), тромбоцитопения, ОПП. В большинстве случаев анемия носила тяжелый характер с симптомами гипоксемии, что в 90% случаев (n = 46) требовало переливания эритроцитарной массы. У 100% пациентов диагностировался отечный синдром различной степени выраженности: от пастозности век до генерализованых отеков.
Степень повреждения почек у детей с ГУС была различной: в 62,8% случаев развилась олигурическая стадия ОПП (n = 32), а в 37,2% наступала анурическая стадия ОПП (n = 19).
Динамика купирования олигурии представлена в табл. 2. Более чем в половине случаев (56,2%) (n = 18) олигурия купировалась в течение 7 дней. Длительность олигурии до 2 недель наблюдалось у 1/4 детей (n = 8). У 1 ребенка (3,1%) олигурическая стадия ОПП длилась более 1 месяца. Динамика купирования стадии анурии ОПП представлена в табл. 3. Более чем у половины детей анурия купировалась в течение второй недели ОПП. У 21% детей (n = 4) длительность анурии составила до 7 дней. У 1 ребенка (5,3%) анурия длилась более 1 месяца.
В разгар ГУС у пациентов наблюдались экстраренальные синдромы: поражение желудочно-кишечного тракта, центральной нервной, сердечно-сосудистой, дыхательной системы, системы гемостаза, синдром интоксикации.
Наиболее частыми клиническими проявлениями поражения нервной системы были: нарушения сознания у 32,4% детей (n = 16), судороги у 23,5% детей (n = 12), острое нарушение мозгового кровообращения по данным магнитно-резонансной томографии (n = 3).
Поражение гастроэнтестинальной системы проявлялось повреждением печени (60%) (n = 31) в виде гепатомегалии, повышения уровня АСТ, АЛТ. У одного ребенка по данным аутопсии развился панкреонекроз, клинически проявлявшийся некупируемой гипергликемией. У одного ребенка по данным эзофагогастродуоденоскопии обнаружены эрозии пищевода.
Поражение сердечно-сосудистой системы проявлялось синдромом артериальной гипертензии в 33,3% случаев (n = 17). Артериальная гипертензия купировалась совместно с ОПП, что, вероятно, связано с явлениями гипергидратации в разгар заболевания.
У 8 детей (15,7%) на фоне общего тяжелого состояния развилась тяжелая дыхательная недостаточность, требовавшая проведения искусственной вентиляции легких.
Проявления нарушения гемостаза варьировались от незначительного кожного геморрагического синдрома до системных кровотечений. У 19 пациентов (37,2%) ГУС осложнился синдромом диссеминированного внутрисосудистого свертывания.
Развитие ОПП у большинства детей с ГУС (76,5%) (n = 39) требовало проведения заместительной почечной терапии (ЗПТ) (табл. 4). У 12 (23,5%) детей ОПП купировалось без ЗПТ. Более чем в половине случаев был осуществлен гемодиализ. На втором месте по частоте применения было сочетание гемо- и перитонеального диализа. Двоим детям был проведен только перитонеальный диализ. В 2 случаях совместно с гемодиализом применен плазмаферез.
Летальность от ГУС в Оренбургской области за период с 2000 г. по 2015 г. составила 11,8% (6 детей).
.gif)
Обсуждение
В Оренбургской области за период с 2000 г. по 2015 г. наблюдается рост заболеваемости ГУС у детей преимущественно грудного и раннего возраста. В клинической картине преобладает ГУС с тяжелой клиникой ОПП, требующей проведения заместительной почечной терапии. Экстраренальные повреждения чаще ассоциировались с вовлечением желудочно-кишечного тракта, центральной нервной системы. Таким образом, тяжесть течения заболевания с риском развития летального исхода и неблагоприятным отдаленным прогнозом требует настороженности врачей всех специальностей, ранней диагностики ГУС с направлением пациентов в специализированный стационар для оказания высококвалифицированной медицинской помощи.
Литература
- Gasser C., Gautier E., Steck A., Siebenman R., Oechslin R. Hemolytic-uremic syndrome: bilateral necrosis of the renal cortex in acute acquired hemolytic anemia // Schweiz Med Wochenschr. 1955. № 85. Р. 905–909.
- Ruggenenti P., Noris M., Remuzzi G. Thrombotic microangiopathy, hemolytic uremic syndrome, and thrombotic thrombocytopenic purpura // Kidney Int. 2001. № 60. Р. 831–846.
- Siegler R. L. The hemolytic uremic syndrome // Pediatr Clin North Am. 1995. V. 42. № 6. Р. 1505–1529.
- Scheiring J., Andreoli S. P., Zimmerhackl L. B. Treatment and outcome of Shiga-toxin-associated hemolytic uremia syndrome (HUS) // Pediatr Nephrol. 2008. № 23. Р. 1749–1760.
- Spinale J. M., Ruebner R. L., Copelovitch L., Kaplan S. Long-term outcomes of Shiga toxin hemolytic uremic syndrome // Pediatric Nephrology. 2013. V. 28. № 11. Р. 2097–2105.
- Гемолитико-уремический синдром как ведущая причина острой почечной недостаточности у детей раннего возраста // Нефрология и диализ. 2000. № 4 (2). С. 317–321.
- Garg A. X., Suri R. S., Barrowman N., Rehman F., Matsell D., Rosas-Arellano M. P., Salvadori M., Haynes R. B., Clark W. F. Long-term renal prognosis of diarrhea-associated hemolytic uremic syndrome: a systematic review, meta-analysis, and meta-regression // JAMA. 2003. V. 290. № 10. Р. 1360–1370.
- Noris M., Giuseppe R. Atypical hemolytic uremic syndrome // N Engl J Med. 2009. № 361. Р. 1676–1687.
- George J. N., Nester C. M. Syndromes of thrombotic microangiopathy // N Engl J Med. 2014. № 371. Р. 654–666.
- Байко С. В., Сукало А. В., Кильчевская Е. В., Бегун А. Н. Динамика изменений уровней белков системы комплемента С3 и С4, витамина Д у детей с постдиарейным ГУС // Российский вестник перинатологии и педиатрии. Тезисы XIV российского конгресса «инновационные технологии в педиатрии и детской хирургии» с международным участием. 2015. № 4. С. 199–200.
- Fujikawa K. et al. Purification of human von Willebrand factor-cleaving protease and its identification as a new member of the metalloproteinase family // Blood. 2001. V. 98. № 6. Р. 1662–1666.
- Zheng X. et al. Structure of von Willebrand factor-cleaving protease (ADAMTS13), a metalloprotease involved in thrombotic thrombocytopenic purpura // J. Biol. Chem. 2001. V. 276. № 44. Р. 41059–41063.
- Орлова О. М., Эмирова Х. М., Толстова Е. М., Панкратенко Т. Е., Абасеева Т. Ю., Музуров А. Л, Буров А. А., Авдонин П. В. Умеренный дефицит активности ADAMTS 13 — фактор риска микроциркуляторных тромбозов при гемолитико-уремическом синдроме, ассоциированным с SHIGA-toxin-продуцирующей E. coli (STEC-ГУС) / Мультидисципленарность и дифференциация направлений современной нефрологии: материалы 4-го Конгресса Ассоциации нефрологов новых независимых государств 29–30 сентября 2016. Минск: СтройМедиаПроект, 2016. С. 109–110.
- Dundas S., Murphy J., Soutar R. L. et al Effectiveness of therapeutic plasma exchange in the 1996 Lanarkshire Escherichia coli O157: H7 outbreak // Lancet. 1999. № 354. Р. 1327–1330.
- Tsai H. M. Is severe deficiency of ADAMTS-13 specific for thrombotic thrombocytopenic purpura? Yes. // J. Thromb. Haemost. 2003. № 1. Р. 625–631.
Е. В. Гунькова1
А. А. Вялкова, доктор медицинских наук, профессор
И. В. Зорин, доктор медицинских наук, профессор
ФГБОУ ВО ОрГМУ МЗ РФ, Оренбург
1 Контактная информация: k_pediatry@orgma.ru
Купить номер с этой статьей в pdf
Источник

Атипичный гемолитико-уремический синдром (аГУС)
Атипичный гемолитико-уремический синдром (аГУС) — это чрезвычайно редкое (орфанное) заболевание, связанное с недостаточностью альтернативного пути активации комплемента. По системе МКБ-10 кодируется, как D 59.3
Атипичный гемолитико-уремический синдром (аГУС). Прогноз. Причины.
К сожалению, прогноз заболевания, чаще всего, неблагоприятный. Атипичный гемолитико-уремический синдром (аГУС) – это угрожающая жизни хроническая болезнь, характеризующаяся мультисистемным поражением органов и тканей. Заболевание примерно одинаково встречается как у детей, так и у взрослых. В основе заболевания лежит тромботическая микроангиопатия (TMA), при которой в маленьких кровеносных сосудах возникают тромбы. Из-за этого нарушается кровоснабжение, и органы страдают.
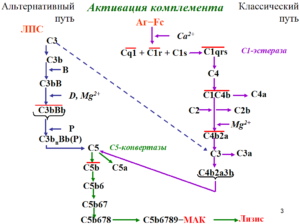 Причина болезни – сбой в системе комплемента, его очень активная деятельность вместо того, чтобы защищать организм, начинает его разрушать. Контролируют уровень активность особые белки, при атипичным гемолитико-уремический синдроме (аГУС) их функция значительно нарушена, и процесс выходит из под контроля.
Причина болезни – сбой в системе комплемента, его очень активная деятельность вместо того, чтобы защищать организм, начинает его разрушать. Контролируют уровень активность особые белки, при атипичным гемолитико-уремический синдроме (аГУС) их функция значительно нарушена, и процесс выходит из под контроля.
Чем дольше длится токсическое агрессивное воздействие на организм, тем более пагубными становятся последствия: отказывают почки, развивается инсульт или инфаркт.
Соответственно, при ранней диагностике, при выявлении заболевания на начальных стадиях, можно снизить пагубное воздействие атипичного гемолитико-уремического синдрома (аГУС), и тем самым дать шанс человеку на нормальную полноценную жизнь.
Атипичный гемолитико-уремический синдром (аГУС). Наследование.
Атипичный гемолитико-уремический синдром (аГУС) считается наследственным заболеванием только в 20% случаев, с аутосомно-рецессивным или доминантным типом передачи. Примерно в половине случаев выявить генетическую мутацию не получается. Поэтому ДНК – анализ при атипичном гемолитико-уремическом синдроме (аГУС) не является важнейшим диагностическим методом, на его основании не может даваться заключение о начале или отмене терапии.
Атипичный гемолитико-уремический синдром (аГУС) одинаково распространен по всей планете, не выявлено зависимости от пола или расы пациентов. Из-за редкости заболевания сложно говорить о точном количестве пациентов, есть предположения о том, что болезнь встречается примерно от 1 до 9 случаев на миллион человек.
Атипичный гемолитико-уремический синдром (аГУС). Клинические проявления.
Симптомы атипичного гемолитико-уремического синдрома (аГУС) встречаются как все вместе, так и по отдельности. Насторожить должно любое из клинических проявлений болезни.
Итак, симптомами атипичного гемолитико-уремического синдрома (аГУС) являются:
- Постоянная усталость и недомогание;
- Поражение почек вплоть до необходимости гемодиализа из-за терминальной почечной недостаточности;
- Отеки, тяжесть в ногах;
- Снижение диуреза;
- Повышение креатинина крови;
- Снижение скорости клубочковой фильтрации;
- Артериальная гипертензия;
- Внепочечный тромбоз;
- Протеинурия;
- Энцефалопатия;
- Спутанность сознания;
- Судороги;
- Инсульт;
- Инфаркт;
- Кардиомиопатия с развитием сердечной недостаточности;
- Высокое артериальное давление;
- Поражение глазных сосудов;
- Поражение легких;
- Поражение кожи. Сыпь;
- Боли в животе;
- Диарея;
- Рвота;
- Колит;
- Панкреатит.
Вызывать проявления атипичного гемолитико-уремического синдрома (аГУС) могут несколько причин, зачастую они становятся спусковым крючком для начала заболевания. Вот они:
- Диарея;
- Гастроэнтерит;
- Инфекции верхних дыхательных путей;
- Беременность и роды;
- Гломерулопатия;
- Склеродермия;
- Системная красная волчанка;
- Злокачественная артериальная гипертензия;
- Злокачественные новообразования;
- Трансплантация почки и костного мозга.
Все они усиливают нарушение в системе комплемента. Иногда для манифестации заболевания бывает достаточно одного фактора, но они могут действовать и в совокупности.
Атипичный гемолитико-уремический синдром (аГУС). Диагностика.
 Тромботическая микроангиопатия (TMA) – результат атипичного гемолитико-уремического синдрома (аГУС), но вызвать такое тяжелое последствие может не только аГУС, но и другие заболевания. Поэтому так важно проводить дифференциальную диагностику, чтобы квалифицировать именно манифестицию атипичного гемолитико-уремического синдрома (аГУС).
Тромботическая микроангиопатия (TMA) – результат атипичного гемолитико-уремического синдрома (аГУС), но вызвать такое тяжелое последствие может не только аГУС, но и другие заболевания. Поэтому так важно проводить дифференциальную диагностику, чтобы квалифицировать именно манифестицию атипичного гемолитико-уремического синдрома (аГУС).
Во-первых, атипичный гемолитико-уремический синдром (аГУС) не имеет в самом начале возникновения заболевания проявлений гемоколита, во-вторых диарея может сама по себе вызвать заболевание, а не быть его симптомом. На этом этапе нужно исключить STEC и Streptococcus pneumoniae – инфекции.
Дальше методом исключения проверяем пациента на системную красную волчанку, СПИД, злокачественную гипертонию, тромботическую тромбоцитопеническую пурпуру, HELLP — синдром у рожающих женщин и ряд других заболеваний.
Напоминаем, что генетический анализ не имеет 100% достоверности, у части пациентов с подтвержденным атипичным гемолитико-уремическим синдромом (аГУС), нарушения в соответствующем гене не выявлены.
Атипичный гемолитико-уремический синдром (аГУС). Лечение.
Лечение инфузиями плазмы, пламообменом. В настоящий момент метод считается недостаточно эффективным, у одних пациентов он вызывает незначительное улучшение показателей, а у других оказывается практически бесполезным.
Гемодиализ. Процедура искусственной очистки организма лишь устраняет последствия сбоя в системе комплемента, но при этом никак не влияет на процесс избыточного образования белка. Она способна на несколько лет увеличить продолжительность жизни пациента. Сохраняется возможность развития внепочечной тромботической микроангиопатии.
Трансплантация. Почка, потерявшая свою функцию, может быть заменена на новую, но прогрессирующее заболевание может вновь начать разрушать органы и ткани. 90% пациентов опять чувствуют симптомы атипичного гемолитико-уремического синдрома (аГУС). Есть большой риск рецидива после трансплантации. Иногда можно осуществить двойную трансплантацию, и печени, и почки, но при этом возникает огромная сложность в поиске идеально подходящих двух донорских органов. Кроме того, и такая сложнейшая манипуляция может не дать гарантированного положительного результата. Тромботическая микроангиопатия развивается и в других органах.
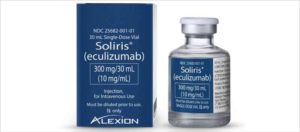 Экулизумаб. Единственный препарат, который воздействует на механизм развития заболевания, а не на последствия болезни. Экулизумаб связывает компонент комплемента и тем самым предотвращает накопление негативных факторов. Препарат зарегистрирован в России и доказал свою эффективность. Люди с атипичным гемолитико-уремическим синдромом (аГУС) не чувствуют постоянную усталость, у них не развивается поражение органов и тканей. Внедрение в лечебную практику экулизумаба, гуманизированного моноклонального антитела к С5 — фракции терминальной стадии каскада комплемента, значительно увеличивает продолжительность жизни пациентов, а сама жизнь становится полноценной.
Экулизумаб. Единственный препарат, который воздействует на механизм развития заболевания, а не на последствия болезни. Экулизумаб связывает компонент комплемента и тем самым предотвращает накопление негативных факторов. Препарат зарегистрирован в России и доказал свою эффективность. Люди с атипичным гемолитико-уремическим синдромом (аГУС) не чувствуют постоянную усталость, у них не развивается поражение органов и тканей. Внедрение в лечебную практику экулизумаба, гуманизированного моноклонального антитела к С5 — фракции терминальной стадии каскада комплемента, значительно увеличивает продолжительность жизни пациентов, а сама жизнь становится полноценной.
Источник
