Гемофагоцитарный синдром у детей вторичный
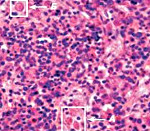
Гемофагоцитарный лимфогистиоцитоз – группа врожденных и приобретенных заболеваний, возникающих вследствие нарушений регуляции иммунного ответа и характеризующихся гиперпродукцией гистиоцитов, а также цитотоксических T-лимфоцитов. Клиническая симптоматика проявляется фебрильной лихорадкой, увеличением печени и селезенки, периферических лимфатических узлов, поражением нервной системы, костного мозга и других органов. Диагностика основана на данных клинического, лабораторного (цитопения, коагулопатия, билирубинемия и др.) и инструментального обследования. Лечение: иммуносупрессивная терапия, кортикостероиды, воздействие на причинные факторы.
Общие сведения
Гемофагоцитарный лимфогистиоцитоз (гемофагоцитарный синдром) – врожденное или приобретенное нарушение регуляции иммунного ответа, при котором происходит аномальная активация цитотоксических T-лимфоцитов, моноцитов и макрофагов с аккумуляцией в органах-мишенях и развитием в них выраженного патологического процесса (воспаления, повреждения тканей, фагоцитоза форменных элементов крови). При врожденной, генетически детерминированной форме заболевания болеют преимущественно дети раннего возраста и в 60-80% случаев – на первом году жизни.
Вторичный (приобретенный) гемофагоцитарный лимфогистиоцитоз встречается во всех возрастных категориях, развивается на фоне затяжного течения различных инфекционных заболеваний, аутоиммунных процессов и новообразований. Впервые признаки гемофагоцитарного синдрома были описаны еще в 1939 году, а заболевание тогда было названо гистиоцитарным медуллярным ретикулезом. Семейная наследственная форма лимфогистиоцитоза была впервые описана в 1959 году. Распространенность заболевания колеблется от 1 случая на 50 тысяч новорожденных до 1-2 случаев на 1 миллион детей в возрасте до 15 лет.

Гемофагоцитарный лимфогистиоцитоз
Причины гемофагоцитарного лимфогистиоцитоза
Врожденный гемофагоцитарный лимфогистиоцитоз возникает вследствие генетического дефекта механизмов клеточной цитотоксичности из-за мутаций гена перфорина. В норме регуляция иммунного ответа обеспечивается своевременным ограничением активности эффекторов иммунной системы в процессе ликвидации угрозы для организма со стороны проникших инфекционных агентов и других негативных воздействий. В этой регуляции важную роль играют механизмы клеточной цитотоксичности.
При первичном гемофагоцитарном лимфогистиоцитозе регулятивная роль цитотоксических гранул клеток и цитотоксических T-лимфоцитов в отношении клеток-мишеней нарушается, происходит чрезмерная активация иммунных клеток, в избытке продуцируются провоспалительные цитокины (интерфероны, фактор некроза опухоли и др.). Активированные вследствие «цитокинового шторма» T-лимфоциты и макрофаги инфильтрируют, а затем повреждают органы и ткани. Важным фактором патогенеза заболевания является развитие патологического гемофагоцитоза зрелых форменных элементов крови. Такой фагоцитоз происходит и в норме, помогая организму избавиться от старых клеток. В данном же случае макрофаги начинают фагоцитировать полноценные, нормально функционирующие форменные элементы крови, приводя к выраженной цитопении, коагулопатии и другим проявлениям заболевания.
Приобретенный (вторичный) гемофагоцитарный лимфогистиоцитоз развивается на фоне некоторых инфекционных заболеваний, опухолей, аутоиммунных процессов, при трансплантации органов и тканей, причем характерные нарушения регуляции иммунного ответа могут быть как следствием основного заболевания, так и осложнением, связанным с проведением иммуносупрессивной терапии и возникновением вторичной инфекции.
Симптомы гемофагоцитарного лимфогистиоцитоза
Клинические проявления гемофагоцитарного лимфогистиоцитоза чрезвычайно вариабельны. Наиболее часто наблюдается длительная лихорадка, рефрактерная к проводимой антибактериальной и противовирусной терапии. Озноб, признаки общей интоксикации (слабость, потливость, нарушения сна, отказ от приема пищи, тошнота и рвота, боли в мышцах) продолжаются в течение длительного времени, приобретая волнообразное течение с периодическими временными улучшениями самочувствия.
Характерным проявлением заболевания является увеличение печени и селезенки, имеющее прогрессирующий характер. К ранним симптомам первичного гемофагоцитарного лимфогистиоцитоза относится появление кожной сыпи, увеличение периферических лимфатических узлов, а также развитие неврологических расстройств в виде повышенной возбудимости, двигательных нарушений и расстройств чувствительности, судорожного синдрома, признаков повышения внутричерепного давления у детей раннего возраста. Встречаются при гемофагоцитарном лимфогистиоцитозе и симптомы, свидетельствующие о наличии анемии, коагулопатии – бледность и желтушность кожных покровов, периферические отеки, признаки кровотечения из пищеварительного тракта (черный кал, примесь крови в каловых массах и др.).
При вторичном гемофагоцитарном синдроме сочетаются клинические признаки поражения иммунной системы и проявления основного заболевания (вирусной инфекции, злокачественного новообразования, аутоиммунного заболевания).
Диагностика гемофагоцитарного лимфогистиоцитоза
Диагноз устанавливается в результате тщательного изучения анамнеза, клинической картины заболевания, результатов лабораторных и инструментальных исследований. Необходимы осмотры врача-гематолога, аллерголога-иммунолога, онколога, инфекциониста, ревматолога и других специалистов. Разработаны международные диагностические критерии гемофагоцитарного лимфогистиоцитоза, к которым относятся:
- лихорадка с повышением температуры выше 38,5 градусов, продолжающаяся более недели;
- увеличение печени и селезенки;
- цитопения с уменьшением гемоглобина ниже 90 г/л, тромбоцитов – меньше 100000 клеток/мкл, нейтрофилов – меньше 1000/мкл;
- признаки коагулопатии;
- увеличение ферритина больше 500 нг/мл;
- повышение уровня растворимого sCD25 в крови;
- низкое или полное отсутствие активности NK-клеток.
Наличие хотя бы пяти из этих признаков свидетельствует о гемофагоцитарном лимфогистиоцитозе. Для установления наследственной формы заболевания необходимо генетическое исследование, в результате которого обнаруживаются мутации генов PRF1, UNC13D, Munc18-2, STX11.
Приобретенные формы гемофагоцитарного синдрома диагностируются на основании вышеописанных международных критериев и проведения уточненной диагностики основного заболевания, для чего зачастую необходимо выполнять сложные лабораторные и инструментальные исследования (эндоскопические, УЗИ, КТ, МРТ, ПЭТ).
Дифференциальный диагноз гемофагоцитарного лимфогистиоцитоза проводится с:
- различными врожденными и приобретенными иммунными заболеваниями,
- болезнями крови,
- острыми и хроническими вирусными инфекциями,
- злокачественными новообразованиями (острым лимфобластным лейкозом, неходжкинскими лимфомами, другими злокачественными опухолями после проведенной химиотерапии),
- системными заболеваниями соединительной ткани: системной красной волчанкой, ювенильным дерматомиозитом, узелковым периартериитом, ювенильным ревматоидным артритом.
Лечение гемофагоцитарного лимфогистиоцитоза
Современная тактика лечения наследственной формы гемофагоцитарного лимфогистиоцитоза включает проведение химиотерапии с использованием иммуносупрессивных средств (дексаметазона, этопозида, циклоспорина A), а также трансплантации стволовых клеток. Прогноз заболевания значительно улучшается при своевременном проведении трансплантации от гистосовместимого родственного донора.
При вирусных, бактериальных и паразитарных инфекциях, вызвавших появление гемофагоцитарного синдрома, проводится этиотропная антимикробная терапия, инфузии высокодозного иммуноглобулина, а также иммуносупрессивная терапия с введением циклоспорина A и кортикостероидов. Иногда показано проведение трансплантации костного мозга. При опухолях, наряду с лечением основного заболевания, в терапевтическую схему включаются иммуносупрессивные средства в индивидуально подобранных дозах. При аутоиммунных процессах лечение включает сочетание иммуноглобулина, пульс-терапии с использованием кортикостероидов, а также циклоспорина A.
Источник
Суть болезни
Гемофагоцитарный лимфогистиоцитоз (ГЛГ) – редкое и тяжелое гематологическое заболевание. Оно характеризуется аномальным размножением и активацией особых клеток организма – гистиоцитов (тканевых макрофагов).
Термин «лимфогистиоцитоз» означает, что в развитии болезни, кроме гистиоцитов, участвуют также и неправильно функционирующие лимфоциты. В свою очередь, термин «гемофагоцитарный» означает, что при этой болезни макрофаги поглощают клетки крови (эритроциты, лейкоциты, тромбоциты) и их клетки-предшественники в различных органах и тканях. Этот процесс и называтся гемофагоцитозом.
В результате аномальной активности лимфоцитов и макрофагов возникают тяжелые поражения органов, включая печень, селезенку, лимфатические узлы, кожу, легкие, головной мозг и т.п. Одновременно гемофагоцитоз приводит к цитопении – состоянию дефицита клеток крови.
ГЛГ не является злокачественным заболеванием; в настоящее время считается, что его причина – нарушение регуляции клеточного иммунитета.
Частота встречаемости, факторы риска
ГЛГ – редкое заболевание. По зарубежным данным, частота его врожденной формы – около 1 случая на 50 000 новорожденных.
Различают первичный (семейный, врожденный) и вторичный (приобретенный) ГЛГ. Нарушения при первичном варианте болезни обусловлены наследственными факторами и чаще всего проявляются в очень раннем возрасте, обычно до 12-18 месяцев. Наследование первичного ГЛГ – аутосомно-рецессивное, то есть больной ребенок может родиться (с вероятностью 25%) только тогда, когда оба родителя являются носителями «дефектных» генов. Поэтому ГЛГ чаще встречается при близкородственных браках. Известно несколько разновидностей болезни, которым соответствуют разные генетические дефекты. Мальчики и девочки болеют с одинаковой частотой, зависимости от этнического происхождения также не выявлено. Семьям, где уже были случаи ГЛГ у детей, рекомендована консультация генетика. Возможна пренатальная (то есть до рождения ребенка) ДНК-диагностика.
Вторичный ГЛГ может возникнуть при аномальной активации клеток в результате некоторых инфекций (например, инфицирования вирусом Эпштейна-Барр), злокачественных опухолей, аутоиммунных заболеваний и иммунодефицитных состояний. Эта форма обычно наблюдается в более позднем возрасте, чем первичный ГЛГ.
Признаки и симптомы
Для ГЛГ характерно упорное повышение температуры, причем лихорадка не поддается лечению антибактериальными препаратами. Наблюдается увеличение селезенки (спленомегалия), обычно также увеличение печени (гепатомегалия). Более чем в половине случаев возникает кожная сыпь, поражающая также и волосистую часть головы. Часто встречается увеличение лимфоузлов – лимфаденопатия. Нередки признаки поражения центральной нервной системы (ЦНС): изменения поведения, нарушения координации движений, судороги. Другие возможные симптомы – желтуха, отеки, признаки поражения желудочно-кишечного тракта (боли в животе, рвота, понос, отказ от пищи, потеря веса).
Кроме того, при ГЛГ возникают клинические проявления цитопении, то есть состояния дефицита клеток крови: недостаток эритроцитов проявляется бледностью и слабостью, недостаток тромбоцитов – синяками и кровотечениями (возможны, например, кровотечения из десен), недостаток лейкоцитов – частыми инфекциями.
Диагностика
При выявлении указанных клинических признаков производятся лабораторные исследования с целью подтвердить или исключить диагноз ГЛГ. В общем анализе крови наблюдается цитопения: анемия, тромбоцитопения и/или нейтропения. Присутствуют также характерные изменения в биохимическом анализе крови. Гистологические исследования указывают на накопление лимфоцитов и макрофагов в различных органах, включая селезенку, лимфоузлы, костный мозг, печень и ЦНС. В образцах тканей, взятых посредством биопсии, наблюдается явление гемофагоцитоза (см. выше), но не всегда выявленные изменения бывает легко оценить.
Используются иммунологические тесты, позволяющие обнаружить именно те иммунные нарушения, которые обычно приводят к развитию ГЛГ (снижение активности NK-лимфоцитов.
Диагноз первичного ГЛГ подтверждается молекулярно-генетическим анализом, так как известен целый ряд соответствующих ему генетических дефектов. В то же время вторичный ГЛГ может иметь сходные клинические проявления, но диагностироваться только по совокупности перечисленных и некоторых других клинических и лабораторных признаков.
Лечение
При ГЛГ огромную роль играют своевременная диагностика и начало лечения, так как состояние больного может ухудшаться очень быстро.
В лечении ГЛГ используется химиотерапия. Так, протокол HLH-2004 предполагает использование дексаметазона, этопозида, циклоспорина, а также применение метотрексата в случае поражения ЦНС. Сопроводительная терапия обязательно включает в себя профилактику инфекций. При необходимости производятся переливания компонентов крови.
При врожденном ГЛГ после химиотерапии, позволяющей стабилизировать состояние пациента, необходима аллогенная трансплантация костного мозга. Без трансплантации невозможно достичь продолжительной ремиссии. Трансплантация может также понадобиться в некоторых случаях вторичного (приобретенного) ГЛГ, хотя в международной медицинской практике вопрос о лечении таких больных не решен однозначно.
Прогноз
Первичный ГЛГ без лечения приводит к смертельному исходу. Непосредственной причиной смерти может быть, например, полиорганная недостаточность, сепсис или грибковая инфекция. Даже при условии применения химиотерапии ремиссия обычно непродолжительна и долговременная выживаемость низка. Основную надежду на излечение дает аллогенная трансплантация костного мозга, несмотря на тяжесть этой процедуры и связанные с ней опасные осложнения. Так, в одном из зарубежных исследований пятилетняя выживаемость пациентов после трансплантации достигала 66%, тогда как без трансплантации составляла лишь 10%. В случае успешной трансплантации пациенты могут в дальнейшем иметь нормальные качество и продолжительность жизни.
При вторичном ГЛГ прогноз сильно варьирует в зависимости от конкретного случая заболевания: зафиксированы как случаи с крайне тяжелым течением, плохо поддающиеся терапии, так и случаи самопроизвольного улучшения.
Источник
Симптомы гемофагоцитарный лимфогистиоцитоза
Клиническая картина очень разнообразна. Заболевание может начинаться как обычная инфекция, в процесс могут вовлекаться различные органы и ткани. Среди наиболее часто встречающихся симптомов выделяют несколько.
- Приступы фебрильной лихорадки (температура тела поднимается выше 38° С).
- Прием антибактериальных (противомикробных) средств не способствует снижению температуры тела.
- Могут возникать симптомы обычной ОРВИ – острой респираторной вирусной инфекции (насморк, заложенность носа, першение в горле).
- Может появиться диарея (частый жидкий стул).
- Гепатоспленомегалия (увеличение размеров печени и селезенки).
- Лимфаденопатия (увеличение и болезненность лимфатических узлов).
- Кожные высыпания (по типу пятен, пузырьков, волдырей, узелков).
- Желтуха (окрашивание кожи в желтый цвет).
- Отеки лица и конечностей.
- Геморрагический синдром (множественные кровоизлияния в кожу и подкожную клетчатку).
- Неврологические симптомы (повышенная возбудимость, рвота, судороги, атаксия (нарушение координации движений), задержка психомоторного развития).
Формы
Выделяют первичный и вторичный гемофагоцитарный лимфогистиоцитоз.
- Первичный (врожденный или семейный) – возникает из-за мутаций (нарушений) в генах RAB27A, CHS1/LIST, SH2D1A, BIRC4, HPS1-7: нарушения могут появиться внутриутробно или передаваться от родителей к детям.
- Вторичный – развивается на фоне вирусных инфекций, аутоиммунных заболеваний (заболеваний, для которых характерна агрессия иммунной системы: она принимает клетки своего организма за чужеродные и начинает атаковать их), иммунодефицитных состояний (снижения иммунитета), злокачественных опухолей. Семейный анамнез заболевания отсутствует, то есть у пациента нет родственников, больных гемофагоцитарным лимфогистиоцитозом.
Причины
Гемофагоцитарный лимфогистиоцитоз — заболевание гетерогенное, его причиной могут быть мутации (нарушения) в различных генах. На сегодняшний день ученые доказали, что они могут возникать в нескольких генах: PRF1, STX11, UNC13D, STXBP2, RAB27A, CHS1/LIST, SH2D1A, BIRC4, HPS1-7.
LookMedBook напоминает: что данный материал размещен исключительно в ознакомительных целях и не заменяет консультацию врача!
Диагностика
- Анализ анамнеза заболевания и жалоб – когда (как давно) появились: повышение температуры тела, отсутствие реакции температуры тела (ее снижение) на проводимую антибактериальную (противомикробную) терапию, увеличение лимфоузлов, наличие кожных высыпаний (по типу пятен, узелков, волдырей, пузырьков), желтухи (окрашивания кожи в желтый цвет), подкожных кровоизлияний, наличие симптомов менингоэнцефалита (головная боль, тошнота, рвота, подъем температуры тела до высоких цифр, озноб, судороги, напряжение затылочных и длинных мышц спины).
- Анализ анамнеза жизни — врач обращает внимание на наличие эпизодов повышения температуры тела, желтуху и геморрагический синдром (кровоизлияния), наличие аутоиммунных заболеваний (заболеваний, для которых характерна агрессия иммунной системы: она принимает клетки своего организма за чужеродные и начинает атаковать их) или злокачественных опухолей. Врач выявляет семейный анамнез заболевания – есть ли у пациента родственники, страдающие гемофагоцитарным лимфогистиоцитозом.
- Осмотр пациента – врач может увидеть увеличенные лимфоузлы, высыпания на коже, желтуху, кровоизлияния; при пальпации (прощупывании) живота выявляется гепатоспленомегалия (увеличение размеров печени и селезенки); могут быть выявлены симптомы менингоэнцефалита (напряженность затылочных и длинных мышц спины, симптомы Кернига – затруднение и болевая реакция при попытке распрямить согнутую в коленном и тазобедренном суставах ногу, симптомы Брудзинского – группа симптомов, указывающих на наличие менингоэнцефалита).
- Общий анализ крови — может быть выявлены лейкопения (уменьшение количества лейкоцитов — белых кровяных телец), лимфопения (уменьшение количества лимфоцитов — клеток иммунной системы), анемия (уменьшение количества гемоглобина (белка-переносчика кислорода)), тромбоцитопения (уменьшение количества тромбоцитов – клеток крови, участвующих в процессах свертываемости); может быть выявлено снижение всех показателей.
- Биохимический анализ крови – значительное увеличение сывороточного ферритина (депо (хранилище) железа, необходимого для нормального образования эритроцитов – красных клеток крови, участвующих в переносе кислорода в организме) – маркер (показатель) воспаления в организме:
- повышение ГГТ – гамма-глутамилтрансфераза – белка, участвующего в обмене аминокислот (структурных единиц всех белков в организме), ее уровень указывает на степень нарушений функций почек, печени, поджелудочной железы;
- АСТ (аспартатаминотрансфераза) и АЛТ (аланинаминотрансфераза) – печеночные ферменты (природные катализаторы (ускорители) химических реакций в клетках печени), повышение уровня которых указывает на поражение ткани печени;
- ЛДГ (лактатдегидрогеназа) – белка-фермента, участвующего в окислении глюкозы (сахара) в организме; изменение ее уровня свидетельствует о поражении мышц или наличии злокачественного процесса;
- уровня билирубина – одного из пигментов (окрашивающих веществ) желчи – говорит о нарушении функции печени;
- уровня триглицеридов (жиров).
- Коагулограмма – снижение уровня фибриногена – белка крови, участвующего в процессах ее свертывания, повышение уровня D-димера – продукта распада имеющихся тромбов (сгустков крови), что может привести к развитию такого осложнения, как кровотечения.
- Иммунный статус – для этого анализа берут кровь из вены; снижение активности натуральных киллеров (клеток иммунной системы), что говорит о снижении защитных свойств иммунитета.
- Метод полимеразно-цепной реакции (ПЦР) – проводится для диагностики вирусных инфекций. Как правило, для этого анализа берут или соскоб, или участок того органа, который поражен, или венозную кровь.
- Посев отделяемого из пораженного органа или его клеток – диагностика наличия бактериальных инфекций.
- Пункция (забор) костного мозга (для исключения злокачественных процессов).
- Спиномозговая пункция – забор ликвора (спинномозговой жидкости). Процедура проводится для исключения инфекционного процесса в нервной системе.
- Электрокардиограмма (ЭКГ) – показывает степень нарушений в работе сердца.
- Эхокардиография (Эхо-КГ) – позволяет увидеть изменения в структуре сердца, выявить наличие жидкости в перикарде (оболочке сердца).
- Рентгенография органов грудной клетки – позволяет увидеть изменения в структуре органов грудной клетки — легких, сердце, лимфатических узлах.
- Ультразвуковое исследование (УЗИ) органов брюшной полости – выявляется гепатоспленомегалия (увеличение размеров печени и селезенки).
- Компьютерная томография (КТ) – метод, в основе которого лежит рентгеновское излучение и дальнейшая компьютерная обработка полученных изображений разных по плотности тканей. Используется для исключения опухолевого процесса шеи, груди, живота, таза.
- Магнитно-резонансная томография (МРТ) головного мозга – в основе метода лежит образование магнитных полей, благодаря действию которых врач получает компьютерное изображение внутренних органов и тканей. В данном случае проводится для исключения опухолевого роста.
- Генотипирование – поиск мутаций (нарушений) в генах PRF1, STX11, UNC13D, STXBP2, RAB27A, CHS1/LIST, SH2D1A, BIRC4, HPS1-7, характерных для гемофагоцитарного лимфогистиоцитоза; для проведения этого анализа берется кровь из вены.
- Возможны также консультации гематолога, терапевта.
Лечение гемофагоцитарный лимфогистиоцитоза
- Антибиотики (противомикробные средства) – назначаются при возникновении инфекционного бактериального процесса.
- Противовирусные препараты (при возникновении вирусной инфекции).
- Противогрибковые препараты (антимикотики) — при грибковой инфекции.
- Химиотерапия – в качестве лекарственных средств используются различные яды и токсины (яды биологического происхождения), которые подавляют рост опухолевых клеток.
- Иммуносупрессивная терапия – для этого метода лечения используются цитостатики – лекарственные препараты, подавляющие иммунную систему.
- Трансплантация (пересадка) костного мозга родственных или неродственных доноров.
Осложнения и последствия
- Инфекционные осложнения – появление инфекций, вызывающих значительную общую интоксикацию (отравление) организма: слабость, сонливость, повышение температуры тела до высоких цифр, нарушение работы внутренних органов.
- Малигнизация – появление опухолей (обычно лимфом (опухолей, возникших из лимфоидной ткани иммунной системы) или лейкемий (появление в кровяном русле незрелых клеток, которые вытесняют зрелые клетки, и кровь не может полноценно выполнять свои функции)).
- Аутоиммунные заболевания (заболевания, для которых характерна агрессия иммунной системы: она принимает клетки своего организма за чужеродные и начинает атаковать их).
- Иммунодефицит (снижение иммунитета).
- Дисфункция почек (почечная недостаточность – невозможность почек выполнять свои функции, необходимость диализа – подключения человека к специальному аппарату, выполняющему функции искусственной почки).
- Кровотечения.
- Летальный исход (смерть) от полиорганной недостаточности (нарушения функций многих внутренних органов), сепсиса (заражения крови) или другого инфекционного процесса.
Профилактика гемофагоцитарный лимфогистиоцитоза
Причины возникновения первичного гемофагоцитарного лимфогистиоцитоза до конца неясны, поэтому комплекс профилактических мероприятий не разработан.
Профилактика развития вторичного гемофагоцитарного лимфогистиоцитоза заключается в лечении основного заболевания. Например, при наличии:
- хронической вирусной инфекции необходимо правильное проведение противовирусной терапии;
- аутоиммунных заболеваний (для этих заболеваний характерна агрессия иммунной системы: она воспринимает клетки своего организма как чужеродные и начинает атаковать их) – прием иммуносупрессивных препаратов (подавляющих иммунную систему). Должен проводиться под контролем врача-ревматолога.
Источник
