Гемофагоцитарный синдром у детей прогноз
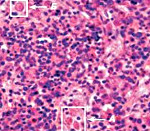

Гемофагоцитарный лимфогистиоцитоз – группа врожденных и приобретенных заболеваний, возникающих вследствие нарушений регуляции иммунного ответа и характеризующихся гиперпродукцией гистиоцитов, а также цитотоксических T-лимфоцитов. Клиническая симптоматика проявляется фебрильной лихорадкой, увеличением печени и селезенки, периферических лимфатических узлов, поражением нервной системы, костного мозга и других органов. Диагностика основана на данных клинического, лабораторного (цитопения, коагулопатия, билирубинемия и др.) и инструментального обследования. Лечение: иммуносупрессивная терапия, кортикостероиды, воздействие на причинные факторы.
Общие сведения
Гемофагоцитарный лимфогистиоцитоз (гемофагоцитарный синдром) – врожденное или приобретенное нарушение регуляции иммунного ответа, при котором происходит аномальная активация цитотоксических T-лимфоцитов, моноцитов и макрофагов с аккумуляцией в органах-мишенях и развитием в них выраженного патологического процесса (воспаления, повреждения тканей, фагоцитоза форменных элементов крови). При врожденной, генетически детерминированной форме заболевания болеют преимущественно дети раннего возраста и в 60-80% случаев – на первом году жизни.
Вторичный (приобретенный) гемофагоцитарный лимфогистиоцитоз встречается во всех возрастных категориях, развивается на фоне затяжного течения различных инфекционных заболеваний, аутоиммунных процессов и новообразований. Впервые признаки гемофагоцитарного синдрома были описаны еще в 1939 году, а заболевание тогда было названо гистиоцитарным медуллярным ретикулезом. Семейная наследственная форма лимфогистиоцитоза была впервые описана в 1959 году. Распространенность заболевания колеблется от 1 случая на 50 тысяч новорожденных до 1-2 случаев на 1 миллион детей в возрасте до 15 лет.
Гемофагоцитарный лимфогистиоцитоз
Причины гемофагоцитарного лимфогистиоцитоза
Врожденный гемофагоцитарный лимфогистиоцитоз возникает вследствие генетического дефекта механизмов клеточной цитотоксичности из-за мутаций гена перфорина. В норме регуляция иммунного ответа обеспечивается своевременным ограничением активности эффекторов иммунной системы в процессе ликвидации угрозы для организма со стороны проникших инфекционных агентов и других негативных воздействий. В этой регуляции важную роль играют механизмы клеточной цитотоксичности.
При первичном гемофагоцитарном лимфогистиоцитозе регулятивная роль цитотоксических гранул клеток и цитотоксических T-лимфоцитов в отношении клеток-мишеней нарушается, происходит чрезмерная активация иммунных клеток, в избытке продуцируются провоспалительные цитокины (интерфероны, фактор некроза опухоли и др.). Активированные вследствие «цитокинового шторма» T-лимфоциты и макрофаги инфильтрируют, а затем повреждают органы и ткани. Важным фактором патогенеза заболевания является развитие патологического гемофагоцитоза зрелых форменных элементов крови. Такой фагоцитоз происходит и в норме, помогая организму избавиться от старых клеток. В данном же случае макрофаги начинают фагоцитировать полноценные, нормально функционирующие форменные элементы крови, приводя к выраженной цитопении, коагулопатии и другим проявлениям заболевания.
Приобретенный (вторичный) гемофагоцитарный лимфогистиоцитоз развивается на фоне некоторых инфекционных заболеваний, опухолей, аутоиммунных процессов, при трансплантации органов и тканей, причем характерные нарушения регуляции иммунного ответа могут быть как следствием основного заболевания, так и осложнением, связанным с проведением иммуносупрессивной терапии и возникновением вторичной инфекции.
Симптомы гемофагоцитарного лимфогистиоцитоза
Клинические проявления гемофагоцитарного лимфогистиоцитоза чрезвычайно вариабельны. Наиболее часто наблюдается длительная лихорадка, рефрактерная к проводимой антибактериальной и противовирусной терапии. Озноб, признаки общей интоксикации (слабость, потливость, нарушения сна, отказ от приема пищи, тошнота и рвота, боли в мышцах) продолжаются в течение длительного времени, приобретая волнообразное течение с периодическими временными улучшениями самочувствия.
Характерным проявлением заболевания является увеличение печени и селезенки, имеющее прогрессирующий характер. К ранним симптомам первичного гемофагоцитарного лимфогистиоцитоза относится появление кожной сыпи, увеличение периферических лимфатических узлов, а также развитие неврологических расстройств в виде повышенной возбудимости, двигательных нарушений и расстройств чувствительности, судорожного синдрома, признаков повышения внутричерепного давления у детей раннего возраста. Встречаются при гемофагоцитарном лимфогистиоцитозе и симптомы, свидетельствующие о наличии анемии, коагулопатии – бледность и желтушность кожных покровов, периферические отеки, признаки кровотечения из пищеварительного тракта (черный кал, примесь крови в каловых массах и др.).
При вторичном гемофагоцитарном синдроме сочетаются клинические признаки поражения иммунной системы и проявления основного заболевания (вирусной инфекции, злокачественного новообразования, аутоиммунного заболевания).
Диагностика гемофагоцитарного лимфогистиоцитоза
Диагноз устанавливается в результате тщательного изучения анамнеза, клинической картины заболевания, результатов лабораторных и инструментальных исследований. Необходимы осмотры врача-гематолога, аллерголога-иммунолога, онколога, инфекциониста, ревматолога и других специалистов. Разработаны международные диагностические критерии гемофагоцитарного лимфогистиоцитоза, к которым относятся:
- лихорадка с повышением температуры выше 38,5 градусов, продолжающаяся более недели;
- увеличение печени и селезенки;
- цитопения с уменьшением гемоглобина ниже 90 г/л, тромбоцитов – меньше 100000 клеток/мкл, нейтрофилов – меньше 1000/мкл;
- признаки коагулопатии;
- увеличение ферритина больше 500 нг/мл;
- повышение уровня растворимого sCD25 в крови;
- низкое или полное отсутствие активности NK-клеток.
Наличие хотя бы пяти из этих признаков свидетельствует о гемофагоцитарном лимфогистиоцитозе. Для установления наследственной формы заболевания необходимо генетическое исследование, в результате которого обнаруживаются мутации генов PRF1, UNC13D, Munc18-2, STX11.
Приобретенные формы гемофагоцитарного синдрома диагностируются на основании вышеописанных международных критериев и проведения уточненной диагностики основного заболевания, для чего зачастую необходимо выполнять сложные лабораторные и инструментальные исследования (эндоскопические, УЗИ, КТ, МРТ, ПЭТ).
Дифференциальный диагноз гемофагоцитарного лимфогистиоцитоза проводится с:
- различными врожденными и приобретенными иммунными заболеваниями,
- болезнями крови,
- острыми и хроническими вирусными инфекциями,
- злокачественными новообразованиями (острым лимфобластным лейкозом, неходжкинскими лимфомами, другими злокачественными опухолями после проведенной химиотерапии),
- системными заболеваниями соединительной ткани: системной красной волчанкой, ювенильным дерматомиозитом, узелковым периартериитом, ювенильным ревматоидным артритом.
Лечение гемофагоцитарного лимфогистиоцитоза
Современная тактика лечения наследственной формы гемофагоцитарного лимфогистиоцитоза включает проведение химиотерапии с использованием иммуносупрессивных средств (дексаметазона, этопозида, циклоспорина A), а также трансплантации стволовых клеток. Прогноз заболевания значительно улучшается при своевременном проведении трансплантации от гистосовместимого родственного донора.
При вирусных, бактериальных и паразитарных инфекциях, вызвавших появление гемофагоцитарного синдрома, проводится этиотропная антимикробная терапия, инфузии высокодозного иммуноглобулина, а также иммуносупрессивная терапия с введением циклоспорина A и кортикостероидов. Иногда показано проведение трансплантации костного мозга. При опухолях, наряду с лечением основного заболевания, в терапевтическую схему включаются иммуносупрессивные средства в индивидуально подобранных дозах. При аутоиммунных процессах лечение включает сочетание иммуноглобулина, пульс-терапии с использованием кортикостероидов, а также циклоспорина A.
Источник
Суть болезни
Гемофагоцитарный лимфогистиоцитоз (ГЛГ) – редкое и тяжелое гематологическое заболевание. Оно характеризуется аномальным размножением и активацией особых клеток организма – гистиоцитов (тканевых макрофагов).
Термин «лимфогистиоцитоз» означает, что в развитии болезни, кроме гистиоцитов, участвуют также и неправильно функционирующие лимфоциты. В свою очередь, термин «гемофагоцитарный» означает, что при этой болезни макрофаги поглощают клетки крови (эритроциты, лейкоциты, тромбоциты) и их клетки-предшественники в различных органах и тканях. Этот процесс и называтся гемофагоцитозом.
В результате аномальной активности лимфоцитов и макрофагов возникают тяжелые поражения органов, включая печень, селезенку, лимфатические узлы, кожу, легкие, головной мозг и т.п. Одновременно гемофагоцитоз приводит к цитопении – состоянию дефицита клеток крови.
ГЛГ не является злокачественным заболеванием; в настоящее время считается, что его причина – нарушение регуляции клеточного иммунитета.
Частота встречаемости, факторы риска
ГЛГ – редкое заболевание. По зарубежным данным, частота его врожденной формы – около 1 случая на 50 000 новорожденных.
Различают первичный (семейный, врожденный) и вторичный (приобретенный) ГЛГ. Нарушения при первичном варианте болезни обусловлены наследственными факторами и чаще всего проявляются в очень раннем возрасте, обычно до 12-18 месяцев. Наследование первичного ГЛГ – аутосомно-рецессивное, то есть больной ребенок может родиться (с вероятностью 25%) только тогда, когда оба родителя являются носителями «дефектных» генов. Поэтому ГЛГ чаще встречается при близкородственных браках. Известно несколько разновидностей болезни, которым соответствуют разные генетические дефекты. Мальчики и девочки болеют с одинаковой частотой, зависимости от этнического происхождения также не выявлено. Семьям, где уже были случаи ГЛГ у детей, рекомендована консультация генетика. Возможна пренатальная (то есть до рождения ребенка) ДНК-диагностика.
Вторичный ГЛГ может возникнуть при аномальной активации клеток в результате некоторых инфекций (например, инфицирования вирусом Эпштейна-Барр), злокачественных опухолей, аутоиммунных заболеваний и иммунодефицитных состояний. Эта форма обычно наблюдается в более позднем возрасте, чем первичный ГЛГ.
Признаки и симптомы
Для ГЛГ характерно упорное повышение температуры, причем лихорадка не поддается лечению антибактериальными препаратами. Наблюдается увеличение селезенки (спленомегалия), обычно также увеличение печени (гепатомегалия). Более чем в половине случаев возникает кожная сыпь, поражающая также и волосистую часть головы. Часто встречается увеличение лимфоузлов – лимфаденопатия. Нередки признаки поражения центральной нервной системы (ЦНС): изменения поведения, нарушения координации движений, судороги. Другие возможные симптомы – желтуха, отеки, признаки поражения желудочно-кишечного тракта (боли в животе, рвота, понос, отказ от пищи, потеря веса).
Кроме того, при ГЛГ возникают клинические проявления цитопении, то есть состояния дефицита клеток крови: недостаток эритроцитов проявляется бледностью и слабостью, недостаток тромбоцитов – синяками и кровотечениями (возможны, например, кровотечения из десен), недостаток лейкоцитов – частыми инфекциями.
Диагностика
При выявлении указанных клинических признаков производятся лабораторные исследования с целью подтвердить или исключить диагноз ГЛГ. В общем анализе крови наблюдается цитопения: анемия, тромбоцитопения и/или нейтропения. Присутствуют также характерные изменения в биохимическом анализе крови. Гистологические исследования указывают на накопление лимфоцитов и макрофагов в различных органах, включая селезенку, лимфоузлы, костный мозг, печень и ЦНС. В образцах тканей, взятых посредством биопсии, наблюдается явление гемофагоцитоза (см. выше), но не всегда выявленные изменения бывает легко оценить.
Используются иммунологические тесты, позволяющие обнаружить именно те иммунные нарушения, которые обычно приводят к развитию ГЛГ (снижение активности NK-лимфоцитов.
Диагноз первичного ГЛГ подтверждается молекулярно-генетическим анализом, так как известен целый ряд соответствующих ему генетических дефектов. В то же время вторичный ГЛГ может иметь сходные клинические проявления, но диагностироваться только по совокупности перечисленных и некоторых других клинических и лабораторных признаков.
Лечение
При ГЛГ огромную роль играют своевременная диагностика и начало лечения, так как состояние больного может ухудшаться очень быстро.
В лечении ГЛГ используется химиотерапия. Так, протокол HLH-2004 предполагает использование дексаметазона, этопозида, циклоспорина, а также применение метотрексата в случае поражения ЦНС. Сопроводительная терапия обязательно включает в себя профилактику инфекций. При необходимости производятся переливания компонентов крови.
При врожденном ГЛГ после химиотерапии, позволяющей стабилизировать состояние пациента, необходима аллогенная трансплантация костного мозга. Без трансплантации невозможно достичь продолжительной ремиссии. Трансплантация может также понадобиться в некоторых случаях вторичного (приобретенного) ГЛГ, хотя в международной медицинской практике вопрос о лечении таких больных не решен однозначно.
Прогноз
Первичный ГЛГ без лечения приводит к смертельному исходу. Непосредственной причиной смерти может быть, например, полиорганная недостаточность, сепсис или грибковая инфекция. Даже при условии применения химиотерапии ремиссия обычно непродолжительна и долговременная выживаемость низка. Основную надежду на излечение дает аллогенная трансплантация костного мозга, несмотря на тяжесть этой процедуры и связанные с ней опасные осложнения. Так, в одном из зарубежных исследований пятилетняя выживаемость пациентов после трансплантации достигала 66%, тогда как без трансплантации составляла лишь 10%. В случае успешной трансплантации пациенты могут в дальнейшем иметь нормальные качество и продолжительность жизни.
При вторичном ГЛГ прогноз сильно варьирует в зависимости от конкретного случая заболевания: зафиксированы как случаи с крайне тяжелым течением, плохо поддающиеся терапии, так и случаи самопроизвольного улучшения.
Источник
За последние десятилетия достигнуты значительные успехи в изучении биологических особенностей системы макрофагов, которая рассматривается как биологический фильтр крови и лимфы, способствует удалению микроорганизмов, клеток, пораженных опухолевыми и инфицированными вирусами, токсинов, метаболитов, остатков лекарственных препаратов.
Гемофагоцитарный синдром в качестве нозологической формы включает группу приобретенных и врожденных патологических состояний, в основе которых лежат нарушения регуляции иммунного ответа к аномалиям активизации цитотоксических Т-лимфоцитов и макрофагов и возникновению опосредованного ими повреждения пораженных органов воспалительного.
Основное понятие
Понятие «гемофагоцитоз» означает патоморфологический феномен фагоцитоза форменных зрелых элементов крови макрофагами тканей. Феномен этот достаточно распространен и не считается синонимом лимфогистиоцитоза гемофагоцитарного вида как нозологической формы.

Внимание к данной патологии в клинической практике инфекционистов обусловлено тем, что на диагностическом этапе пациенты с традиционными наследственными формами гемофагоцитарного лимфогистиоцитоза, в силу особенностей медицинской презентации, часто отмечаются в инфекционных стационарах с идентичными диагнозами, такими как, например, внутриутробная инфекция или процесс, ассоциированный с сепсисом и, зачастую, истинный диагноз устанавливают с опасной длительной задержкой.
С другой стороны, течение множества банальных инфекций может быть осложнено развитием угрожающего жизни вторичного гемофагоцитарного синдрома. Он требует в дополнение к стандартному этиотропному лечению проведения иммуносупрессивной и иммуномодулирующей терапии, которая должна быть направлена на контроль патологической активизации иммунного ответа. В соответствии с классификацией, принятой Обществом по изучению гистиоцитозов в гемофагоцитарный лимфогистиоцитоз причислен к категории заболеваний с вариабильной клинической картиной.

К первичным, то есть наследственно детерминированным гемофагоцитарным синдромам относятся семейный лимфогистиоцитоз и некоторые редкие первичные иммунодефициты. Ко вторичным можно отнести формы, которые развиваются в контексте опухолевых, инфекционных и аутоиммунных патологических явлений.
Необходимо подчеркнуть, что по мере исследования молекулярных механизмов возникновения патологии грань между генетически детерминированными и вторичными лимфогистиоцитозами существенно утрачивает четкость.
Как проявляется гемофагоцитарный синдром у взрослых и детей?
Симптоматика
Клиническая картина недуга характеризуется продолжительной лихорадкой, рефрактерной к антибактериальным медикаментозным препаратам, сплено-мегалией, геморрагическим синдромом, отечным синдромом, гепатомегалией, признаками поражения ЦНС. Патологический процесс в большинстве случаев начинается крайне остро. Триггером клинической манифестации патологии является банальное инфицирование.
Психомоторное и физическое развитие пациента до момента возникновения гемофагоцитарного синдрома в большинстве случаев не страдает. На первоначальном этапе обследования зачастую диагностируется внутриутробная инфекция либо (на более поздних стадиях развития болезни) менингоэнцефалит или сепсис. Некупирующаяся лихорадка и проявления интоксикации становятся основной причиной госпитализации в стационар инфекционной больницы, где при диагностическом обследовании зачастую удается при помощи лабораторных методик подтвердить инфицирование наиболее распространенным патогеном. Назначение этиотропного лечения при этом не приводит к значительному улучшению состояния больного.
Временная нормализация состояния может отмечаться при назначении кортикостероидов в соответствии с тяжестью состояния. Однако чаще всего сохраняется лихорадка, гепатоспленомегалия прогрессирует, начинает появляться геморрагический синдром, неврологическая симптоматика существенно нарастает и включает в себя выраженную раздражительность, рвоту, отказ от еды, возникновение судорог, менингеальных симптомов.
В некоторых случаях начало патологического процесса проходит под видом изолированного энцефаломиелита, энцефалита, а рецидивирующие приступы ведут к формированию устойчивого неврологического дефицита. Как правило, клинические проявления гемофагоцитарного синдрома у детей и взрослых дополняются характерными изменениями в лабораторных показателях, обязательно включающими в себя цитопению периферической крови, с вовлечением двух или более ветвей кроветворения.
Анемия и тромбоцитопения
В большинстве случаев на ранних этапах развития заболевания выявляется анемия и тромбоцитопения, а по мере его прогрессирования развивается нейтропения и лейкопения. Характерно также возникновение коагулопатии, которая наиболее часто проявляется гипофибриногенемией, несколько реже – в виде тотальной гипокоагуляции.
Среди значений биохимического исследования крови наиболее характерны гипоальбуминемия, гипертриглицеридемия, гипонатриемия, повышение уровня лактатдегидрогеназы и билирубина.

Увеличение ферритина
Довольно характерно также увеличение содержания ферритина в сыворотке, в некоторых случаях до экстремального уровня (более 10 000 мкг/л). При лабораторном исследовании спинномозговой жидкости обнаруживается умеренный моноцитарный и лимфоцитарный плеоцитоз, увеличение уровня белка.
При проведении миелограммы посредством стандартного окрашивания наблюдается полиморфная картина в костном мозге с активированными макрофагами или моноцитами, а также явлениями фагоцитоза в клеточных элементах (эритроциты, реже – тромбоциты и лейкоциты). Наиболее специфичным проявлением при лабораторном изучении гемофагоцитарного синдрома является понижение NK-клеточной цитотоксичности.
Классификация
Гемофагоцитарный лимфогистиоцитоз относится к категории “H” в современной классификации гистиоцитоза. Выделяются первичные формы этого заболевания, обусловленные известными генетическими дефектами, и вторичные, которые не связаны с наследуемой генетической аномалией.
Полная классификация данной патологии:
- первичный синдром: наследственные патологии, ведущие к развитию ГЛГ;
- ГЛГ, ассоциированный с дефектом цитотоксичности лимфоцитов;
- ГЛГ, ассоциированный с дефектами активации инфламмасомы;
- ГЛГ, ассоциированный с наследственными заболеваниями, влияющими на развитие воспалительного процесса;
- семейные формы ГЛГ с неустановленными генетическими дефектами;
- вторичный гемофагоцитарный синдром, ассоциированный с инфекцией;
- вирус-ассоциированный ГЛГ;
- ГЛГ, ассоциированный с бактериальными инфекциями;
- ГЛГ, ассоциированный с грибковыми инфекциями;
- ГЛГ, ассоциированный с паразитарными инфекциями;
- ГЛГ, который ассоциирован со злокачественными новообразованиями;
- ГЛГ, ассоциированный с поведением химиотерапии (не связанный с первичным возникновением злокачественной опухоли);
- ГЛГ, ассоциированный с развитием ревматологических заболеваний;
- ГЛГ, ассоциированный с трансплантацией;
- ГЛГ, который ассоциирован с иатрогенной активизацией иммунной системы;
- синдром, ассоциированный с развитием ятрогенной иммуносупрессии;
- гемофагоцитарный синдром, ассоциированный с сепсисом.

Прокальцитонин
Прокальцитонин — это соединение, которое относится к гликопротеинам их белково-углеводного комплекса, в составе которого присутствуют 116 аминокислот. Он представляет собой предшественника кальцитонина, соединения гормонального характера, продуцируемого, главным образом, в щитовидной железе С-клетками.
Прокальцитонин в ходе метаболических процессов распадается на кальцитонин, катакальцин и концевой пептид. Повышение уровня данного соединения зачастую отмечается при мелкоклеточной карциноме легких, что говорит о его формировании не только в щитовидной железе. Кроме того, что наиболее интересно, особенно ярко наблюдается изменение концентрации прокальцитонина при гемофагоцитарном синдроме у детей.
Это предположительно фатальное осложнение, в основе которого лежат нарушения регуляции иммунного ответа в результате мутаций в генах, контролирующих цитолитические функции, приводящих к дефективной активации цитотоксических моноцитов, Т-лимфоцитов, макрофагов и возникновению системного воспалительного ответа у ребенка. Это заболевание относится к категории гистиоцитарных, которые развиваются из клеток макрофагального ряда. Крайне важно проведение при этом лабораторной диагностики по выявлению уровня прокальцитонина и других специфических соединений в крови.
Вторичный синдром как развивается?
Вторичный гемофагоцитарный синдром у детей возникает, как правило, при инфекциях, ревматических патологиях, злокачественных образованиях и у онкогематологической категории болезней. Доказана ассоциация ГФС вторичного характера с рядом патогенов, который включает как вирусы (герпесвирус, ВИЧ, грипп А, парвовирус В19, аденовирус), бактерии (микобактерии, сальмонеллы, микоплазмы, риккетсии, пневмококк), так грибки и простейшие.
Герпервирусы
Среди вирусов, наиболее часто ассоциированных со вторичным гемофагоцитарным синдромом, на первом месте находятся герпесвирусы. Одновременно с этим, данный недуг способен имитировать ряд инфекционных болезней, например, висцерального лейшманиоза, лептоспироза и сепсиса.
Комплекс ГФС включает спленомегалию, лихорадку, поражение ЦНС, гепатит, коагуляционные нарушения, цитопении, множество биохимических маркеров. Вышеуказанные признаки довольно неспецифичны, что существенно осложняет диагностику подобного патологического состояния, особенно на ранних этапах, приводя к неоднозначному прогнозу жизни особенно у иммунокомпрометированных пациентов.
Как выявляют вторичный и первичный гемофагоцитарный синдром?

Диагностика
Первичная диагностика заболевания включает сбор анамнеза и жалоб больного, а также проведение физикального обследования. Далее проводится необходимая лабораторная диагностика, при которой необходимо выяснение уровня следующих веществ в крови:
- билирубин прямой и общий;
- АЛТ/АСТ;
- ЛДГ;
- альбумин;
- натрий;
- триглицериды;
- ферритин;
- мочевина;
- креатинин.
Кроме того, необходимо проведение коагулограммы, исследований спинномозговой жидкости, цитометрии и т. д.
Инструментальная диагностика
Инструментальная диагностика включает:
- МРТ головного мозга c контрастированием гадолинием;
- КТ легких;
- УЗИ брюшной полости;
- Рентген грудной клетки.
Узнаем, каковы перспективы при гемофагоцитарном синдроме у детей и взрослых?
Лечение
Целью консервативного лечения является подавление воспалительного ответа, восстановление функционирования органов и выполнение трансплантации стволовых гемопоэтических клеток. ТГСК – единственная куративная методика терапии. Далее проводится иммуносупрессивная химиотерапия, комбинированная с применением медикаментозных препаратов: «Дексаметазон», «Метотрексат», «Преднизолон», «Циклоспогрин А» и т. д.
Длительность излечения гемофагоцитарного синдрома и установление дозировок проводится врачом.
Трансплантация
Современные тактики лечения наследственных форм лимфогистиоцитоза включают не только вышеперечисленные методики. Прогноз заболевания существенно улучшается при своевременном осуществлении трансплантации от совместимого родственного донора. При бактериальных, вирусных и паразитарных инфекциях, спровоцировавших появление данного синдрома, реализуется этиотропная противомикробная терапия, инфузии иммуноглобулина в высоких дозах, а также иммуносупрессивное лечение. Иногда показана трансплантация костного мозга.
Прогноз при гемофагоцитарном синдроме
Это напрямую связано с запущенностью патологического процесса и его формой. Первичный синдром лечится гораздо сложнее, и шансов на выздоровление при этом сравнительно немного. Крайне негативный прогноз у детей с врожденными формами заболевания – при несвоевременном лечении и сложных формах патологии очень высок процент смертности.
Источник
