Гемофагоцитарный синдром у детей лечение
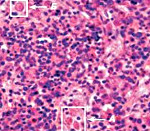
Гемофагоцитарный лимфогистиоцитоз – группа врожденных и приобретенных заболеваний, возникающих вследствие нарушений регуляции иммунного ответа и характеризующихся гиперпродукцией гистиоцитов, а также цитотоксических T-лимфоцитов. Клиническая симптоматика проявляется фебрильной лихорадкой, увеличением печени и селезенки, периферических лимфатических узлов, поражением нервной системы, костного мозга и других органов. Диагностика основана на данных клинического, лабораторного (цитопения, коагулопатия, билирубинемия и др.) и инструментального обследования. Лечение: иммуносупрессивная терапия, кортикостероиды, воздействие на причинные факторы.
Общие сведения
Гемофагоцитарный лимфогистиоцитоз (гемофагоцитарный синдром) – врожденное или приобретенное нарушение регуляции иммунного ответа, при котором происходит аномальная активация цитотоксических T-лимфоцитов, моноцитов и макрофагов с аккумуляцией в органах-мишенях и развитием в них выраженного патологического процесса (воспаления, повреждения тканей, фагоцитоза форменных элементов крови). При врожденной, генетически детерминированной форме заболевания болеют преимущественно дети раннего возраста и в 60-80% случаев – на первом году жизни.
Вторичный (приобретенный) гемофагоцитарный лимфогистиоцитоз встречается во всех возрастных категориях, развивается на фоне затяжного течения различных инфекционных заболеваний, аутоиммунных процессов и новообразований. Впервые признаки гемофагоцитарного синдрома были описаны еще в 1939 году, а заболевание тогда было названо гистиоцитарным медуллярным ретикулезом. Семейная наследственная форма лимфогистиоцитоза была впервые описана в 1959 году. Распространенность заболевания колеблется от 1 случая на 50 тысяч новорожденных до 1-2 случаев на 1 миллион детей в возрасте до 15 лет.

Гемофагоцитарный лимфогистиоцитоз
Причины гемофагоцитарного лимфогистиоцитоза
Врожденный гемофагоцитарный лимфогистиоцитоз возникает вследствие генетического дефекта механизмов клеточной цитотоксичности из-за мутаций гена перфорина. В норме регуляция иммунного ответа обеспечивается своевременным ограничением активности эффекторов иммунной системы в процессе ликвидации угрозы для организма со стороны проникших инфекционных агентов и других негативных воздействий. В этой регуляции важную роль играют механизмы клеточной цитотоксичности.
При первичном гемофагоцитарном лимфогистиоцитозе регулятивная роль цитотоксических гранул клеток и цитотоксических T-лимфоцитов в отношении клеток-мишеней нарушается, происходит чрезмерная активация иммунных клеток, в избытке продуцируются провоспалительные цитокины (интерфероны, фактор некроза опухоли и др.). Активированные вследствие «цитокинового шторма» T-лимфоциты и макрофаги инфильтрируют, а затем повреждают органы и ткани. Важным фактором патогенеза заболевания является развитие патологического гемофагоцитоза зрелых форменных элементов крови. Такой фагоцитоз происходит и в норме, помогая организму избавиться от старых клеток. В данном же случае макрофаги начинают фагоцитировать полноценные, нормально функционирующие форменные элементы крови, приводя к выраженной цитопении, коагулопатии и другим проявлениям заболевания.
Приобретенный (вторичный) гемофагоцитарный лимфогистиоцитоз развивается на фоне некоторых инфекционных заболеваний, опухолей, аутоиммунных процессов, при трансплантации органов и тканей, причем характерные нарушения регуляции иммунного ответа могут быть как следствием основного заболевания, так и осложнением, связанным с проведением иммуносупрессивной терапии и возникновением вторичной инфекции.
Симптомы гемофагоцитарного лимфогистиоцитоза
Клинические проявления гемофагоцитарного лимфогистиоцитоза чрезвычайно вариабельны. Наиболее часто наблюдается длительная лихорадка, рефрактерная к проводимой антибактериальной и противовирусной терапии. Озноб, признаки общей интоксикации (слабость, потливость, нарушения сна, отказ от приема пищи, тошнота и рвота, боли в мышцах) продолжаются в течение длительного времени, приобретая волнообразное течение с периодическими временными улучшениями самочувствия.
Характерным проявлением заболевания является увеличение печени и селезенки, имеющее прогрессирующий характер. К ранним симптомам первичного гемофагоцитарного лимфогистиоцитоза относится появление кожной сыпи, увеличение периферических лимфатических узлов, а также развитие неврологических расстройств в виде повышенной возбудимости, двигательных нарушений и расстройств чувствительности, судорожного синдрома, признаков повышения внутричерепного давления у детей раннего возраста. Встречаются при гемофагоцитарном лимфогистиоцитозе и симптомы, свидетельствующие о наличии анемии, коагулопатии – бледность и желтушность кожных покровов, периферические отеки, признаки кровотечения из пищеварительного тракта (черный кал, примесь крови в каловых массах и др.).
При вторичном гемофагоцитарном синдроме сочетаются клинические признаки поражения иммунной системы и проявления основного заболевания (вирусной инфекции, злокачественного новообразования, аутоиммунного заболевания).
Диагностика гемофагоцитарного лимфогистиоцитоза
Диагноз устанавливается в результате тщательного изучения анамнеза, клинической картины заболевания, результатов лабораторных и инструментальных исследований. Необходимы осмотры врача-гематолога, аллерголога-иммунолога, онколога, инфекциониста, ревматолога и других специалистов. Разработаны международные диагностические критерии гемофагоцитарного лимфогистиоцитоза, к которым относятся:
- лихорадка с повышением температуры выше 38,5 градусов, продолжающаяся более недели;
- увеличение печени и селезенки;
- цитопения с уменьшением гемоглобина ниже 90 г/л, тромбоцитов – меньше 100000 клеток/мкл, нейтрофилов – меньше 1000/мкл;
- признаки коагулопатии;
- увеличение ферритина больше 500 нг/мл;
- повышение уровня растворимого sCD25 в крови;
- низкое или полное отсутствие активности NK-клеток.
Наличие хотя бы пяти из этих признаков свидетельствует о гемофагоцитарном лимфогистиоцитозе. Для установления наследственной формы заболевания необходимо генетическое исследование, в результате которого обнаруживаются мутации генов PRF1, UNC13D, Munc18-2, STX11.
Приобретенные формы гемофагоцитарного синдрома диагностируются на основании вышеописанных международных критериев и проведения уточненной диагностики основного заболевания, для чего зачастую необходимо выполнять сложные лабораторные и инструментальные исследования (эндоскопические, УЗИ, КТ, МРТ, ПЭТ).
Дифференциальный диагноз гемофагоцитарного лимфогистиоцитоза проводится с:
- различными врожденными и приобретенными иммунными заболеваниями,
- болезнями крови,
- острыми и хроническими вирусными инфекциями,
- злокачественными новообразованиями (острым лимфобластным лейкозом, неходжкинскими лимфомами, другими злокачественными опухолями после проведенной химиотерапии),
- системными заболеваниями соединительной ткани: системной красной волчанкой, ювенильным дерматомиозитом, узелковым периартериитом, ювенильным ревматоидным артритом.
Лечение гемофагоцитарного лимфогистиоцитоза
Современная тактика лечения наследственной формы гемофагоцитарного лимфогистиоцитоза включает проведение химиотерапии с использованием иммуносупрессивных средств (дексаметазона, этопозида, циклоспорина A), а также трансплантации стволовых клеток. Прогноз заболевания значительно улучшается при своевременном проведении трансплантации от гистосовместимого родственного донора.
При вирусных, бактериальных и паразитарных инфекциях, вызвавших появление гемофагоцитарного синдрома, проводится этиотропная антимикробная терапия, инфузии высокодозного иммуноглобулина, а также иммуносупрессивная терапия с введением циклоспорина A и кортикостероидов. Иногда показано проведение трансплантации костного мозга. При опухолях, наряду с лечением основного заболевания, в терапевтическую схему включаются иммуносупрессивные средства в индивидуально подобранных дозах. При аутоиммунных процессах лечение включает сочетание иммуноглобулина, пульс-терапии с использованием кортикостероидов, а также циклоспорина A.
Источник
Причины и симптомы гемофагоцитарного синдрома
Гемофагоцитарный синдром и его причины
За последние десятилетия достигнуты значительные успехи в изучении биологических особенностей системы макрофагов, которая рассматривается как биологический фильтр крови и лимфы, способствует удалению микроорганизмов, клеток пораженных опухолевыми и инфицированными вирусами, токсинов, метаболитов, остатков лекарственных препаратов.
В процессах очищения организма участвуют мононуклеарные фагоциты печени и селезенки, моноциты, макрофаги лимфоузлов, альвеолярные макрофаги.
Повышенная активность макрофагов приводит к нерегулируемому фагоцитозу клеток крови — это и является отличительной особенностью гемофагоцитарного синдрома (ГФС). Это заболевание наследственное или приобретенное, относится к группе гистиоцитарных синдромов, объединяющей заболевания, характеризующиеся пролиферацией моноцитов, макрофагов и дендритных клеток.
Симптомы ГФС
Симптомы заболевания описаны в 1952 г. характеризуется стабильной лихорадкой, снижением состава веществ формирующих кровь, увеличением печени и селезенки с признаками выраженного геморрагического синдрома.
У больных отмечается нарушения работы печени, повышенный уровень ферритина и трансаминазина, неврологические симптомы с нарушением работы центральной нервной системы, повышенное содержание триглицеридов в плазме крови, коагулопатия с повышенной свертываемостью крови.
Клиническая картина многих больных – увеличение лимфатических узлов, высыпания, желтуха и отеки. В красной пульпе селезенки, синусоидах печени, синусах лимфатических узлов, в костном мозге и ЦНС при проявлениях ГФС имеется диффузная инфильтрация органов и тканей активированными макрофагами с признаками гемофагоцитоза. При этом истощается лимфоидная ткань. Биопсия печени показывает изменения характерные для хронического персистирующего гепатита.
Известны два различных состояния, по начальным клиническим симптомам их трудно отличить друг от друга.
1. Наследственный гемофагоцитарный лимфогистиоцитоз – это аутосомно-рецессивное заболевание, в формировании которого мутация в гене перфорина играет важную роль (20-40% случаев СГЛГ).
2. Вторичный гемофагоцитарный лимфогистиоцитоз – синдром макрофагальной активации с гемофагоцитозом, развивающийся в результате иммунной активации системы мононуклеарных фагоцитов. В большинстве случаев у больных гемофагоцитарным лимфогистиоцитозом нет иммунодефицита. Развитие ГЛГ может индуцироваться ревматическими болезнями, злокачественными опухолями, метаболическими заболеваниями.
Формы гемофагоцитарного синдрома
На сегодняшний день есть четыре формы заболевания, для трех из которых определены гены, ответственные за синтез белков. Они участвуют в опосредуемой CD8 Т — и NK-клетками цитотоксичности и кодируют перфорин – белок, встраивающийся в липидный бислой мембраны клетки-мишени и запускающий её гибель.
Диагностика гемофагоцитарного синдрома
Невероятно сложен дифференциальный диагноз между первичным и вторичным ГЛГ при отсутствии семейного анамнеза. Для установления диагноза требуется гистологическая идентификация гемофагоцитоза в органах. Выявленные патологии сложно оценить на основании данных биопсии костного мозга, лимфатических узлов или печени. Иммунологические тесты, демонстрирующие угнетение деятельности NK-клеток и увеличение уровня рецептора интерлейкина-2 не являются определяющими в диагнозе. Диагноз ГЛГ устанавливается на основании симптомокомплекса, в который включена гепатомегалия, спленомегалия, лейкопения, тромбоцитопения, анемия, гипофибриногенемия, гипертриглицеридемия, поражение ЦНС. Окончательная верификация формы заболевания выполняется на основании молекулярно-генетического анализа. Наиболее часто встречающимся вариантом ГФС У взрослых ГФС встречается в виде ИАГФС. Вирусные инфекции, особенно обусловленные вирусом Эпштейна – Барр (EBV), могут инициировать как первичный, так и вторичный ГЛГ.
Лечение гемофагоцитарного синдрома
Лечение нужно начинать на ранних стадиях заболевания. Ранняя терапия иммунодепрессантами, применение противовирусных препаратов, плазмаферез и симптоматическая терапия помогут, чтобы гемофагоцитарный синдром не был рецидивирующим, тяжелым и персистирующим с необратимыми последствиями.
В лечении используются протокольная полихимиотерапия, аллогенная трансплантация стволовой гемопоэтической клетки от совместимого донора, это способствует постепенному выздоровлению. К сожалению, данная болезнь очень коварна, часто проведенная спленэктомия способствует выздоровлению и хорошему самочувствию больных, позволяя нормально жить и работать.
 Автор статьи: Мочалов Павел Александрович | д. м. н. терапевт
Автор статьи: Мочалов Павел Александрович | д. м. н. терапевт
Образование:
Московский медицинский институт им. И. М. Сеченова, специальность — «Лечебное дело» в 1991 году, в 1993 году «Профессиональные болезни», в 1996 году «Терапия».
Наши авторы
Источник
Суть болезни
Гемофагоцитарный лимфогистиоцитоз (ГЛГ) – редкое и тяжелое гематологическое заболевание. Оно характеризуется аномальным размножением и активацией особых клеток организма – гистиоцитов (тканевых макрофагов).
Термин «лимфогистиоцитоз» означает, что в развитии болезни, кроме гистиоцитов, участвуют также и неправильно функционирующие лимфоциты. В свою очередь, термин «гемофагоцитарный» означает, что при этой болезни макрофаги поглощают клетки крови (эритроциты, лейкоциты, тромбоциты) и их клетки-предшественники в различных органах и тканях. Этот процесс и называтся гемофагоцитозом.
В результате аномальной активности лимфоцитов и макрофагов возникают тяжелые поражения органов, включая печень, селезенку, лимфатические узлы, кожу, легкие, головной мозг и т.п. Одновременно гемофагоцитоз приводит к цитопении – состоянию дефицита клеток крови.
ГЛГ не является злокачественным заболеванием; в настоящее время считается, что его причина – нарушение регуляции клеточного иммунитета.
Частота встречаемости, факторы риска
ГЛГ – редкое заболевание. По зарубежным данным, частота его врожденной формы – около 1 случая на 50 000 новорожденных.
Различают первичный (семейный, врожденный) и вторичный (приобретенный) ГЛГ. Нарушения при первичном варианте болезни обусловлены наследственными факторами и чаще всего проявляются в очень раннем возрасте, обычно до 12-18 месяцев. Наследование первичного ГЛГ – аутосомно-рецессивное, то есть больной ребенок может родиться (с вероятностью 25%) только тогда, когда оба родителя являются носителями «дефектных» генов. Поэтому ГЛГ чаще встречается при близкородственных браках. Известно несколько разновидностей болезни, которым соответствуют разные генетические дефекты. Мальчики и девочки болеют с одинаковой частотой, зависимости от этнического происхождения также не выявлено. Семьям, где уже были случаи ГЛГ у детей, рекомендована консультация генетика. Возможна пренатальная (то есть до рождения ребенка) ДНК-диагностика.
Вторичный ГЛГ может возникнуть при аномальной активации клеток в результате некоторых инфекций (например, инфицирования вирусом Эпштейна-Барр), злокачественных опухолей, аутоиммунных заболеваний и иммунодефицитных состояний. Эта форма обычно наблюдается в более позднем возрасте, чем первичный ГЛГ.
Признаки и симптомы
Для ГЛГ характерно упорное повышение температуры, причем лихорадка не поддается лечению антибактериальными препаратами. Наблюдается увеличение селезенки (спленомегалия), обычно также увеличение печени (гепатомегалия). Более чем в половине случаев возникает кожная сыпь, поражающая также и волосистую часть головы. Часто встречается увеличение лимфоузлов – лимфаденопатия. Нередки признаки поражения центральной нервной системы (ЦНС): изменения поведения, нарушения координации движений, судороги. Другие возможные симптомы – желтуха, отеки, признаки поражения желудочно-кишечного тракта (боли в животе, рвота, понос, отказ от пищи, потеря веса).
Кроме того, при ГЛГ возникают клинические проявления цитопении, то есть состояния дефицита клеток крови: недостаток эритроцитов проявляется бледностью и слабостью, недостаток тромбоцитов – синяками и кровотечениями (возможны, например, кровотечения из десен), недостаток лейкоцитов – частыми инфекциями.
Диагностика
При выявлении указанных клинических признаков производятся лабораторные исследования с целью подтвердить или исключить диагноз ГЛГ. В общем анализе крови наблюдается цитопения: анемия, тромбоцитопения и/или нейтропения. Присутствуют также характерные изменения в биохимическом анализе крови. Гистологические исследования указывают на накопление лимфоцитов и макрофагов в различных органах, включая селезенку, лимфоузлы, костный мозг, печень и ЦНС. В образцах тканей, взятых посредством биопсии, наблюдается явление гемофагоцитоза (см. выше), но не всегда выявленные изменения бывает легко оценить.
Используются иммунологические тесты, позволяющие обнаружить именно те иммунные нарушения, которые обычно приводят к развитию ГЛГ (снижение активности NK-лимфоцитов.
Диагноз первичного ГЛГ подтверждается молекулярно-генетическим анализом, так как известен целый ряд соответствующих ему генетических дефектов. В то же время вторичный ГЛГ может иметь сходные клинические проявления, но диагностироваться только по совокупности перечисленных и некоторых других клинических и лабораторных признаков.
Лечение
При ГЛГ огромную роль играют своевременная диагностика и начало лечения, так как состояние больного может ухудшаться очень быстро.
В лечении ГЛГ используется химиотерапия. Так, протокол HLH-2004 предполагает использование дексаметазона, этопозида, циклоспорина, а также применение метотрексата в случае поражения ЦНС. Сопроводительная терапия обязательно включает в себя профилактику инфекций. При необходимости производятся переливания компонентов крови.
При врожденном ГЛГ после химиотерапии, позволяющей стабилизировать состояние пациента, необходима аллогенная трансплантация костного мозга. Без трансплантации невозможно достичь продолжительной ремиссии. Трансплантация может также понадобиться в некоторых случаях вторичного (приобретенного) ГЛГ, хотя в международной медицинской практике вопрос о лечении таких больных не решен однозначно.
Прогноз
Первичный ГЛГ без лечения приводит к смертельному исходу. Непосредственной причиной смерти может быть, например, полиорганная недостаточность, сепсис или грибковая инфекция. Даже при условии применения химиотерапии ремиссия обычно непродолжительна и долговременная выживаемость низка. Основную надежду на излечение дает аллогенная трансплантация костного мозга, несмотря на тяжесть этой процедуры и связанные с ней опасные осложнения. Так, в одном из зарубежных исследований пятилетняя выживаемость пациентов после трансплантации достигала 66%, тогда как без трансплантации составляла лишь 10%. В случае успешной трансплантации пациенты могут в дальнейшем иметь нормальные качество и продолжительность жизни.
При вторичном ГЛГ прогноз сильно варьирует в зависимости от конкретного случая заболевания: зафиксированы как случаи с крайне тяжелым течением, плохо поддающиеся терапии, так и случаи самопроизвольного улучшения.
Источник
