Гемофагоцитарный синдром у детей фото
Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Редкое и сложно определяемое заболевание – гемофагоцитарный синдром, по-другому называют гемофагоцитарным лимфогистиоцитозом. Эта тяжелая болезнь связана с возникновением недостаточности многих органов в результате бесконтрольной активизации эффекторной составляющей клеточной иммунной защиты.
При гемофагоцитарном синдроме наблюдается сильный рост функциональности токсических Т-лимфоцитов и макрофагов, что ведет к выработке многочисленных антивоспалительных цитокинов. В свою очередь, этот процесс влечет за собой интенсивную системную воспалительную реакцию и масштабное нарушение функции многих органов.
 [1], [2], [3], [4]
[1], [2], [3], [4]
Код по МКБ-10
D76.2 Гемофагоцитарный синдром, связанный с инфекцией
Причины гемофагоцитарного синдрома
Гемофагоцитарный синдром чаще бывает первичным – то есть, наследственного типа в результате генетического нарушения в работе макрофагов.
Вторичный гемофагоцитарный синдром ещё называют приобретенным: он связан с различными инфекционными патологиями, опухолевыми процессами, аутоиммунными заболеваниями, врожденными нарушениями метаболизма.
При классическом варианте наследственного типа гемофагоцитарного синдрома детей часто помещают для лечения в реанимационное отделение или ОИТ при инфекционных больницах, диагностируя септические осложнения или внутриутробную генерализованную инфекцию. Непосредственно диагноз гемофагоцитарного синдрома зачастую устанавливают уже после летального исхода.
Однако и обычные на первый взгляд инфекционные заболевания вирусного или микробного происхождения способны вызвать такое осложнение, как опасный для жизни гемофагоцитарный синдром.
Гемофагоцитарный синдром у взрослых практически во всех случаях бывает вторичным: чаще всего патология развивается на фоне лимфопролиферативных заболеваний и хронических ВЭБ-инфекций.
Гемофагоцитарный синдром у детей может быть, как первичным, так и вторичным – вследствие перенесенных инфекционных заболеваний (ветряной оспы, менингоэнцефалита и пр.).
 [5], [6], [7], [8], [9]
[5], [6], [7], [8], [9]
Симптомы гемофагоцитарного синдрома
Признаки синдрома впервые поддались описанию в середине прошлого века. Были выделены такие характерные симптомы:
- стабильное лихорадящее состояние;
- уменьшение уровня кроветворных веществ;
- увеличение размеров печени и селезенки;
- выразительный геморрагический синдром.
У пациентов можно наблюдать явления печеночной недостаточности, высокое содержание ферритина и трансаминазина, четкую неврологическую картину с расстройством функциональности ЦНС, высокий уровень триглицеридов в сыворотке, ускоренное свертывание крови и коагулопатией.
Зачастую у заболевших обнаруживают увеличенные лимфоузлы, кожную сыпь, пожелтение склер, кожных и слизистых покровов, а также отечность.
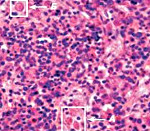
Паренхима селезенки, синусоидные печеночные капилляры, синусы лимфоузлов, костный мозг и центральная нервная система отличаются диффузной инфильтрацией активными макрофагами на фоне гемофагоцитарной симптоматики. Происходит истощение лимфоидной ткани. При исследовании печени наблюдаются поражения, типичные для хронической формы персистирующего воспаления.
 [10], [11], [12], [13]
[10], [11], [12], [13]
Формы
Различают две клинические формы, которые на первых порах достаточно сложно дифференцировать.
- Первичный гемофагоцитарный лимфогистиоцитоз, который является аутосомно-рециссивной патологией, при развитии которой основное значение имеет мутирование гена перфорина.
- Вторичная форма гемофагоцитарного лимфогистиоцитоза, которая развивается вследствие избыточной иммунной активности цепи мононуклеарных фагоцитов.
 [14], [15]
[14], [15]
Осложнения и последствия
- Присоединение инфекции с последующей интоксикацией. Такое осложнение характеризуется постепенной потерей функции основных органов и систем, лихорадкой, истощением больного.
- Злокачественное перерождение клеток. Обычно малигнизация представляет собой развитие лимфомы, лейкемии и прочих злокачественных заболеваний.
- Аутоиммунные патологии – своеобразная агрессивная реакция собственной иммунной защиты больного.
- Стойкое понижение иммунитета с развитием иммунодефицитного состояния.
- Недостаточность функции почек и печени.
- Внутренние кровотечения, геморрагии.
- Гибель больного от тотальной дисфункции органов или от септических осложнений.
 [16], [17], [18], [19]
[16], [17], [18], [19]
Диагностика гемофагоцитарного синдрома
Если семейный анамнез не отягощен, то определить первичность или вторичность гемофагоцитарного синдрома очень сложно. Для того чтобы поставить точный диагноз, необходимо провести гистологическую дифференциацию гемофагоцитоза.
Многие болезни трудно определить, используя только лишь информацию, полученную при биопсии тканей: лимфоузлов, печени и костного мозга.
Проведение иммунологических исследований, которые позволяют увидеть угнетенную функцию NK-клеточных структур и повышение содержания рецептора интерлейкин-2, не может служить основанием для постановки диагноза. Дополнительно учитываются особенности клинической картины, повреждение и нарушение функции центральной нервной системы и изменения в составе крови больного.
Окончательной точкой в постановке диагноза служат данные молекулярного генетического анализа.
 [20], [21]
[20], [21]
Дифференциальная диагностика
Дифференцировать заболевание крайне сложно, при этом подход должен быть определен в зависимости от возраста больного. В педиатрии важно как можно раньше обнаруживать генетические формы гемофагоцитарного синдрома, анализируя все возможные факторы, которые могут указывать на наследственную разновидность патологии.
Так, стремительное развитие синдрома в течение первых 12 месяцев жизни при неотягощенном семейном анамнезе типично для первичной формы гемофагоцитарного синдрома. Обнаруженная экспрессия перфорина на NK-клеточных структурах при помощи метода проточной цитофлюорометрии и молекулярного генетического исследования перфорина помогает установить правильный диагноз примерно в 30% случаев наследственного гемофагоцитарного синдрома. Одновременное появление болезни на фоне альбинизма обнаруживается при таких синдромах:
- синдром Чедиака-Хигаси;
- синдром Гриссели.
Если наследование обладает Х-сцепленным типом, то есть, когда болезнь развивается у родственных мужчин по линии матери, то наиболее вероятным считается наличие аутоиммунного лимфопролиферативного синдрома.
При вторичном гемофагоцитарном синдроме главное – своевременно обнаружить злокачественные опухоли, которые чаще всего являются причинами синдрома во взрослом возрасте.
Лечение гемофагоцитарного синдрома
Лечение при гемофагоцитарном синдроме достаточно сложное: успех такого лечения во многом зависит от возраста больного и от того, насколько своевременно было обнаружено заболевание.
Терапевтические схемы при гемофагоцитарном синдроме подразумевают применение глюкокортикостероидных препаратов (Дексаметазон), цитостатиков (Этопозид, Циклоспорин А). Цитостатики назначают для угнетения провоспалительного действия фагоцитов с дальнейшей алогенной пересадкой стволовых клеток.
Единая схема лечения, используемая при гемофагоцитарном синдроме, до сих пор не определена. Этиотропное лечение считается недостаточным для борьбы с синромом, а применение иммуносупрессоров может негативно повлиять на течение вирусно-бактериального процесса.
Рекомендованы инъекции высоких доз иммуноглобулина, исходя из количества 1-2 мг на килограмм веса пациента в сутки.
Плазмофорез может быть назначен в составе патогенетического лечения для наблюдения за гиперцитокинемией.
Основой лечения считается спленэктомия и пересадка донорского костного мозга.
Профилактика
Специалисты на данный момент не располагают четкой информацией о методах профилактики первичного гемофагоцитарного синдрома, так как не полностью изучены причины развития данной патологии.
Что касается вторичного гемофагоцитарного синдрома, то профилактические мероприятия могут заключаться в следующем:
- грамотное и своевременное лечение вирусных и микробных инфекций;
- квалифицированное лечение аутоиммунных патологий под наблюдением медицинского специалиста ревматологического профиля.
 [22], [23], [24], [25], [26], [27], [28], [29]
[22], [23], [24], [25], [26], [27], [28], [29]
Прогноз
Прогноз гемофагоцитарного синдрома считается крайне неблагоприятным, что можно увидеть из статистической информации: шесть смертельных случаев среди семи заболевших. Максимальная длительность выживания на данный момент – два года.
Гемофагоцитарный синдром считается очень сложным и коварным заболеванием, которое на сегодняшний день «конкурирует» разве что с инфекцией вируса иммунодефицита, а по частоте последствий даже превосходит ВИЧ.
 [30], [31]
[30], [31]
Источник
Суть болезни
Гемофагоцитарный лимфогистиоцитоз (ГЛГ) – редкое и тяжелое гематологическое заболевание. Оно характеризуется аномальным размножением и активацией особых клеток организма – гистиоцитов (тканевых макрофагов).
Термин «лимфогистиоцитоз» означает, что в развитии болезни, кроме гистиоцитов, участвуют также и неправильно функционирующие лимфоциты. В свою очередь, термин «гемофагоцитарный» означает, что при этой болезни макрофаги поглощают клетки крови (эритроциты, лейкоциты, тромбоциты) и их клетки-предшественники в различных органах и тканях. Этот процесс и называтся гемофагоцитозом.
В результате аномальной активности лимфоцитов и макрофагов возникают тяжелые поражения органов, включая печень, селезенку, лимфатические узлы, кожу, легкие, головной мозг и т.п. Одновременно гемофагоцитоз приводит к цитопении – состоянию дефицита клеток крови.
ГЛГ не является злокачественным заболеванием; в настоящее время считается, что его причина – нарушение регуляции клеточного иммунитета.
Частота встречаемости, факторы риска
ГЛГ – редкое заболевание. По зарубежным данным, частота его врожденной формы – около 1 случая на 50 000 новорожденных.
Различают первичный (семейный, врожденный) и вторичный (приобретенный) ГЛГ. Нарушения при первичном варианте болезни обусловлены наследственными факторами и чаще всего проявляются в очень раннем возрасте, обычно до 12-18 месяцев. Наследование первичного ГЛГ – аутосомно-рецессивное, то есть больной ребенок может родиться (с вероятностью 25%) только тогда, когда оба родителя являются носителями «дефектных» генов. Поэтому ГЛГ чаще встречается при близкородственных браках. Известно несколько разновидностей болезни, которым соответствуют разные генетические дефекты. Мальчики и девочки болеют с одинаковой частотой, зависимости от этнического происхождения также не выявлено. Семьям, где уже были случаи ГЛГ у детей, рекомендована консультация генетика. Возможна пренатальная (то есть до рождения ребенка) ДНК-диагностика.
Вторичный ГЛГ может возникнуть при аномальной активации клеток в результате некоторых инфекций (например, инфицирования вирусом Эпштейна-Барр), злокачественных опухолей, аутоиммунных заболеваний и иммунодефицитных состояний. Эта форма обычно наблюдается в более позднем возрасте, чем первичный ГЛГ.
Признаки и симптомы
Для ГЛГ характерно упорное повышение температуры, причем лихорадка не поддается лечению антибактериальными препаратами. Наблюдается увеличение селезенки (спленомегалия), обычно также увеличение печени (гепатомегалия). Более чем в половине случаев возникает кожная сыпь, поражающая также и волосистую часть головы. Часто встречается увеличение лимфоузлов – лимфаденопатия. Нередки признаки поражения центральной нервной системы (ЦНС): изменения поведения, нарушения координации движений, судороги. Другие возможные симптомы – желтуха, отеки, признаки поражения желудочно-кишечного тракта (боли в животе, рвота, понос, отказ от пищи, потеря веса).
Кроме того, при ГЛГ возникают клинические проявления цитопении, то есть состояния дефицита клеток крови: недостаток эритроцитов проявляется бледностью и слабостью, недостаток тромбоцитов – синяками и кровотечениями (возможны, например, кровотечения из десен), недостаток лейкоцитов – частыми инфекциями.
Диагностика
При выявлении указанных клинических признаков производятся лабораторные исследования с целью подтвердить или исключить диагноз ГЛГ. В общем анализе крови наблюдается цитопения: анемия, тромбоцитопения и/или нейтропения. Присутствуют также характерные изменения в биохимическом анализе крови. Гистологические исследования указывают на накопление лимфоцитов и макрофагов в различных органах, включая селезенку, лимфоузлы, костный мозг, печень и ЦНС. В образцах тканей, взятых посредством биопсии, наблюдается явление гемофагоцитоза (см. выше), но не всегда выявленные изменения бывает легко оценить.
Используются иммунологические тесты, позволяющие обнаружить именно те иммунные нарушения, которые обычно приводят к развитию ГЛГ (снижение активности NK-лимфоцитов.
Диагноз первичного ГЛГ подтверждается молекулярно-генетическим анализом, так как известен целый ряд соответствующих ему генетических дефектов. В то же время вторичный ГЛГ может иметь сходные клинические проявления, но диагностироваться только по совокупности перечисленных и некоторых других клинических и лабораторных признаков.
Лечение
При ГЛГ огромную роль играют своевременная диагностика и начало лечения, так как состояние больного может ухудшаться очень быстро.
В лечении ГЛГ используется химиотерапия. Так, протокол HLH-2004 предполагает использование дексаметазона, этопозида, циклоспорина, а также применение метотрексата в случае поражения ЦНС. Сопроводительная терапия обязательно включает в себя профилактику инфекций. При необходимости производятся переливания компонентов крови.
При врожденном ГЛГ после химиотерапии, позволяющей стабилизировать состояние пациента, необходима аллогенная трансплантация костного мозга. Без трансплантации невозможно достичь продолжительной ремиссии. Трансплантация может также понадобиться в некоторых случаях вторичного (приобретенного) ГЛГ, хотя в международной медицинской практике вопрос о лечении таких больных не решен однозначно.
Прогноз
Первичный ГЛГ без лечения приводит к смертельному исходу. Непосредственной причиной смерти может быть, например, полиорганная недостаточность, сепсис или грибковая инфекция. Даже при условии применения химиотерапии ремиссия обычно непродолжительна и долговременная выживаемость низка. Основную надежду на излечение дает аллогенная трансплантация костного мозга, несмотря на тяжесть этой процедуры и связанные с ней опасные осложнения. Так, в одном из зарубежных исследований пятилетняя выживаемость пациентов после трансплантации достигала 66%, тогда как без трансплантации составляла лишь 10%. В случае успешной трансплантации пациенты могут в дальнейшем иметь нормальные качество и продолжительность жизни.
При вторичном ГЛГ прогноз сильно варьирует в зависимости от конкретного случая заболевания: зафиксированы как случаи с крайне тяжелым течением, плохо поддающиеся терапии, так и случаи самопроизвольного улучшения.
Источник

Гемофагоцитарный лимфогистиоцитоз – группа врожденных и приобретенных заболеваний, возникающих вследствие нарушений регуляции иммунного ответа и характеризующихся гиперпродукцией гистиоцитов, а также цитотоксических T-лимфоцитов. Клиническая симптоматика проявляется фебрильной лихорадкой, увеличением печени и селезенки, периферических лимфатических узлов, поражением нервной системы, костного мозга и других органов. Диагностика основана на данных клинического, лабораторного (цитопения, коагулопатия, билирубинемия и др.) и инструментального обследования. Лечение: иммуносупрессивная терапия, кортикостероиды, воздействие на причинные факторы.
Общие сведения
Гемофагоцитарный лимфогистиоцитоз (гемофагоцитарный синдром) – врожденное или приобретенное нарушение регуляции иммунного ответа, при котором происходит аномальная активация цитотоксических T-лимфоцитов, моноцитов и макрофагов с аккумуляцией в органах-мишенях и развитием в них выраженного патологического процесса (воспаления, повреждения тканей, фагоцитоза форменных элементов крови). При врожденной, генетически детерминированной форме заболевания болеют преимущественно дети раннего возраста и в 60-80% случаев – на первом году жизни.
Вторичный (приобретенный) гемофагоцитарный лимфогистиоцитоз встречается во всех возрастных категориях, развивается на фоне затяжного течения различных инфекционных заболеваний, аутоиммунных процессов и новообразований. Впервые признаки гемофагоцитарного синдрома были описаны еще в 1939 году, а заболевание тогда было названо гистиоцитарным медуллярным ретикулезом. Семейная наследственная форма лимфогистиоцитоза была впервые описана в 1959 году. Распространенность заболевания колеблется от 1 случая на 50 тысяч новорожденных до 1-2 случаев на 1 миллион детей в возрасте до 15 лет.
Гемофагоцитарный лимфогистиоцитоз
Причины гемофагоцитарного лимфогистиоцитоза
Врожденный гемофагоцитарный лимфогистиоцитоз возникает вследствие генетического дефекта механизмов клеточной цитотоксичности из-за мутаций гена перфорина. В норме регуляция иммунного ответа обеспечивается своевременным ограничением активности эффекторов иммунной системы в процессе ликвидации угрозы для организма со стороны проникших инфекционных агентов и других негативных воздействий. В этой регуляции важную роль играют механизмы клеточной цитотоксичности.
При первичном гемофагоцитарном лимфогистиоцитозе регулятивная роль цитотоксических гранул клеток и цитотоксических T-лимфоцитов в отношении клеток-мишеней нарушается, происходит чрезмерная активация иммунных клеток, в избытке продуцируются провоспалительные цитокины (интерфероны, фактор некроза опухоли и др.). Активированные вследствие «цитокинового шторма» T-лимфоциты и макрофаги инфильтрируют, а затем повреждают органы и ткани. Важным фактором патогенеза заболевания является развитие патологического гемофагоцитоза зрелых форменных элементов крови. Такой фагоцитоз происходит и в норме, помогая организму избавиться от старых клеток. В данном же случае макрофаги начинают фагоцитировать полноценные, нормально функционирующие форменные элементы крови, приводя к выраженной цитопении, коагулопатии и другим проявлениям заболевания.
Приобретенный (вторичный) гемофагоцитарный лимфогистиоцитоз развивается на фоне некоторых инфекционных заболеваний, опухолей, аутоиммунных процессов, при трансплантации органов и тканей, причем характерные нарушения регуляции иммунного ответа могут быть как следствием основного заболевания, так и осложнением, связанным с проведением иммуносупрессивной терапии и возникновением вторичной инфекции.
Симптомы гемофагоцитарного лимфогистиоцитоза
Клинические проявления гемофагоцитарного лимфогистиоцитоза чрезвычайно вариабельны. Наиболее часто наблюдается длительная лихорадка, рефрактерная к проводимой антибактериальной и противовирусной терапии. Озноб, признаки общей интоксикации (слабость, потливость, нарушения сна, отказ от приема пищи, тошнота и рвота, боли в мышцах) продолжаются в течение длительного времени, приобретая волнообразное течение с периодическими временными улучшениями самочувствия.
Характерным проявлением заболевания является увеличение печени и селезенки, имеющее прогрессирующий характер. К ранним симптомам первичного гемофагоцитарного лимфогистиоцитоза относится появление кожной сыпи, увеличение периферических лимфатических узлов, а также развитие неврологических расстройств в виде повышенной возбудимости, двигательных нарушений и расстройств чувствительности, судорожного синдрома, признаков повышения внутричерепного давления у детей раннего возраста. Встречаются при гемофагоцитарном лимфогистиоцитозе и симптомы, свидетельствующие о наличии анемии, коагулопатии – бледность и желтушность кожных покровов, периферические отеки, признаки кровотечения из пищеварительного тракта (черный кал, примесь крови в каловых массах и др.).
При вторичном гемофагоцитарном синдроме сочетаются клинические признаки поражения иммунной системы и проявления основного заболевания (вирусной инфекции, злокачественного новообразования, аутоиммунного заболевания).
Диагностика гемофагоцитарного лимфогистиоцитоза
Диагноз устанавливается в результате тщательного изучения анамнеза, клинической картины заболевания, результатов лабораторных и инструментальных исследований. Необходимы осмотры врача-гематолога, аллерголога-иммунолога, онколога, инфекциониста, ревматолога и других специалистов. Разработаны международные диагностические критерии гемофагоцитарного лимфогистиоцитоза, к которым относятся:
- лихорадка с повышением температуры выше 38,5 градусов, продолжающаяся более недели;
- увеличение печени и селезенки;
- цитопения с уменьшением гемоглобина ниже 90 г/л, тромбоцитов – меньше 100000 клеток/мкл, нейтрофилов – меньше 1000/мкл;
- признаки коагулопатии;
- увеличение ферритина больше 500 нг/мл;
- повышение уровня растворимого sCD25 в крови;
- низкое или полное отсутствие активности NK-клеток.
Наличие хотя бы пяти из этих признаков свидетельствует о гемофагоцитарном лимфогистиоцитозе. Для установления наследственной формы заболевания необходимо генетическое исследование, в результате которого обнаруживаются мутации генов PRF1, UNC13D, Munc18-2, STX11.
Приобретенные формы гемофагоцитарного синдрома диагностируются на основании вышеописанных международных критериев и проведения уточненной диагностики основного заболевания, для чего зачастую необходимо выполнять сложные лабораторные и инструментальные исследования (эндоскопические, УЗИ, КТ, МРТ, ПЭТ).
Дифференциальный диагноз гемофагоцитарного лимфогистиоцитоза проводится с:
- различными врожденными и приобретенными иммунными заболеваниями,
- болезнями крови,
- острыми и хроническими вирусными инфекциями,
- злокачественными новообразованиями (острым лимфобластным лейкозом, неходжкинскими лимфомами, другими злокачественными опухолями после проведенной химиотерапии),
- системными заболеваниями соединительной ткани: системной красной волчанкой, ювенильным дерматомиозитом, узелковым периартериитом, ювенильным ревматоидным артритом.
Лечение гемофагоцитарного лимфогистиоцитоза
Современная тактика лечения наследственной формы гемофагоцитарного лимфогистиоцитоза включает проведение химиотерапии с использованием иммуносупрессивных средств (дексаметазона, этопозида, циклоспорина A), а также трансплантации стволовых клеток. Прогноз заболевания значительно улучшается при своевременном проведении трансплантации от гистосовместимого родственного донора.
При вирусных, бактериальных и паразитарных инфекциях, вызвавших появление гемофагоцитарного синдрома, проводится этиотропная антимикробная терапия, инфузии высокодозного иммуноглобулина, а также иммуносупрессивная терапия с введением циклоспорина A и кортикостероидов. Иногда показано проведение трансплантации костного мозга. При опухолях, наряду с лечением основного заболевания, в терапевтическую схему включаются иммуносупрессивные средства в индивидуально подобранных дозах. При аутоиммунных процессах лечение включает сочетание иммуноглобулина, пульс-терапии с использованием кортикостероидов, а также циклоспорина A.
Источник
