Физическая активность при метаболическом синдроме

Рассмотрено влияние физической нагрузки на обменные процессы у пациентов с метаболическим синдромом. Показано, что регулярная физическая активность должна быть неотъемлемым компонентом профилактики и лечения метаболического синдрома.

Снижение физической активности как причина метаболических изменений
Физическая активность является неотъемлемым компонентом поддержания метаболического здоровья. Положительное влияние регулярных физических упражнений заключается в целом комплексе процессов, отражающихся на обмене веществ, в т. ч. гомеостазе липидов и углеводов, а также поддержании мышечной массы. Условия жизни человека, особенно в больших городах, иногда особенности профессиональной деятельности таковы, что время, которое человек проводит физически активно, уменьшается, и, наоборот, увеличивается время, проведенное за компьютером в офисе или дома, либо перед телевизором. Получены доказательства того, что сидячий образ жизни ведет к увеличению распространенности в популяции ожирения, а также считается фактором риска развития различных хронических заболеваний, в т. ч. метаболических нарушений [1]. Так, в исследовании NIH-AARP Diet and Health Study [2], в котором приняли участие 240 819 человек в возрасте 50–71 год, оценивалось влияние общего времени, проведенного сидя, и физической нагрузки умеренной интенсивности на смертность. Было показано, что время, проведенное за телевизором (≥7 ч по сравнению с <1 ч/день), ассоциировано с большим риском смерти от всех причин (HR: 1,61; 95% ДИ: 1,47–1,76), сердечно-сосудистой смертностью (HR: 1,85; 95% ДИ: 1,56– 2,20) и раком (HR: 1,22; 95% ДИ: 1,06–1,40). При этом даже включение в распорядок дня физической активности умеренной интенсивности (>7 ч/нед.) не давало преимуществ в отношении риска смерти от всех причин (HR: 1,47; 95% ДИ: 1,20–1,79) и сердечно-сосудистой смертности (HR: 2,00; 95% ДИ: 1,33–3,00) по сравнению с теми, кто проводил <1 ч/день за просмотром телепередач. Возможно, увеличение рисков смертности во время длительного нахождения в положении сидя связано с тем, что уменьшение сокращений скелетных мышц может приводить к снижению активности липопротеинлипазы – фермента, гидролизующего жиры липопротеинов, и к уменьшению клиренса триглицеридов, что приводит к развитию центрального ожирения, повышению уровня триглицеридов. Отмечено, что сокращение времени, проведенного в положении сидя, в большей степени усиливает активность липопротеинлипазы, чем включение в распорядок дня тренировок без сокращения времени сидя [3]. Влияние на углеводный обмен может осуществляться через снижение стимулированной секреции инсулина, развитием инсулинорезистентности вследствие снижения содержания GLUT-4, который является переносчиком глюкозы в мышцах.
В исследовании, проведенном в Австралии с участием 222 497 человек (621 695 человеко-лет), изучалась взаимосвязь времени, проведенного сидя, и смертности от всех причин. Было показано, что риск смертности от всех причин увеличивался пропорционально времени, проведенному в положении сидя (от 4 до 8 ч, от 8 до 11 ч, более 11 ч), в сравнении с теми, кто проводил в сидячем положении менее 4 ч: 1,02 (95% ДИ: 0,95–1,09), 1,15 (1,06–1,25) и 1,40 (1,27–1,55) соответственно [4].
Физические упражнения способствуют улучшению обмена веществ, кардиопротекции, снижению инсулинорезистентности, а также ведут к улучшению окислительной способности и общего состояния здоровья [5, 6]. Недостаток физической активности с возрастом может провоцировать быстрое снижение мышечной массы и развитие саркопении (снижение силы, функциональной способности и объема мышц), а саркопения является независимым фактором риска неблагоприятных исходов, таких как инвалидность, ухудшение качества жизни и смертность [7, 8]. Комбинируя различные виды физической активности, можно не только снизить избыточный вес, но и замедлить потерю мышечной массы, возникающую как с увеличением возраста, так и вследствие различных заболеваний.
Регулярные физические упражнения способствуют улучшению физической формы, которая включает в себя подготовленность сердечно-сосудистой и дыхательной системы – так называемый кардиореспираторный резерв; а также силу, выносливость, мощность, чувство равновесия, координацию движений, реакцию, быстроту. По данным D.C. Lee et al. отмечено, что низкий кардиореспираторный резерв по сравнению с высоким резервом ассоциирован с увеличением риска смерти (рис. 1) [9].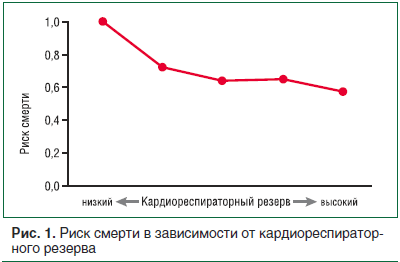
Важным показателем состояния физической формы является соотношение жировой и мышечной массы. При выборе вида физической активности следует учитывать состояние физической формы по всем параметрам для ее гармоничного улучшения.
Влияние физической активности на митохондриальную функцию
Одним из важных факторов, участвующих в поддержании энергетического гомеостаза, является функционирование митохондрий. Дисфункция митохондрий приводит к нарушению производства активных форм кислорода, запускает катаболические сигнальные пути, способствующие активации процессов атрофии мышц. Механизмом, посредством которого физические упражнения оказывают благотворное влияние на метаболизм мышц и всего организма, возможно, является участие в регуляции катаболических и анаболических процессов в зависимости от энергетических потребностей, а также улучшение митохондриальной функции посредством активации митохондриального биогенеза и ремоделирования, увеличения плотности митохондрий и их жизнеспособности.
Виды физической активности
К понятию «физическая активность», с одной стороны, относится любое движение, производимое скелетной мускулатурой, в результате которого затрачивается энергия. С другой стороны – это физические упражнения и тренировка, улучшающие состояние кардиореспираторной системы, направленные на повышение прочности, силы, массы скелетных мышц, а также функциональных возможностей организма, т. е. способствующие улучшению физической формы [10].
Среди основных типов физических нагрузок принято выделять аэробные и анаэробные нагрузки. Аэробный механизм осуществляется вследствие образования аденозинтрифосфата (АТФ) в митохондриях скелетных мышц путем окислительного фосфорилирования. Субстратом для этого пути являются глюкоза, жирные кислоты, белок. На 1 молекулу глюкозы образуются 38 молекул АТФ. Ресинтез АТФ в этом случае осуществляется при участии поступающего в организм кислорода.
Глюкоза + О2 + АДФ = АТФ + Н2О + СО2
Жир + О2 + АДФ = АТФ + Н2О + CО2
Белок + О2 + АДФ = АТФ + Н2О + CО2 + мочевина
Образующаяся энергия полностью покрывает энерготраты во время физических нагрузок, и при достаточном количестве кислорода они могут выполняться в течение длительного времени.
К аэробным физическим нагрузкам относятся плавание, бег, танцы, езда на велосипеде, активные игры. Это динамические нагрузки низкой или средней интенсивности, имеющие повторяющийся характер. Используя аэробную нагрузку, можно добиться уменьшения объема висцерального жира вследствие увеличения липолиза, преимущественно в абдоминальной области, увеличения суточной секреции гормона роста, который стимулирует жировую ткань через чувствительную к гормону липазу, а также опосредованно повышает чувствительность к инсулину. Так как висцеральная жировая ткань больше коррелирует с уровнем триглицеридов, артериальным давлением и инсулинорезистентностью по сравнению с общим содержанием жира [11], то выполнение аэробных упражнений может способствовать снижению риска метаболических нарушений.
Анаэробный путь осуществляется без участия кислорода, и субстратом для него являются АТФ, креатинфосфат, гликоген или глюкоза. Ресинтез АТФ в этом случае может осуществляться различными путями. Возможными вариантами восполнения запасов АТФ являются:
Креатинфосфокиназный механизм:
Креатинфосфат + АДФ → креатин + АТФ
Гликолитический механизм:
Глюкоза + АДФ = АТФ + лактат
Миокиназный механизм (резервный):
2АДФ = АТФ + АМФ
Анаэробные нагрузки характеризуются высокой интенсивностью и кратковременностью. Во время анаэробной физической работы уменьшается доставка кислорода к мышцам, а ресинтез АТФ осуществляется с помощью анаэробных механизмов. На 1 молекулу глюкозы образуются 2 молекулы АТФ. Посредством включения в тренировку анаэробных нагрузок, таких как бег на короткие дистанции, поднятие тяжестей, можно способствовать увеличению объема мышечной массы и силы, а также уменьшить проявление саркопении.
Анаэробные физические нагрузки могут способствовать отрицательному энергетическому балансу и вести к изменению распределения жира в организме. Так как анаэробные нагрузки влияют на увеличение мышечной массы, это, в свою очередь, может способствовать улучшению метаболического контроля и увеличению скорости метаболизма в покое.
В целом только небольшое число различных вариантов физической нагрузки можно отнести к какому-то определенному типу, т. е. только к аэробному или только к анаэробному. Большинство видов физической активности, как правило, включают и аэробный, и анаэробный механизмы, и можно говорить лишь о преобладании одного из компонентов. При этом комбинация аэробных и анаэробных упражнений приводит к более выраженному снижению массы тела за счет потери жировой ткани при сохранении мышечной массы по сравнению с изолированной аэробной или анаэробной активностью.
Оценка уровня физической активности
Уровень физической активности можно оценить посредством ее интенсивности, которая может быть как абсолютной, так и относительной [10].
Абсолютная интенсивность для аэробной нагрузки – это необходимый для осуществления этой нагрузки расход энергии, который можно измерить в метаболических эквивалентах (МЕТ – Metabolic Equivalent Task). Один MET – это расход энергии человека, находящегося в покое, в условиях основного обмена, который сопровождается поглощением кислорода около 3,5 мл в минуту на 1 кг массы тела ((млО2/кг/мин) х3,5). Число МЕТ во время нагрузки показывает, во сколько раз возрастает потребление кислорода относительно его уровня в покое. Преимущество использования МЕТ заключается в том, что этот показатель не зависит от массы тела. В настоящее время принято выделять 4 категории абсолютной интенсивности: положение сидя – ≤1,5 МЕТ, легкая интенсивность – 1,6–2,9 МЕТ, умеренная интенсивность – 3,0–5,9 МЕТ и значительная интенсивность – ≥6,0 МЕТ [12]. Таким образом, умеренно активный человек сжигает в 3–6 раз больше калорий, а высокоактивный человек – более чем в 6 раз больше по сравнению с человеком в состоянии покоя. При этом увеличение абсолютной интенсивности (большее значение МЕТ) коррелирует со значительным снижением относительного риска смерти (рис. 2) [13].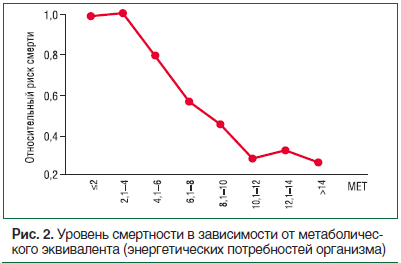
Относительная интенсивность характеризует усилия, с которыми выполняется та или иная нагрузка. Относительную интенсивность аэробной нагрузки можно выразить как процент аэробной мощности (VO2max) или процент максимальной частоты сердечных сокращений. Она также может быть охарактеризована индивидуальным восприятием физической нагрузки как очень легкой, легкой, средней, тяжелой, очень тяжелой или максимальной [10].
VO2max, или максимальный уровень потребления кислорода, обозначает предельную способность человеческого организма вырабатывать энергию посредством аэробного пути во время выполнения физических упражнений высокой интенсивности. Большее значение VO2max свидетельствует о большей выносливости и физической работоспособности и зависит от производительности сердца и артериовенозной разницы насыщения крови кислородом.
VO2max = Q (A – B),
где VO2max – максимальный уровень потребления кислорода, л/мин, Q – минутный объем крови, л/мин, (А–В) – артериовенозная разница насыщения крови кислородом, мл О2/ 100 мл крови.
Максимальная частота сердечных сокращений (ЧСС) рассчитывается по формуле:
ЧСС max = 220 – возраст (в годах)
Для оценки интенсивности физической нагрузки можно использовать показатель порога анаэробного обмена (ПАНО), или лактатный порог, – это уровень интенсивности нагрузки, при котором концентрация лактата в крови начинает резко повышаться, т. к. скорость его образования превышает скорость утилизации [14]. ПАНО характеризует соотношение аэробных и анаэробных механизмов энергообеспечения, ему соответствует 85% от максимальной ЧСС или 75% от максимального потребления кислорода [15].
Определить ПАНО возможно, используя прямые и непрямые методы. К прямым методам относят определение лактата в крови на разных этапах нагрузки с построением лактатной кривой. В лактатной кривой выделяют два выраженных подъема. Первый – так называемый аэробный порог характеризуется повышением уровня лактата на 0,5–1 ммоль/л от исходного. Второй – лактатный порог определяется увеличением содержания лактата >4 ммоль/л, он и характеризует величину ПАНО. Кроме того, прямым методом определения ПАНО является расчет дыхательного коэффициента, т. е. изменения содержания газов (кислорода и углекислого газа) в выдыхаемом воздухе. Анаэробным порогом является увеличение дыхательного коэффициента >1.
К непрямым методам относят тест Конкони, основанный на зависимости между ЧСС и скоростью передвижения. Во время теста выполняется непрерывный бег общей продолжительностью 10–12 мин на дистанцию 2400–3200 м с постепенным увеличением скорости через каждые 200 м, так, чтобы каждый последующий 200-метровый отрезок преодолевался на 2 с быстрее предыдущего. По окончании каждого 200-метрового отрезка фиксируются ЧСС и время. Тест продолжается до тех пор, пока скорость больше не может быть увеличена, а частота пульса возрастает до 180—200 ударов в минуту. Полученные данные сводятся в таблицу, строится график зависимости ЧСС (ось Y) от скорости передвижения (ось X). Точка перегиба на графике соответствует анаэробному порогу (рис. 3) [16].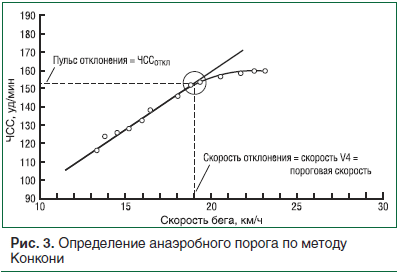
Рекомендации по физической активности для пациентов с метаболическим синдромом
Согласно имеющимся руководствам по физической активности при метаболических нарушениях, их основными принципами являются регулярность и умеренная интенсивность. Рекомендуется как минимум 30-минутная физическая активность средней интенсивности в день. Однако предпочтение отдается 60-минутной ходьбе средней интенсивности в сочетании с другими видами деятельности [17]. Необходимо включать 10–15-минутные периоды физической активности с использованием простого тренажерного оборудования либо без него, а также избегать положения сидя в свободное время [18]. 30-минутная физическая активность, достигнутая в течение 3-х 10-минутных сеансов, за сутки эквивалентна расходу энергии 1500 ккал в неделю. Расширение физической активности как по интенсивности, так и по продолжительности должно быть постепенным (на 5 мин/сеанс/неделю), начиная с упражнений низкой интенсивности (<3 МЕТ) [19]. Так, следует добавлять по 500 шагов с 3-дневными интервалами до целевого значения 10 000–12 000 шагов в день. Особенно важным это является для пациентов с низкой исходной степенью физической активности (<150 мин в неделю) и ведущих сидячий образ жизни [20].
Для того чтобы в результате физических упражнений повысить чувствительность к инсулину, необходимо, чтобы длительность их была не менее 30 мин в день в большинство дней недели, т. к. их положительное влияние на инсулинорезистентность проявляется в течение 24–48 ч и исчезает в течение 3–5 дней [21]. Согласно рекомендациям Всемирной организации здравоохранения, для снижения риска хронических заболеваний, включая сердечно-сосудистые заболевания, сахарный диабет 2-го типа и некоторые виды рака, необходимо по крайней мере 150 мин аэробной физической активности в течение недели [22]. Оптимальным считается сочетание анаэробных и аэробных упражнений, которое позволяет добиться более существенного снижения массы тела и жировой массы при сохранении тощей массы в сравнении с изолированными аэробными или анаэробными упражнениями [23]. Кроме того, регулярные упражнения повышают чувствительность к инсулину, снижают уровень триглицеридов, сердечно-сосудистую заболеваемость и смертность [24].
В том случае, если в течение дня человек много времени проводит в положении сидя, необходимо как можно чаще делать перерывы с активной физической нагрузкой, что может способствовать улучшению ряда метаболических показателей. Так, в исследовании с участием 168 человек, средний возраст которых составил 53,4 года, изучалось влияние перерывов (положение стоя, ходьба) при сидячем образе жизни на ряд метаболических показателей (глюкоза плазмы натощак, 2-часовая глюкоза плазмы, уровень триглицеридов, холестерина ЛПВП), а также массы тела, окружности талии и артериального давления. Было показано, что независимо от общего времени нахождения в положении сидя и времени физической активности средней и сильной интенсивности увеличение перерывов в продолжительном сидении благотворно влияло на окружность талии (β=–0,16; 95% ДИ: от –0,31 до –0,02, р=0,026), ИМТ (β= –0,19; 95% ДИ: от –0,35 до –0,02, р=0,026), триглицериды (β=–0,18; 95% ДИ: от –0,34 до –0,02, p=0,029) и 2-часовую глюкозу плазмы (β=–0,18; 95% ДИ: от –0,34 до –0,02, p=0,025), где β (95% ДИ) – стандартизированный коэффициент регрессии [25].
Перераспределение 2–2,5 ч времени в сутки, проводимого сидя, на время, проводимое стоя, у лиц с ожирением приводит к увеличению энерготрат на ~300–350 ккал или ~10–20%, что потенциально может способствовать потере веса на 15 кг в течение года [26].
Таким образом, регулярная физическая активность, включающая аэробные и анаэробные физические упражнения, должна быть неотъемлемым компонентом профилактики и лечения метаболических нарушений, в т. ч. метаболического синдрома. Необходимость расширения физической активности обусловлена имеющимися на сегодняшний день тенденциями: с одной стороны, к избыточному потреблению калорий и, соответственно, к положительному энергетическому балансу, с другой – склонностью к сидячему образу жизни [27].
Источник
Большинство авторов сходятся во мнении о существовании нескольких механизмов, обусловливающих наличие связи артериальной гипертензии и инсулинорезистентности.
Еще в 80-х годах прошлого века ученые пришли к выводу, что сочетание артериальной гипертензии с метаболическими факторами риска – это не механическое скопление, а закономерное проявление единой цепи целого ряда сложных биохимических нарушений на тканевом уровне. В 1985 г. Было высказано предположение, что гиперинсулинемия может служить связывающим звеном между артериальной гипертензией, ожирением и нарушением толерантности к глюкозе (НТГ). В ряде исследований по прямому определению инсулинорезистентности было показано, что больные с артериальной гипертензией в среднем утилизируют на 40% меньше глюкозы, чем лица с нормальным артериальным давлением.
В эпидемиологических исследованиях продемонстрировано также, что 64% больных с артериальной гипертензией имели инсулинорезистентности и только у половины пациентов она клинически манифестировала с нарушением углеводного обмена. С другой стороны, у 36% больных, имевших гиперлипопротеидемию (ГЛП) или избыточную массу тела (ИМТ), не было выявлено инсулинорезистентности. Таким образом, даже на фоне имеющегося в настоящее время огромного интереса к метаболическому синдрому было бы ошибочным связывать каждый случай эссенциальной артериальной гипертензии с проявлениями тканевой инсулинорезистентности.
Хроническая гиперинсулинемия как проявление тканевой инсулинорезистентности способствует задержке в организме натрия путем ускорения его реабсорбции, что приводит к увеличению объема жидкости и общего периферического сосудистого сопротивления. Повышение активности Na-K-, H- и Ca-Mg-АТФазы под непосредственным воздействием инсулина вызывает увеличение содержания внутриклеточного натрия и кальция, что способствует вазоконстрикции гладкой мускулатуры сосудов. При этом усиливается и чувствительность сосудов к прессорным агентам, таким как адреналин и ангиотензин.
Гиперинсулинемия также способствует активации симпатической нервной системы (СНС), в результате чего возрастает сердечный выброс и стимулируется вазоконстрикция периферических кровеносных сосудов. Симпатическая стимуляция почек запускает мощный механизм развития артериальной гипертензии – ренин-ангиотензин-альдостероновую систему. Исследования показывают, что при сочетании артериальной гипертензии с инсулинорезистентностью активность АПФ является достоверно более высокой по сравнению с больными артериальной гипертензией без проявлений инсулинорезистентности. Ангиотензин 11 – главный действующий компонент ренин-ангиотензин-альдостероновой системы – прямо и косвенно (опосредованно через активацию симпатической нервной системы) повышает давление в клубочковом аппарате, вызывает пролиферацию гладкомышечных стенок артерий, гипертрофию кардиомиоцитов и нарушает функцию эндотелия, что способствует системной артериальной и венозной вазоконстрикции.
Особую роль в ассоциации артериальной гипертензии и инсулинорезистентности играет ожирение абдоминального типа, характерное для метаболиского синдрома. В адипоцитах брыжейки и сальника идет синтез метаболически активных веществ, ингибирующих выработку эндогенного оксида азота, соответственно стимулируя вазоконстрикцию. В последние годы также активно обсуждается роль лептина в усилении активности симпатической нервной системы. Артериальная гипертензия развивается примерно у 60% больных ожирением.
В последнее десятилетие получило развитие учение о роли функции эндотелия в формировании и прогрессировании артериальной гипертензии. Показано, что в патогенезе артериальной гипертензии, связанном с метаболическими нарушениями, эндотелиальная функция является интегральным аспектом синдрома инсулинорезистентности и способствует ее углублению, увеличению реактивности сосудов и дальнейшему формированию артериальной гипертензии.
Источник
