Двухростковая цитопения код мкб
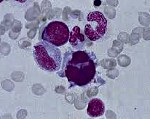
Цитостатические лекарственные средства применяются для сдерживания и уничтожения злокачественных клеток. Однако после химиотерапии такими препаратами проявляется негативный побочный эффект: ухудшение работы костного мозга и последующее уменьшение в организме кровяных частиц, называемое цитопенией. Отличие патологии выделяется из её названия (греч. cyto – клетка, penia – недостаток). Обычно наблюдается изолированная нехватка лейкоцитов и тромбоцитов, реже – эритроцитов.
Причины возникновения и развития цитопении
Проявление заболевания выражается в двух факторах: разрушение кровяных телец в сосудах, а также ухудшение синтеза новых клеток.
Не считая воздействия на организм ряда медикаментов, причинами возникновения цитопении являются:
- Анемия (в том числе постцитостатическая), вызванная нехваткой железа и витаминов группы B.
- Инфекционные заболевания (туберкулёз, сифилис, гепатит, пневмония)
- Высокая скорость кровяного цикла.
- Миелодиспластический синдром и причины его образования (негативная генетика, вредное производство, курение, радиация).
- Онкологии, вызывающие ухудшение кровяного цикла: все виды лейкоза, метастазы костного мозга, миелома, лимфосаркома.
- Депрессия, частые стрессы, проявления шизофрении и другие ухудшения работы нервной системы.
- Дифференциация стволовых клеток в костном мозге, нарушающая его деятельность.
- При увеличении селезёнки – секвестрация в ней кровяных тел.
- Наследственная нейтропения (замедление роста и снижение концентрации отдельного вида белых тел в крови).
- Уничтожение эритроцитов антителами (аутоиммунная гемолитическая анемия).
- Цитомегалия и мононуклеоз, провоцирующие проблемы с балансом гормона роста и приводящие к остановке роста клеток крови.
- Пароксизмальная ночная гемоглобинурия (в кровеносных сосудах появляются склонные к гемолизу клоны эритроцитов).
Следствие развития цитопении – характерные для неё клинические признаки:
- уменьшение синтеза клеток крови и замедление их выхода;
- ускорение цикла кровообращения;
- поглощение и перераспределение кровяных тел в сосудах.
Виды цитопении и их характеристики
Цитопения – это ощутимый для организма дефицит клеток крови в организме. Болезнь обнаруживает разновидности: названия и особенности обусловлены нехваткой конкретного компонента системы кровообращения.
Двух-, трёхростковая, рефрактерная цитопения, панцитопения считаются симптомами миелодиспластического синдрома (МДС) – неспособности костного мозга воспроизводить клетки крови. Группа заболеваний МДС располагает кодом по МКБ-10 D46.
Эритроцитопения
Нехватка красных кровяных тел. Патология вынуждает уменьшать количество гемоглобина и кислорода в организме, приводящее к утомлению и ухудшению состояния больного. По признакам патология характерна типичному оголоданию человека: озноб, слабое внимание, потеря массы, головокружение. Все видимые покровы портятся (растрескивание губ, бледность или пожелтение кожи, кариес и рыхлые дёсны на зубах).
Видимые проявления тромбоцитопении
Лейкопения
Лейкопения – пониженный уровень лейкоцитов в системе кровообращения. Уменьшение их количества негативно сказывается на иммунной системе человека: сопротивление болезням слабеет, даже незначительные недуги протекают в тяжёлой форме. Сопровождается частыми инфекционными заболеваниями, недомоганием и высокой температурой тела. На теле появляются прыщи, болячки, фурункулы, нагноения.
Тромбоцитопения
Тромбоцитопения представляет собой изолированный дефицит тромбоцитов в цикле кровообращения. Имеет код по МКБ-10 D69. Внешне распознаётся частыми кровотечениями из носа, кровохарканием, черным калом (кровоизлияния в кишечнике). Телесные повреждения (и сильные, и слабые) вызывают синяки. Причины – ухудшение свёртываемости и меньшая вязкость крови: как итог, кровотечение (как внутреннее, так и наружное) занимает больше времени для остановки.
Другие виды
Пониженное содержание всех видов составляющих цикла кровообращения приводит к панцитопении.
Угнетение работы нескольких ростков кроветворения означает заболевание двухростковой или трёхростковой цитопенией. Также возможна рефрактерная цитопения – поражение всех ростков: нехватка гемоглобина, тромбоцитов и лейкоцитов. Тяжёлым видам недуга подвержены люди старше 70 лет.
Диагностика
Обнаружить и искоренить сразу недуг не получится: на первых порах заметных признаков нет. Количество элементов крови уменьшается постепенно: к плавным переменам организм стремится приспосабливаться. Симптомы проявляются только при длительном развитии патологии.
Электронная фотография эритроцита крови
Диагностика цитопении
Вероятное развитие цитопении возможно отследить при долгом наблюдении ряда общих симптомов: по частой заболеваемости, утомлению, недомоганиям, ломким ногтям, выпадению волос.
Точное определение наличия и разновидности патологии устанавливается специалистами. Диагностика заболевания проходит в ряд последовательных шагов:
- Началом послужит беседа больного с врачами. Затем, собрав необходимые сведения (анамнез, вероятность наследственных патологий) и проведя полный клинический осмотр, устанавливается характер заболевания.
- Следующий шаг – внутренний осмотр. Включает общий и биохимический анализ крови и мочи. Проводится иммунологическая и серологическая экспертиза (на уровень сопротивляемости организма и стадию развития уже имеющейся болезни).
- Забор пункции костного мозга, анализ полученных тканей.
- Выведение миелограммы (результатов анализа состояния костного мозга): изучение хода кроветворения.
- УЗИ брюшной полости (проверка на увеличение органов), МРТ и ПЭТ при необходимости.
Диагностика МДС
Обнаруживается и устанавливается диагноз МДС после гистологического и цитологического изучения поражённого органа.
Двухростковая цитопения – синдром рефрактерной цитопении с мультилинейной дисплазией (РЦМД): 10% клеток с нарушенным развитием, дефект двух или трёх ростков кроветворения.
Цитопения конкретного вида клеток – неклассифицированный МДС (с одноростковой дисплазией и отсутствием бластов) или рефракторная анемия (при наличии бластов).
Панцитопения вкупе с повышенным числом кольцевых сидеробластов (свыше 15%) говорит о РЦМД с кольцевыми сидеробластами.
Лечение цитопении
В случае подтверждения заболевания врачом-гематологом проводится лечение. Оно требует стационарных условий, а также регулярно сдавать кровь на анализ. Важно помнить: указанная болезнь – не самостоятельный недуг, а сопровождение другой патологии. Курс, нацеленный только на применении мер против цитопении, будет бесполезным.
Общее лечение заболевания
Обычное лечение (на предмет сниженного иммунитета) предусматривает употребление пациентом гормональных кортикостероидов и глюкокортикостероидов. Также гематологами выявляется нехватка минералов и иных компонентов крови: составляются курсы употребления витаминов и правильного питания, сравнение состояния пациента до, во время и после терапии. При острой необходимости допускается переливание крови. Результат терапии непредсказуем: возможен как положительный, так и негативный итог. Во время лечения процедуры и препараты подбираются с учётом особенностей патологии.
Лечить пациента стандартным курсом достаточно, если основной болезнью стала лёгкая или средняя степень анемии: восполняется недостаток железа, белков и витамина В12.
Цитопения обнаруживается не только у взрослых, но и у детей всех возрастов. Их комплекс лечения предполагает принятие Цитозара – предусматривается как дифференциальная, так и комбинированная терапия. Универсальность препарата делает его ключевым средством в достижении ремиссии раковых опухолей.
Специфическое лечение цитопении
По сравнению с консервативной терапией, к углублённому варианту лечения недуга прибегают, если заболевание-источник признан тяжёлой патологией.
При лейкозе, миеломе, метастазах костного мозга и иных онкологических заболеваниях в развитой форме стационарного лечения и насыщения организма становится недостаточно. Если применение цитозара также не привело к желаемым результатам, проводится хирургическое вмешательство: выполняется пересадка костного мозга. Эта операция считается наиболее действенным способом избавления от цитопении. Другой возможной процедурой (при соответствующих медицинских показаниях) считается удаление селезёнки.
После выполненных хирургических процедур назначается симптоматическое лечение. От правильно организованной диеты, восполняющей послеоперационную бедность организма питательными веществами, витаминами и минералами, и распределения физических нагрузок зависит восстановление организма и возвращение полноценной жизнедеятельности человека. Симптомы проходят, состояние нормализуется.
Профилактика и прогноз жизни
Методы, предупреждающие развитие цитопении на ранних сроках, отсутствуют: из-за адаптации организма начальную стадию невозможно распознать. Цель профилактических мер – уменьшить число обострений.
Предупреждающие мероприятия
Для профилактики переболевшему патологией нужно регулярно сдавать анализ крови и проходить обследование у врача-гематолога. Норма посещений – не реже 1 раза в полгода (или каждые 4 месяца, если риск рецидива велик).
Выздоровевший пациент для профилактики цитопении должен соблюдать каждый элемент здорового образа жизни:
- Здоровое питание: обогащение рациона свежими фруктами, ягодами, орехами, злаками, нежирным мясом и молоком, избегание жареной и жирной еды.
- Занятия лечебной физкультурой, двигательная активность: развивается кровообращение, улучшается иммунитет, стабилизируется работа сердца и лёгких.
- Полный отказ от вредных привычек: курения, алкоголя, переедания.
- Следование рекомендациям лечащего врача, регулярное употребление прописанных препаратов.
Сроки жизни после хирургической и химической терапии
Прогноз жизни и возможность полноценной жизнедеятельности зависит от общего физического состояния пациента, его возраста и заболевания, послужившего причиной развития цитопении. Практика показывает: после химиотерапии и остальных необходимых мер 4 из 5 переболевших гарантировано восстановление до нормы и пятилетний срок жизни.
При лейкозе в ранней стадии, анемии, инфекционных заболеваниях в случае их успешного преодоления обычно даётся положительный прогноз жизни.
Лечение миелодиспластического синдрома в тяжёлой форме зависит от своевременного переливания крови и трансплантации костного мозга (в особых случаях – стволовых клеток). Но, учитывая, что 80% больных – люди старше 60 лет (с ожидаемым сроком жизни до 12 лет), вопрос о применении хирургических мер почти не поднимается. Основной метод – лечение низкой интенсивности (переливание эритроцитов, белковое питание, химиотерапия) и поддерживающие меры для улучшения состояния и посильного продления существования.
В сравнении с довольно «лёгкими» патологиями, на поздних сроках онкологических недугов и метастазов в системе кровообращения также применяются лишь общие лечебные процедуры по поддержанию внешнего качественного состояния здоровья пациента. Неизлечимые патологии неизбежно ведут к смерти больного.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди:
Источник
Связанные заболевания и их лечение
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Причины
- Прогноз
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Миелодиспластический синдром.

Миелодиспластический синдром
Описание
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. Населения в год и увеличивается с возрастом.
Симптомы
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией.
Одышка. Тромбоцитоз. Увеличение лимфоузлов.
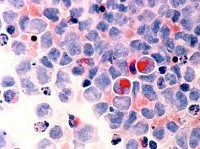
Миелодиспластический синдром
Диагностика
Диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика
Необходимо дифференцировать МДС от железа или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Причины
Первичный (идиоптический) тип — 80-90 % случаев, вторичный(вследствие предшествующей химиотерапии и факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы, топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и ), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
Факторы риска, первичный МДС:
• Контакт с токсинами (бензин, органические растворители, пестициды).
• Радиация.
• Курение.
• Врожденные и наследственные заболевания.
• Пожилой возраст.
Факторы риска, вторичный МДС:
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз ~30 % случаев.
Лечение
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»).
Выбор терапевтической тактики во многом определятся возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС:
• Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных часто получающих гемотрансфузии развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо — хелаторы (десферал, эксиджад).
• Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q- синдромом. Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии.
• Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом.
Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
• Химиотерапия.
• Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии.
Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся. Bowen D считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац. ), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС. Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остается актуальной.
• Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ. Пятилетняя выживаемость составляет около 18 %.
• Гипометилирующие препараты.
Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
