Двс синдром этиология патогенез лечение

Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).
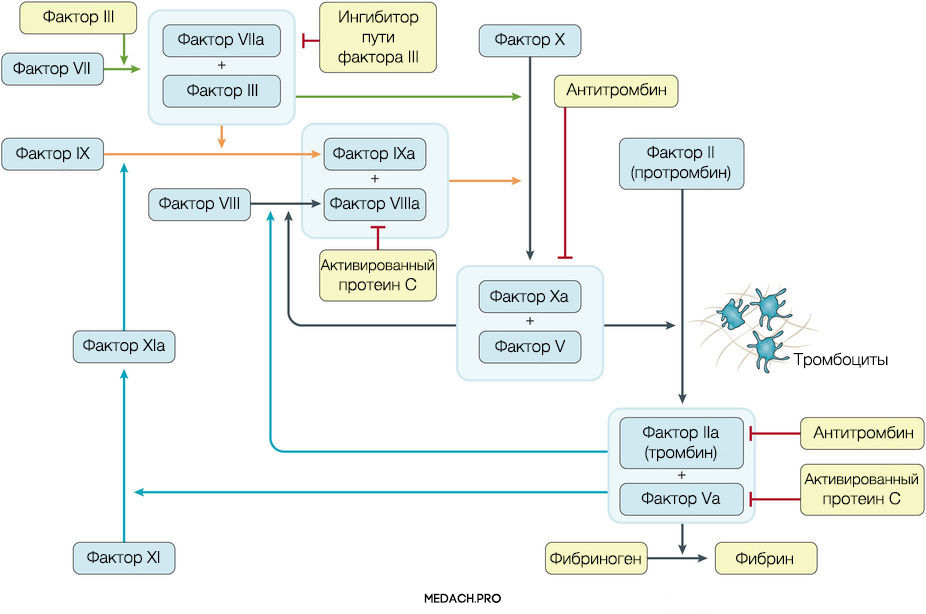
Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).
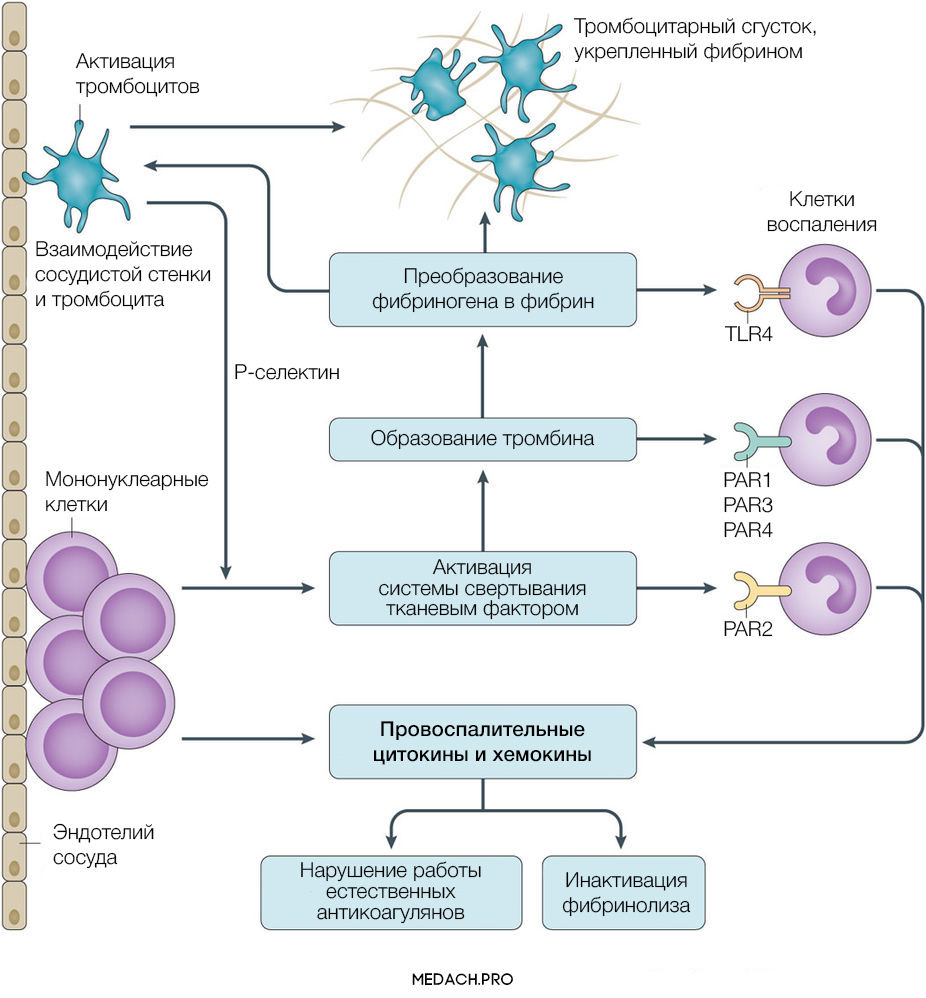
Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
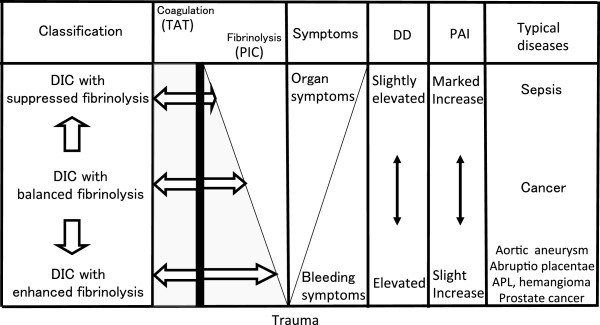
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):

Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):

Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):

Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
Лечение
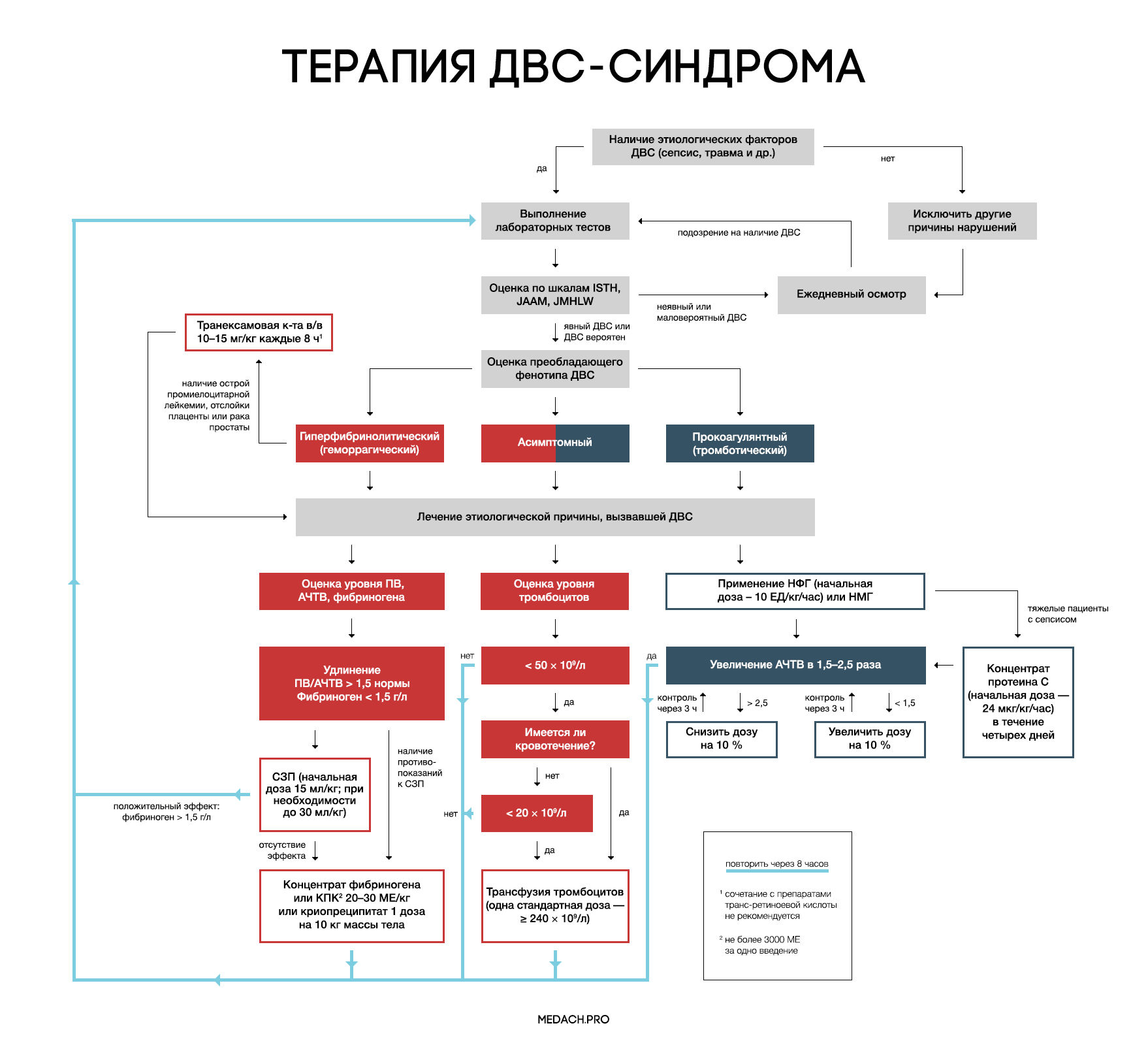
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов < 50 × 10^9 /л либо при отсутствии кровотечения, но наличии высокого риска его развития и уровне тромбоцитов < 20 × 10^9 /л. Трансфузия тромбоцитарной массы начинается с одной стандартной взрослой дозы (более 240 × 10^9/л). Переливание СЗП может применяться при удлинении ПВ/АЧТВ (больше 1,5 от нормы) или снижении уровня фибриногена менее 1,5 г/дл. Начальная доза СЗП составляет 15 мл/кг, при необходимости более жесткой коррекции уровня факторов свертывания допустимо использование дозы 30 мл/кг, однако следует помнить, что такие высокие дозы СЗП могут вызвать перегрузку объемом. КПК или концентрат фибриногена применяются при наличии подтвержденной тяжелой гипофибриногенемии (< 1,5 г/дл), несмотря на использование СЗП либо при наличии противопоказаний к ее применению. При применении 3 грамм концентрата фибриногена уровень фибриногена плазмы крови повышается примерно на 1 г/л. Такой же эффект достигается при переливании 4 единиц СЗП или 2 доз криопреципитата (10 донорских единиц). При планировании у пациентов инвазивных процедур необходимо контролировать уровень лабораторных показателей свертывания крови, и при необходимости превентивно провести трансфузию тромбоцитов или СЗП. Эффективность и безопасность применения рекомбинантного фактора VIIа у пациентов с ДВС требует дальнейшего исследования.
Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( < 30 x 10^9/л). Для контроля терапии используется АЧТВ. Исследования по применению тифакогина (рекомбинантного ингибитора пути тканевого фактора) не увенчались успехом.
На данный момент имеется ряд исследований по безопасности и эффективности рекомбинантного растворимого человеческого тромбомодулина (rhTM), однако их результаты гетерогенны. Проведенный метаанализ данных исследований показал, что препараты rhTM оказывают положительный эффект на выживаемость в группе тяжелого сепсиса и пациентов с количеством баллов по шкале APACHE II более 24 или по шкале SOFA более 11. На данный момент исследования препаратов rhTM перешли в третью фазу.
Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.
Источник
Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) – состояние, характеризующееся нарушениями в системе свертывания крови. При этом в зависимости от стадии ДВС-синдрома происходит образование множественных тромбов (кровяных сгустков) в сосудах различных органов либо возникает кровотечение.
Система свертывания крови включает в себя тромбоциты и факторы свертывания (специфические белки и неорганические вещества). В норме механизмы свертывания крови активизируются при дефекте стенки сосуда и кровотечении. В результате образуется тромб (кровяной сгусток), который закупоривает поврежденное место. Этот защитный механизм предотвращает потерю крови при различных повреждениях.
Синдром диссеминированного внутрисосудистого свертывания возникает на фоне других серьезных заболеваний (например, осложнений во время родов и беременности, тяжелых травм, злокачественных опухолей и других). При этом из поврежденных тканей выделяется значительное количество факторов свертывания, что приводит к образованию множественных тромбов в различных органах и тканях. Это затрудняет кровообращение в них и, как следствие, вызывает их повреждение и нарушение функций.
Большое количество тромбов приводит к уменьшению количества факторов свертывания крови (они расходуются в процессе формирования тромбов). Это снижает способность крови к свертыванию и приводит к кровотечениям (стадия гипокоагуляции).
ДВС-синдром является тяжелым осложнением и угрожает жизни пациента. Требуется проведение неотложных лечебных мероприятий, направленных на лечение основного заболевания (на фоне которого возник ДВС-синдром), предупреждение образования новых тромбов, остановку кровотечения, восстановление дефицита факторов свертывания и компонентов крови, поддержание нарушенных функций организма.
Синонимы русские
Коагулопатия потребления, синдром дефибринирования, тромбогеморрагический синдром.
Синонимы английские
Disseminated intravascular coagulation, сonsumption сoagulopathy, defibrination syndrome.
Симптомы
Симптомысиндрома диссеминированного внутрисосудистого свертывания зависят от стадии заболевания.
На стадии повышенной свертываемости крови образуются множественные тромбы в различных органах.
При тромбах в сосудах сердца и легких могут возникать эти и другие симптомы:
- боль в груди (может распространяться на левую руку, плечо, спину, шею, челюсть, верхнюю часть живота);
- одышка;
- чувство нехватки воздуха;
- холодный пот;
- тошнота;
- рвота.
Признаки образования тромбов в венах ног:
- боль в ногах;
- покраснение;
- жар;
- отечность.
При тромбозе сосудов головного мозга может развиваться острое нарушение мозгового кровообращения (инсульт). Ему сопутствуют:
- головная боль;
- потеря сознания;
- тошнота, рвота;
- речевые нарушения;
- слабость в мышцах или обездвиженность руки, ноги на одной стороне;
- слабость в мышцах или обездвиженность одной стороны лица;
- онемение преимущественно одной стороны тела.
Образование тромбов в сосудах других органов (например, почек) приводит к их повреждению и нарушению функций (почечная недостаточность).
Постепенно уменьшается количество факторов свертывания крови, так как они расходуются в процессе образования множественных тромбов. В результате ДВС переходит в стадию гипокоагуляции (снижения свертываемости крови). При этом может возникать кровотечение.
Симптомывнутреннего кровотечения (в различные внутренние органы и ткани):
- кровь в моче – в результате кровоизлияния в мочевой пузырь, почки;
- кровь в кале – кровоизлияние в желудочно-кишечном тракте (например, в желудке, тонком кишечнике);
- резкая головная боль, потеря сознания, судороги и другие проявления – при кровоизлиянии в мозг.
Симптомынаружного кровотечения:
- длительное кровотечение даже из минимальных повреждений кожи (например, из места инъекции);
- кровотечение из носа, десен;
- длительное обильное менструальное кровотечение у женщин;
- точечные кровоизлияния на коже (петехии).
Таким образом, проявления синдрома диссеминированного внутрисосудистого свертывания многообразны и зависят от стадии ДВС-синдрома, преимущественного поражения определенных органов.
Общая информация о заболевании
Синдром диссеминированного внутрисосудистого свертывания – нарушение в системе свертывания крови, которое развивается на фоне различных тяжелых заболеваний.
Причинами развития ДВС-синдрома могут быть:
- осложнения во время беременности и родов (например, отслойка плаценты, гибель плода, тяжелая кровопотеря и другие);
- сепсис – тяжелое заболевание, при котором инфекция циркулирует в крови и разносится по всему организму;
- тяжелые травмы, ожоги, при которых в кровоток попадает большое количество веществ из разрушенных клеток, повреждается эндотелий (внутренняя стенка сосудов); эти и другие механизмы могут вызывать активацию процессов свертывания крови;
- злокачественные опухоли – механизм развития диссеминированного внутрисосудистого свертывания при злокачественных опухолях изучен не до конца, по мнению исследователей, некоторые виды злокачественных опухолей (например, аденокарцинома поджелудочной железы) могут выделять в кровь вещества, активирующие процессы свертывания крови;
- сосудистые нарушения – такие сосудистые заболевания, как аневризма аорты (расширение сосуда, которое грозит его разрывом), могут вызывать локальное усиление коагуляции (свертывания крови). Попадая в кровоток, активированные факторы свертывания приводят к синдрому диссеминированного внутрисосудистого свертывания во всем организме;
- укусы ядовитых змей.
Таким образом, данные состояния способны вызывать выход в кровь большого количества стимуляторов свертывания крови, в результате чего происходит образование тромбов в сосудах различных органов. Это может приводить к нарушению кровоснабжения легких, почек, головного мозга, печени и других органов. В наиболее тяжелых случаях происходит выраженное нарушение функций нескольких органов (полиорганная недостаточность).
Постепенно происходит снижение уровня факторов свертывания крови, так как они расходуются при образовании тромбов. В результате способность крови к свертыванию резко снижается. Это может приводить к возникновению кровотечений. Выраженность кровотечения может варьировать от небольших кровоизлияний на коже (петехий), до возникновения массивных кровотечений из желудочно-кишечного тракта, кровоизлияний в головной мозг, легкие и другие органы.
Синдром диссеминированного внутрисосудистого свертывания бывает острым и хроническим. При остром ДВС — синдроме после короткой фазы гиперкоагуляции (повышенной свертываемости крови) может развиваться гипокоагуляция (снижение свертываемости крови). При этом основными проявлениями будет возникновение кровотечений и кровоизлияний в различные органы.
При хроническом ДВС-синдроме на первый план выступает образование тромбов. Частой причиной хронического синдрома диссеминированного внутрисосудистого свертывания является рак.
Синдром диссемнированного внутрисосудистого свертывания является грозным осложнением. По данным различных исследователей, наличие ДВС-синдрома увеличивает риск летального исхода в 1,5 — 2 раза.
Кто в группе риска?
К группе риска относятся:
- женщины, имеющие серьезные осложнения во время беременности и родов (например, отслойка плаценты)
- пациенты с сепсисом (тяжелое состояние, при котором происходит распространение инфекции током крови по всему организму)
- лица, имеющие тяжелые травмы, ожоги
- лица, имеющие злокачественные опухоли (например, аденокарцинома простаты)
- лица, подвергшиеся укусам ядовитых змей.
Диагностика
Ключевую роль в диагностике синдрома диссеминированного внутрисосудистого свертывания имеет лабораторная диагностика. Определение параметров свертывания крови также имеет большое значение при лечении ДВС – синдрома. Проводятся следующие лабораторные исследования:
- Коагулограмма. Анализ свертывающей системы крови. Свертывание крови – сложный процесс, в котором участвует множество компонентов. Оценка параметров свертывания включает в себя несколько показателей: АЧТВ (Активированное частичное тромбопластиновое время), МНО (Международное нормализованное отношение), протромбиновый индекс, антитромбин III, D-димеры, фибриноген и другие. При ДВС-синдроме требуется комплексная оценка данных показателей.
- Активированное частичное тромбопластиновое время (АЧТВ). Показывает время, за которое образуется сгусток крови при добавлении в плазму крови (жидкая часть крови) определенных химических реагентов. Повышение данного показателя говорит о гипокоагуляции, то есть снижении способности крови к свертыванию (склонность к кровотечению), снижение данного показателя является указанием на повышенный риск тромбообразования (образования кровяных сгустков).
- Протромбиновый индекс (ПИ). Протромбин – белок, который образуется в печени. Он является предшественником тромбина – белка, необходимого для свертывания крови. Протромбиновый индекс показывает отношение времени свертывания плазмы здорового человека к времени свертывания плазмы пациента. Выражается данный показатель в процентах. Увеличение данного показателя указывает на повышенную свертываемость крови, уменьшение – снижение способности крови к формированию кровяного сгустка.
- Международное нормализованное отношение (МНО). Показатель системы свертывания крови. Увеличение данного показателя наблюдается при снижении способности крови к свертыванию. Является важным параметром при лечении препаратами, влияющими на систему свертывания крови.
- Антитромбин III. Является природным веществом, которое снижает свертываемость крови. В стадии образования тромбов количество антитромбина уменьшается. По данному показателю косвенно можно судить о выраженности ДВС-синдрома.
- Фибриноген. Фибриноген – белок, который необходим для процесса свертывания крови. В стадию повышенной свертываемости крови при ДВС-синдроме наблюдается снижение уровня фибриногена.
- D-димеры. D – димеры являются одним из конечных продуктов расщепления фибриногена (белка, участвующего в свертывании крови). Повышение уровня D – димеров указывает на активацию тромбообразования. Уровень повышен в стадию гиперкоагуляции при ДВС-синдроме.
- Тромбиновое время. Время, необходимое для образования сгустка фибрина (белок, необходимый для образования тромба) при добавлении фермента (тромбина). Увеличение данного показателя наблюдается при гипокоагуляции (снижении способности крови к свертыванию).
- Общий анализ крови. Данный показатель позволяет определить количество основных компонентов крови: эритроцитов, гемоглобина, тромбоцитов, лейкоцитов. При ДВС – синдроме может быть снижение количества тромбоцитов.
Оценка функции почек, печени:
- Креатинин в сыворотке крови. Креатинин образуется в мышцах, затем попадает в кровь. Участвует в обменных процессах, сопровождающихся выделением энергии. Выводится из организма с мочой через почки. При нарушении функции почек уровень креатинина в крови возрастает.
- Мочевина в сыворотке. Мочевина – конечный продукт обмена белков. Выводится из организма почками с мочой. Уровень мочевины возрастает при нарушении функционирования почек.
- Аланинаминотрансфераза (АЛТ). Аланинаминотрансфераза — фермент, который содержится во многих клетках организма, преимущественно в клетках печени. При повреждении клеток печени данный фермент попадает в кровь. Повышение уровня данного фермента наблюдается при поражении печени.
Исследования:
Диагностика ДВС-синдрома основана на клинических данных и лабораторных анализах. Различные исследования могут быть необходимы для диагностики основного заболевания, возникших осложнений. Необходимость проведения и объем исследований определяется лечащим врачом.
Лечение
Тактика лечения синдрома диссеминированного внутрисосудистого свертывания зависит от причин его возникновения, тяжести состояния больного и других факторов.
Острый синдром диссеминированного внутрисосудистого свертывания является тяжелым состоянием, которое угрожает жизни больного и требует проведения интенсивных лечебных мероприятий. Лечение может быть направлено на устранение причин, вызвавших ДВС – синдром (основное заболевание), на предупреждение образования тромбов в сосудах, остановку кровотечения, восстановление нормального объема крови и ее компонентов. Для этого может проводиться переливание свежезамороженной плазмы (жидкая часть крови, взятая от донора), компонентов крови, внутривенное введение различных растворов, применяются препараты, влияющие на свертываемость крови, и другие медикаменты.
Профилактика
Специфической профилактики синдрома диссеминированного внутрисосудистого свертывания не существует.
Рекомендуемые анализы
- Коагулограмма №3 (ПИ, МНО, фибриноген, АТIII, АЧТВ, D-димер)
- Тромбиновое время
- Общий анализ крови
- Креатинин в сыворотке
- Мочевина в сыворотке
- Аланинаминотрансфераза (АЛТ)
Литература
- Dan L. Longo, Dennis L. Kasper,J. Larry Jameson, Anthony S. Fauci, Harrison’s principles of internal medicine (18th ed.). New York: McGraw-Hill Medical Publishing Division, 2011. Chapter 116. Coagulation Disorders. Disseminated Intravascular Coagulation.
- Mark H. Birs, The Merk Manual, Litterra 2011. Chapter 17, p. 694. Disseminated Intravascular Coagulation.
Источник
