Двс синдром и его заключение
ДВС-синдром (диссеминированное внутрисосудистое свёртывание, коагулопатия потребления, тромбогеморрагический синдром) — это патологический неспецифический процесс, характеризующийся образованием диссеминированных тромбов (фибринных, эритроцитарных и гиалиновых) в сосудах микроциркуляторного русла в сочетании с несвёртываемостью крови, приводящей к множественным массивным кровоизлияниям.
Может протекать бессимптомно или в виде остро развившейся коагулопатии. Часто встречается при различной акушерской патологии, различных видах шока, тяжёлых травмах, бактериальном сепсисе[3].
Классификация[править | править код]
Выделяют 3 основных типа течения заболевания.
- Острый ДВС синдром.
- Подострый ДВС синдром.
- Хронический ДВС синдром[4].
Также существует довольно большое количество классификаций по стадиям развития процесса.
По М. С. Мачабели выделяют 4 стадии[5]:
- I стадия — гиперкоагуляции;
- II стадия — коагулопатия потребления;
- III стадия — резкое снижение в крови всех прокоагулянтов, вплоть до полного отсутствия фибриногена;
- IV стадия — восстановительная.
По Фёдоровой З. Д. и др. (1979), Барышеву Б. А. (1981) классификация имеет следующий вид[5]:
- I стадия — гиперкоагуляции;
- II стадия — гипокоагуляции;
- III стадия — гипокоагуляции с генерализованной активацией фибринолиза;
- IV стадия — полное несвертывание крови.
Этиология[править | править код]
Этиологические формы острого и подострого ДВС-синдрома[править | править код]
- Инфекционно-септические:
- бактериальные;
- вирусные;
- токсически-шоковый (в том числе при абортах).
- Травматические и при деструкциях тканей:
- ожоговый;
- синдром длительного сдавления;
- массивные травмы;
- при некрозах тканей и органов (острая токсическая дистрофия печени, некротический панкреатит, острый инфаркт миокарда и др.);
- при остром внутрисосудистом гемолизе, в том числе при переливаниях несовместимой крови;
- при травматичных операциях;
- при массивных гемотрансфузиях;
- при гемобластозах, прежде всего при остром промиелоцитарном лейкозе;
- при острой лучевой болезни.
- Акушерские и гинекологические:
- при эмболии околоплодными водами (особенно инфицированными);
- при ранней отслойке и предлежании плаценты;
- при атонии и массаже матки;
- при внутриутробной гибели плода и его ретенции;
- при преэклампсии и эклампсии.
- Шоковые (при всех терминальных состояниях).
- В процессе интенсивной химиотерапии.
- При трансплантации органов.
Причинами хронического (затяжного) ДВС-синдрома чаще всего являются следующие виды патологии:
- хрониосепсис, включая затяжной септический эндокардит;
- хронические иммунные и иммунокомплексные болезни;
- хронические вирусные заболевания (гепатит, ВИЧ и др.);
- опухолевые процессы (рак, лимфомы, лейкозы и др.).
Фазы ДВС-синдрома:
- I фаза — гиперкоагуляция. Потеря факторов свертывающей системы в процессе обильного кровотечения приводит к удлинению времени образования сгустка и его ретракции, удлинению времени капиллярного кровотечения. Лабораторные показатели: уменьшение времени свертывания крови, тромбинового времени, положительный этаноловый тест.
- II фаза — гипокоагуляция. При геморрагическом шоке в фазе спазма венул и артериол (клинические проявления: дегидратация, бледные и холодные кожные покровы, признаки острой почечной недостаточности) в капиллярах развивается расслоение плазмы и форменных элементов — «сладж»-феномен. Агрегация форменных элементов, обволакивание их фибрином сопровождаются потреблением факторов свертывания крови и активацией фибринолиза. Лабораторные показатели: умеренная тромбоцитопения (до 120×109/л), тромбиновое время 60 с и больше, резко положительный этаноловый тест.
- III фаза — потребления с активацией местного фибринолиза. Афибриногенемия в сочетании с выраженной активацией фибринолиза. При этой фазе рыхлые сгустки крови в месте кровотечения быстро (в течение 15-20 мин) лизируются на 50 %. Лабораторные показатели: увеличение времени свертывания крови, тромбинового времени, уменьшение тромбоцитов до 100×109/л, быстрый лизис сгустка.
- IV фаза — генерализованный фибринолиз. Капиллярная кровь не свертывается, отмечаются паренхиматозное кровотечение, петехиальные высыпания на коже и внутренних органах, гематурия, выпот в синовиальные полости и терминальные изменения в органах и системах.
Патогенез[править | править код]
Основные звенья патогенеза ДВС-синдрома[править | править код]
1. Начальная активация гемокоагуляционного каскада и тромбоцитов эндогенными факторами: тканевым тромбопластином, лейкоцитарными протеазами, продуктами распада тканей, опухолевыми прокоагулянтами;
2. Персистирующая тромбинемия с повышением уровня её маркеров в крови (РФМК и D-димеров);
3. Истощение системы физиологических антикоагулянтов со значительным снижением содержания в плазме антитромбина III, протеина С, плазминогена и повышением уровня тромбомодулина в плазме крови;
4. Системное поражение сосудистого эндотелия и снижение его антитромботического потенциала;
5. Образование микросгустков крови и блокада микроциркуляции в органах-мишенях (мозг, надпочечники, почки, печень, желудок и кишечник (субсиндром полиорганной недостаточности) с развитием дистрофических и деструктивных нарушений в них).
6. Активация фибринолиза в зоне блокады микроциркуляции и истощение его резервов в общей циркуляции;
7. Потребление факторов гемокоагуляции и тромбоцитопения (и — патия) потребления, приводящие к системной кровоточивости и терминальной гипокоагуляции вплоть до полной несвертываемости крови (геморрагическая фаза синдрома);
8. Нарушение барьерной функции слизистой оболочки желудка и кишечника с трансформацией асептического ДВС-синдрома в септический;
вторичная тяжелая эндогенная интоксикация.
Клиническая картина[править | править код]
В клинической картине ДВС-синдрома отмечаются:
- в 1-й стадии — симптомы основного заболевания и признаки тромбогеморрагического синдрома (с преобладанием проявлений генерализованного тромбоза), гиповолемия, нарушение метаболизма;
- во 2-й стадии появляются признаки полиорганного повреждения и блокады системы микроциркуляции паренхиматозных органов, геморрагический синдром (петехиально-пурпурный тип кровоточивости);
- в 3-й стадии к указанным нарушениям присоединяются признаки полиорганной недостаточности (острая дыхательная, сердечно-сосудистая, печеночная, почечная, парез кишечника) и метаболические нарушения (гипокалиемия, гипопротеинемия, метаболический синдром по смешанному типу (петехии, гематомы, кровоточивость из слизистых оболочек, массивные желудочно-кишечные, легочные, внутричерепные и другие кровотечения, кровоизлияния в жизненно важные органы);
- в 4-й стадии (при благоприятном исходе) основные витальные функции и показатели гемостаза постепенно нормализуются.
Диагностика[править | править код]
Проводится диагностика свертывания крови и нарушения фибринолиза.
ЭКСПРЕСС-ДИАГНОСТИКА НАРУШЕНИЯ ГЕМОСТАЗА.
| показатель | норма | 1 фаза | 2 фаза | 3 фаза | 4 фаза |
|---|---|---|---|---|---|
| время свертывания | 5-12 | менее 5 | 5-12 | более 12 | более 60 |
| лизис сгустка | нет | нет | нет | быстрый | сгусток не образуется |
| число тромбоцитов | 175-425 | 175-425 | менее 120 | менее 100 | менее 60 |
Гиперкоагуляционная фаза ДВС-синдрома
При наличии заболевания или состояния, которое может вызвать гиперкоагуляционный синдром, необходимо определить ряд лабораторных показателей коагулограммы и тенденции их изменения с течением времени. АЧТВ может сокращаться, уровень тромбоцитов падает, уровни D-димеров, тромбин-антитромбиновых комплексов, фрагментов протромбина растут.
Гипокоагуляционная фаза ДВС-синдрома
Для этой фазы характерно сочетание геморрагических проявлений в результате полной несвертываемости крови с выраженной полиорганной недостаточностью. Лабораторные показатели на этой стадии демонстрируют выраженную гипокоагуляцию: сгусток в пробирке не образуется, резко удлиняется АЧТВ и ПВ, снижается уровень антитромбина III, в крови резко повышается уровень D-димеров, развивается выраженная тромбоцитопения, и тромбоциты перестают полноценно агрегировать (тромбоцитопатия ДВС-синдрома).
Лечение[править | править код]
Немедленное переливание минимум 1 литра свежезамороженной плазмы в течение 40-60 мин, гепарина внутривенно в начальной дозе 1000 ед/час с помощью инфузомата или капельно (суточная доза гепарина нуждается в уточнении после анализа коагулограммы).
Купирование шока: инфузии кровезаменителей, глюкокортикоидов, наркотические анальгетики, допамин.
Антиагрегантная терапия: аспирин (aцетилсалициловая кислота).
Активация фибринолиза: никотиновая кислота, плазмаферез.
Ингибиторы протеолитических ферментов: контрикал.
Прогноз[править | править код]
Прогноз варьируется в зависимости от основной патологии и степени внутрисосудистого тромбоза. Так на 1 и 2 стадии он благоприятный, но лишь при наличии адекватного лечения; сомнительный на 3; и летальный на 4. Для пациентов с ДВС-синдромом, независимо от причины вызвавшей его, прогноз часто мрачен: от 20 % до 50 % пациентов умирают. ДВС-синдром осложненный сепсисом имеет значительно более высокий уровень смертности, чем не осложненный.
См. также[править | править код]
- Сепсис
- Шок
- Коагулологические исследования
Примечания[править | править код]
Ссылки[править | править код]
- Цикл Видеолекций по ДВС-синдрому
Источник
Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
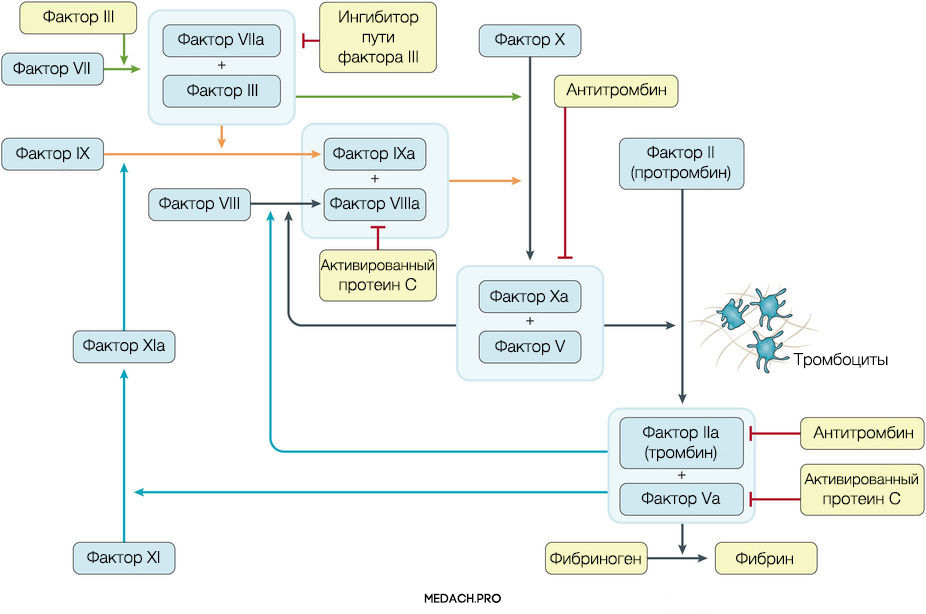
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).

Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).
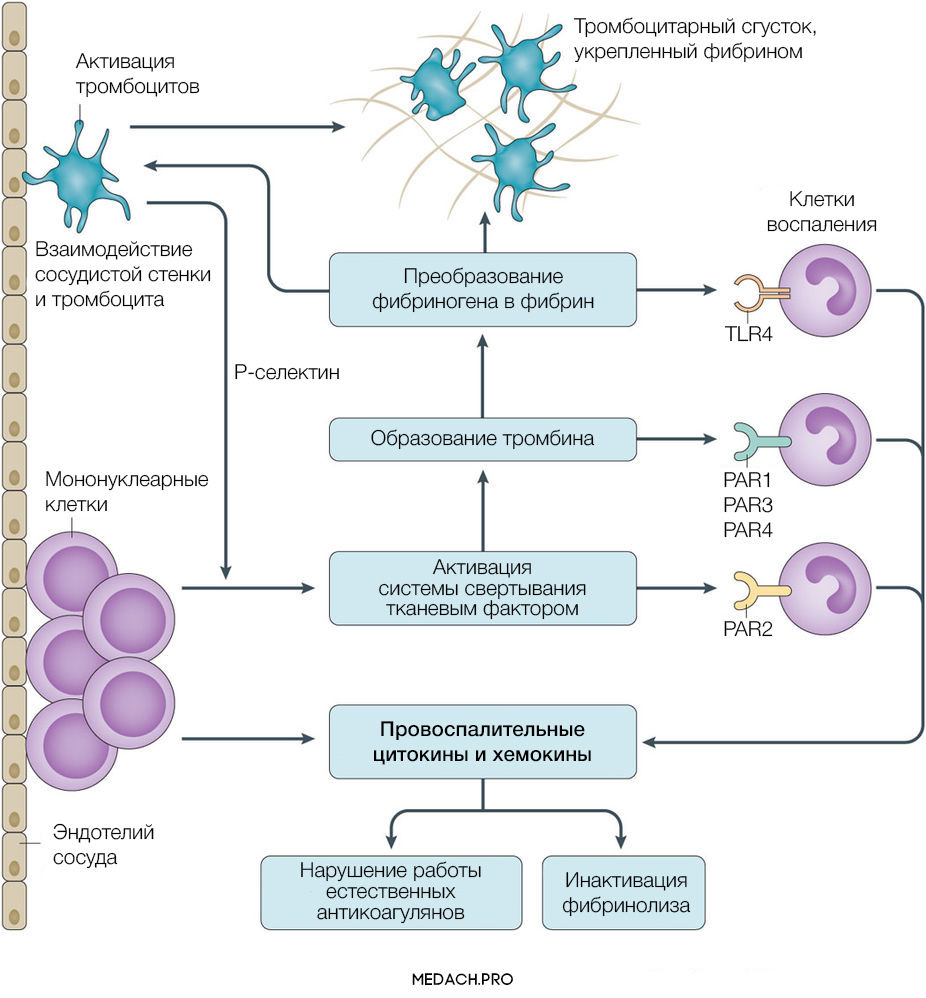
Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
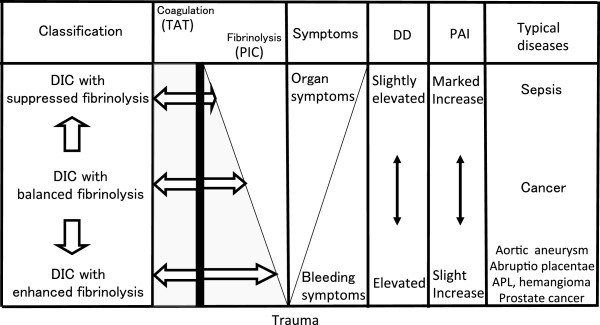
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):

Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):

Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):

Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
Лечение
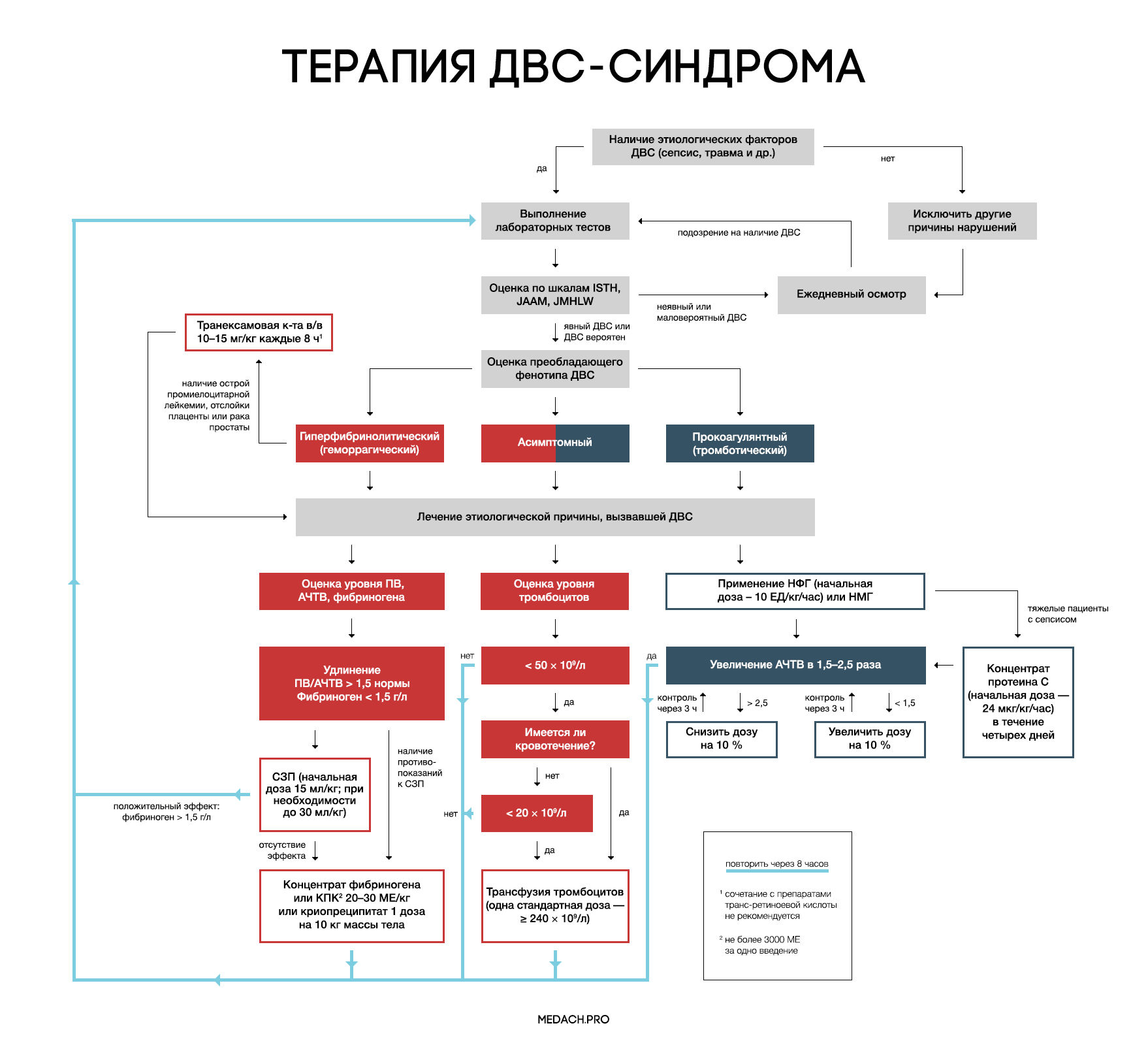
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов < 50 × 10^9 /л либо при отсутствии кровотечения, но наличии высокого риска его развития и уровне тромбоцитов < 20 × 10^9 /л. Трансфузия тромбоцитарной массы начинается с одной стандартной взрослой дозы (более 240 × 10^9/л). Переливание СЗП может применяться при удлинении ПВ/АЧТВ (больше 1,5 от нормы) или снижении уровня фибриногена менее 1,5 г/дл. Начальная доза СЗП составляет 15 мл/кг, при необходимости более жесткой коррекции уровня факторов свертывания допустимо использование дозы 30 мл/кг, однако следует помнить, что такие высокие дозы СЗП могут вызвать перегрузку объемом. КПК или концентрат фибриногена применяются при наличии подтвержденной тяжелой гипофибриногенемии (< 1,5 г/дл), несмотря на использование СЗП либо при наличии противопоказаний к ее применению. При применении 3 грамм концентрата фибриногена уровень фибриногена плазмы крови повышается примерно на 1 г/л. Такой же эффект достигается при переливании 4 единиц СЗП или 2 доз криопреципитата (10 донорских единиц). При планировании у пациентов инвазивных процедур необходимо контролировать уровень лабораторных показателей свертывания крови, и при необходимости превентивно провести трансфузию тромбоцитов или СЗП. Эффективность и безопасность применения рекомбинантного фактора VIIа у пациентов с ДВС требует дальнейшего исследования.
Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( < 30 x 10^9/л). Для контроля терапии используется АЧТВ. Исследования по применению тифакогина (рекомбинантного ингибитора пути тканевого фактора) не увенчались успехом.
На данный момент имеется ряд исследований по безопасности и эффективности рекомбинантного растворимого человеческого тромбомодулина (rhTM), однако их результаты гетерогенны. Проведенный метаанализ данных исследований показал, что препараты rhTM оказывают положительный эффект на выживаемость в группе тяжелого сепсиса и пациентов с количеством баллов по шкале APACHE II более 24 или по шкале SOFA более 11. На данный момент исследования препаратов rhTM перешли в третью фазу.
Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.
Источник
