Дистрофия мкб 10 код
Содержание
- Описание
- Причины
- Симптомы
- Лечение
- Профилактика
- Основные медицинские услуги
- Клиники для лечения
Названия
Дистрофия.
Описание
Дистрофия – патологический процесс, ведущий к потере или накоплению тканями веществ, не свойственных ей в нормальном состоянии (например, скопление угля в легких). При дистрофии клетки и межклеточное вещество повреждаются, вследствие чего нарушается и функционирование больного органа. За метаболизм и сохранность структуры клеток отвечает комплекс механизмов – трофика. Именно она страдает при дистрофии: нарушается саморегуляция клеток и транспорт продуктов метаболизма.
Дистрофия чаще всего поражает детей до трех лет, что ведет к задержке физического, интеллектуального и психомоторного развития, нарушениям иммунной системы и обмена веществ.
Причины
Дистрофия может быть обусловлена множеством различных причин. Помимо врожденных генетических нарушений обмена веществ, появление заболевания могут вызвать инфекционные болезни, стрессы, нерациональное питание. Также причинами дистрофии могут стать неправильный образ жизни, внешние неблагоприятные факторы, слабый иммунитет, хромосомные заболевания.
Бытует ошибочное мнение, что дистрофии подвержены только дети, которые родились раньше срока. Но болезнь может возникнуть из-за длительного голодания или переедания (особенно углеводсодержащих продуктов), проблем желудочно-кишечного тракта, соматических заболеваний и проч.
Врожденная дистрофия часто возникает из-за слишком молодого или, наоборот, пожилого возраста матери больного ребенка.
Симптомы
Симптомы дистрофии проявляются исключительно в зависимости от ее формы и степени тяжести. Общими признаками заболевания принято считать возбуждение, потерю аппетита и ухудшение сна, слабость, утомляемость, задержку роста (у детей), потерю веса и проч.
При гипотрофии (I–II степени) снижается масса тела (на 10–30 %), наблюдается бледность, снижение мышечного тонуса и эластичности тканей, истончается или исчезает подкожная клетчатка, появляется витаминная недостаточность. У больных нарушается иммунитет, может увеличиваться печень, стул нарушен (чередование запоров и поносов).
При гипотрофии III степени наступает истощение, кожа теряет эластичность, западают глазные яблоки, нарушается дыхание и сердечный ритм, снижается артериальное давление и температура тела.
Паратрофия выражается в избыточном откладывании жира в подкожной клетчатке. Больной бледен и подвержен аллергическим реакциям; наблюдаются нарушения работы кишечника, дисбактериоз, анемия. В складках кожи часто появляются опрелости.
Гипостатура часто сопровождает гипотрофию II–III степени. Ее симптомами являются бледность, снижение эластичности тканей, функциональные расстройства нервной системы, нарушения метаболизма, снижение иммунитета. Гипостатура является стойкой формой дистрофии, поэтому существуют определенные трудности в ее лечении. Примечательно также, что отсутствие других симптомов дистрофии (снижение веса, слабость ) может считать гипостатуру нормальным признаком конституциональной низкорослости.
Лечение
Лечение дистрофии всегда должно быть комплексным и зависеть от ее вида и степени тяжести. Если дистрофия имеет вторичный характер, упор делают на лечение болезни, ставшей ее причиной. В противном же случае основным средством лечения является диетотерапия и профилактика вторичных инфекций (при дистрофии иммунитет снижен и больной подвержен различным заболеваниям).
При гипотрофии I степени детей лечат дома, но при II и III степени заболевания требуется стационарный режим с помещением больного ребенка в бокс.
Диета является основой при рациональном лечении дистрофии.
При гипотрофии на первом этапе выясняется переносимость определенной пищи, а затем увеличивается ее объем и качество (до выздоровления).
Больным показано грудное молоко, кисломолочные смеси, дробное питание (до 10 раз в день), ведение дневника пищи (с указанием изменений стула и массы тела). Также больным назначают витамины, ферменты, стимуляторы и биологически активные добавки.
Профилактика
Профилактика дистрофии имеет множество нюансов: чтобы уберечь ребенка от этого заболевания, будущая мать должна следить за своим здоровьем, соблюдать режим дня, отказаться от вредных привычек. После рождения ребенка необходимо соблюдать все правила кормления и ухода за ним, своевременно лечить инфекционные и другие заболевания, ежемесячно проводить взвешивание и измерение роста.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
Содержание
- Синонимы диагноза
- Описание
- Дополнительные факты
- Причины
- Классификация
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Лечение
Другие названия и синонимы
Алиментарный маразм.
Названия
Название: Алиментарная дистрофия.

Алиментарная дистрофия
Синонимы диагноза
Алиментарный маразм.
Описание
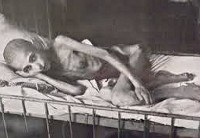
Алиментарная дистрофия. Заболевание, характеризующееся тяжелой белковой и чаще более выраженной энергетической недостаточностью. Проявления могут быть самыми различными, основные — потеря массы тела более 20% (или ИМТ менее 16), сухость и дряблость кожи, ломкость волос и ногтей, вялость, сонливость и слабость, повышенный аппетит. Диагностика строится в основном на анамнезе, сочетании объективных и субъективных признаков, а также на исключении других заболеваний. Лечение комплексное, заключается в налаживании питания и восстановлении запасов питательных веществ, витаминов и микроэлементов в организме.

Алиментарная дистрофия
Дополнительные факты
Алиментарная дистрофия (алиментарный маразм) — это социальное заболевание, которое может развиться в результате вынужденного или осознанного голодания. На сегодняшний день алиментарным маразмом страдают люди не только в развивающихся странах, во время войн и катастроф – а это более полумиллиона человек. Многие готовы морить себя голодом осознанно в погоне за красивой фигурой и в угоду своим комплексам. Однако заболевание может иметь тяжелые последствия, вплоть до летального исхода. При длительном голодании, отсутствии поступления незаменимых веществ в организме могут произойти необратимые изменения метаболических процессов. В развитых странах все чаще можно услышать о случаях анорексии — а это та же алиментарная дистрофия тяжелой степени.
Причины
Причиной алиментарного маразма служит длительное голодание, во время которого в организм поступает недостаточное количество питательных веществ и энергии. При этом учитывается и их относительная недостаточность: когда поступление калорий не соответствует их расходу. Голодание может наступить по разным причинам (война, экологическое бедствие и другие случаи, когда человек вынужденно длительно не получает пищу; диеты; сужение и рубцы пищевода и прочее), однако усугубление процесса провоцируется тяжелым физическим трудом, переохлаждением.
Следует заметить, что развитие дистрофии возможно только при длительном энергетическом голодании. При этом в организме сначала полностью истощаются запасы гликогена и жиров, затем для обеспечения основного обмена используются запасы внутритканевого белка. В первую очередь процессы дистрофии начинаются в коже, мышцах, затем задействуются внутренние органы, в самую последнюю очередь – жизненно важные (сердце, почки и мозг). В какой-то момент процессы катаболизма принимают такую форму, что летальный исход становится неизбежным даже при начале полноценного лечения.
На последних стадиях заболевания в организме истощаются запасы витаминов и минералов, перестает функционировать иммунная система. Летальный исход обычно наступает или от сердечной недостаточности, или от присоединившейся инфекции на фоне значительного угнетения иммунитета.
Классификация
В гастроэнтерологии принято разделять алиментарную дистрофию как по формам, так и по тяжести. По форме заболевание делится на кахектическую (сухую) и отечную. Кахектическая форма имеет более неблагоприятное течение. Отечная форма характеризуется развитием распространенных отеков, в том числе и внутренних (асцит, перикардит и плеврит), эта форма лучше поддается лечению.
По тяжести заболевания различают три стадии. На первой стадии отмечается незначительное снижение массы тела, сохранение работоспособности наряду с появлением жалоб на более частые мочеиспускания, жажду и повышение аппетита, зябкость и слабость. На второй стадии отмечается значительное исхудание с потерей работоспособности. Такие больные еще могут себя обслуживать, но практически не способны на какой-либо труд. Могут появляться отеки, значительно снижается уровень белка, часто бывают эпизоды понижения уровня глюкозы крови. На третьей стадии больные уже не могут самостоятельно передвигаться и вставать с кровати, резко истощены. При появлении голодной комы даже у пациента, который до этого сохранял работоспособность, говорят о третьей стадии заболевания.
Симптомы
Алиментарная дистрофия развивается исподволь, нередко пациент может не отдавать себе отчет, что страдает этим недугом. Обычно первые признаки кахексии проявляются только после длительного ограничения поступления в организм не только калорий, но и белка, жиров, незаменимых аминокислот и витаминов (чаще жирорастворимых). Первые симптомы могут быть не замечены или не расценены как опасные: учащение мочеиспускания, полиурия (увеличение суточного объема мочи), слабость и раздражительность, снижение работоспособности, постоянная сонливость. Часто беспокоит жажда, повышенный аппетит. Один из специфических симптомов – склонность к поеданию соли.
Если питание не будет налажено, заболевание прогрессирует и переходит в следующую стадию. При этом кожа становится очень дряблой и сухой, провисает складками, напоминает пергамент. Выполнять любую физическую работу становится очень тяжело, общее состояние страдает достаточно сильно. Появляются первые признаки дистрофии и нарушения функционирования внутренних органов (запоры и другие диспепсические проявления, нарушения работы сердца, эндокринные нарушения – у женщин пропадают менструации, наступает бесплодие). Отмечается склонность к понижению температуры. Сердцебиение урежается, давление низкое. Могут появиться изменения в психике.
Последняя стадия заболевания характеризуется ярким проявлением угасания всех функция организма. Подкожно-жировой слой отсутствует, мышцы становятся очень тонкими и дряблыми. Самостоятельно передвигаться человек на третьей стадии уже не способен. Отмечается снижение уровня всех клеток крови (эритроцитов, лейкоцитов, тромбоцитов), угнетается иммунитет. В крови отмечается очень низкий уровень белка, склонность к снижению уровня глюкозы. Полностью истощаются запасы витаминов и минералов, кости становятся ломкими. Так как организм запускает катаболизм (разрушение) собственных белков, то в крови начинают накапливаться ядовитые продукты их распада. Это приводит к еще большему ухудшению состояния, появлению выраженных психических расстройств (результат действия продуктов распада на головной мозг). Обычно на последних стадиях заболевания даже начало лечения и питания не может предотвратить печальный исход.
Тяжелейшее состояние, которое развивается на последних стадиях алиментарной дистрофии – голодная кома. Возникает она из-за значительного снижения уровня глюкозы в крови и невозможности обеспечить головной мозг необходимым количеством энергии. Клиника этого состояния достаточно яркая: внезапная потеря сознания, бледность и холодность кожи, зрачки широкие. Температура тела значительно понижена. Дыхание поверхностное, может быть редким и неритмичным. Мышцы без тонуса, могут развиться судороги. Пульс практически не определяется, слабый, давление низкое. Если не оказать своевременную помощь, смерть наступит от остановки сердечной деятельности и дыхания.
Вялость. Жажда. Запор. Изменение веса. Истощение. Отсутствие аппетита. Потеря веса. Раздражительность. Судороги.
Диагностика
Диагноз может быть выставлен на основании тщательного сбора анамнеза и осмотра пациента. Если в анамнезе есть указания на длительное голодание, то имеется характерная для алиментарной дистрофии симптоматика и лабораторные показатели (развернутый клинический и биохимический анализы крови, признаки дистрофии внутренних органов по УЗИ, КТ или МРТ), а также исключили другие заболевания, диагноз не представляет затруднений.
Дифференциальная диагностика
Дифференцировать алиментарную дистрофию следует с другими заболеваниями, которые могут приводить к истощению организма: онкологические процессы (прежде всего рак желудка и кишечника), туберкулез, сахарный диабет, гипофизарные расстройства и тиреотоксикоз. Алиментарную дистрофию от других заболеваний отличает выраженное усиление жажды и аппетита, голод, очень сильное истощение мышц и изменения кожи, брадикардия и снижение температуры тела, нарушение работы всех эндокринных желез.
Лечение
Лечение данного заболевания на любой стадии начинают с нормализации режима дня, питания, отдыха и сна. Таких больных помещают в теплую проветриваемую палату, не допуская контакта с инфекционными больными. При первой стадии заболевания начинают дробное питание легко усваиваемой пищей. При второй и третьей стадии питание осуществляется как энтерально (энпиты – специальные питательные смеси), так и парентерально путем введения растворов глюкозы и других питательных веществ внутривенно.
Калорийность должна составлять для начала около 3000 ккал/сут, постепенно доводя до 4500 ккал/сут. В рацион обязательно включаются животные белки, общее количество белка должно составлять 2 г/кг/сут. Восполнять необходимо не только питательные вещества, но и жидкость путем инфузии различных растворов. На третьей стадии обязательно проводятся переливания препаратов крови (эритроцитов и плазмы, альбумина). Корректируется кислотно-щелочное состояние организма.
Для лечения инфекционных осложнений вводят антибиотики (согласно чувствительности). Также производится коррекция иммунного статуса, дисбактериоза. Лечение алиментарной комы заключается во введении раствора 40% глюкозы внутривенно до восстановления сознания или уровня глюкозы в крови; согревании, витамино- и гормонотерапии; купировании судорог. Во время и после окончания курса лечения такие больные требуют мощной психической и физической реабилитации, которая может длиться до полугода после выписки из стационара, поэтому лечение проводится совместно гастроэнтерологом и психотерапевтом.
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Лечение
Названия
Название: Прогрессирующая мышечная дистрофия Беккера.
Прогрессирующая мышечная дистрофия Беккера
Описание
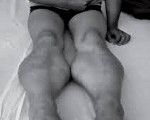
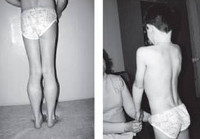
Прогрессирующая мышечная дистрофия Беккера. Вариант наследственной сцепленной с Х — хромосомой миодистрофии, отличающейся более замедленным и доброкачественным течением. Заболевание характеризуется постепенно усугубляющейся и распространяющейся мышечной слабостью, гипотонией и атрофией, первоначально возникающей в мышцах бедер и тазового пояса. Диагностический поиск включает неврологическое обследование, консультацию генетика и кардиолога, нейрофизиологическое тестирование нервно-мышечного аппарата, ДНК диагностику, биопсию мышц с морфологическим, иммунологическим и гистохимическим изучением полученных образцов. Лечение симптоматическое и, к сожалению, малоэффективное. Прогрессирование болезни приводит к потери больными способности самостоятельно передвигаться к возрасту 40 лет.
Дополнительные факты
Прогрессирующая мышечная дистрофия Беккера впервые была описана в 1955 г. Как доброкачественный вариант течения мышечной дистрофии Дюшенна. В последующем многочисленные исследования в области неврологии, генетики и биохимии обнаружили существенные отличия в характере течения, биохимической и морфологической основе этих заболеваний. В результате клиническая форма Беккера была выделена как самостоятельная нозология.
Мышечная дистрофия Беккера входит в группу миопатий (миодистрофий) — заболеваний, возникающих вследствие нарушений строения и метаболизма мышечной ткани и проявляющихся мышечной слабостью. Патология наследуется рецессивно сцеплено с Х-хромосомой, поэтому болеют только лица мужского пола. Частота встречаемости составляет 1 новорожденный на 20 тыс. Детей.
Прогрессирующая мышечная дистрофия Беккера
Причины
В основе заболевания лежит мутация в гене, ответственном за кодирование белка дистрофина. Примерно 30% от общего числа случаев мышечной дистрофии Беккера приходится на т. Н. «свежие» мутации. Ген располагается в 21 локусе (в регионе Хр21. 2–р21. 1) короткого плеча Х-хромосомы. Примерно у 65-70% больных обнаруживаются крупные делеции указанного участка, у 5% — дупликации, у остальных — точковые мутации. Указанные структурные перестройки гена не влекут за собой полного прекращения синтеза дистрофина, как при дистрофии Дюшенна, а потенцируют синтез аномального усеченного белка, в некоторой степени способного выполнять свои функции. Это и обуславливает более доброкачественный характер дистрофии Беккера в сравнении с вариантом Дюшенна.
В норме белок дистрофин поддерживает целостность сарколеммы — мембраны миоцитов (мышечных волокон), обеспечивает эластичность и устойчивость миофибрилл при мышечном сокращении. Неспособность аномального дистрофина адекватно выполнять эти функции приводит к нарушению целостности мембран мышечных волокон. В следствие этого происходят дегенеративные изменения цитоплазматических компонентов последних и повышенная транспортировка ионов калия внутрь миоцитов. Результатом таких биохимических и морфологических сдвигов является гибель миофибрилл и разрушение мышечных волокон. На месте погибших миоцитов происходит образование соединительной ткани, что обуславливает феномен псевдогипертрофии — увеличение объема и плотности мышцы при резком снижении ее сократительной способности.
Симптомы
Прогрессирующая мышечная дистрофия Беккера манифестирует обычно в период от 10 до 15 лет, в некоторых случаях раньше. Начальными признаками заболевания выступают чрезмерная утомляемость и мышечная слабость в тазовом поясе и нижних конечностях. У ряда пациентов первыми проявлениями являются периодические болезненные мышечные судороги (крампи), локализующиеся в ногах. Мышечная слабость обуславливает затруднение при подъеме по лестнице, при необходимости встать из положения сидя. Со временем формируется переваливающаяся «утиная» походка. Для того, чтобы встать, пациент вынужден использовать вспомогательные миопатические приемы — опираться руками о расположенные рядом предметы мебели или, при отсутствии таковых, использовать в качестве опоры собственное тело (симптом Говерса).
Как и другие наследственные миопатии, заболевание Беккера характеризуется симметрично развивающимися атрофиями мышц. В первую очередь поражаются мышцы бедра и тазового пояса, затем процесс распространяется на мускулатуру плечевого пояса и проксимальных мышц рук. В начале болезни формируются псевдогипертрофии, наиболее выраженные в икроножных, дельтовидных, трех- и четырехглавых мышцах. По мере прогрессирования миодистрофии они трансформируются в мышечные гипотрофии.
Слабость в руках. Слабость мышц (парез). Судороги.
Диагностика
Прогрессирующая мышечная дистрофия Беккера диагностируется неврологом на основании анамнеза, клинических данных, дополнительных обследований и генетического тестирования. В неврологическом статусе наблюдается снижение мышечной силы и умеренное снижение мышечного тонуса в проксимальных отделах конечностей, выпадение коленных рефлексов при симметричном снижении сухожильных рефлексов дистальных отделов ног и верхних конечностей, полная сохранность чувствительности.
Среди клинических анализов наибольшее значение имеет биохимический анализ крови, который выявляет многократное повышение уровня КФК. Данные электронейрографии позволяют исключить поражение нервных волокон, электромиография свидетельствует о первично-мышечном типе поражения. Биопсия мышц проводится только после отрицательных результатов генетического анализа. Морфологическое исследование полученного материала определяет диффузную разнокалиберность, дистрофические и некротические изменения мышечных волокон, разрастание соединительной ткани. Проводится специальное иммунное окрашивание образцов с последующим определением наличия в них дистрофина.
Подтвердить диагноз мышечной дистрофии Беккера позволяет консультация генетика с проведением анализа ДНК. Выявление дупликаций или делеций в гене Хр21 дает возможность установить точный диагноз. Отрицательный результат анализа ДНК не говорит об отсутствии патологии, поскольку могут иметь место точковые мутации, поиск которых представляет собой сложную и более дорогостоящую процедуру.
С целью выявления сердечной патологии назначается электрокардиография, Эхо-КГ, консультация кардиолога. Кардиологическое обследование может обнаружить нарушение внутрижелудочковой проводимости, АВ-блокаду, дилатацию желудочков, гипертрофические изменения миокарда, кардиомиопатию, сердечную недостаточность.
Дифференциальная диагностика
Дифференциальная диагностика проводится с прогрессирующей мышечной дистрофией Дрейфуса, миодистрофией Дюшена, мышечной дистрофией Эрба-Рота, метаболической миопатией, полимиозитом и дерматомиозитом, воспалительной миопатией, спинальной амиотрофией, наследственной полиневропатией.
Пренатальная диагностика рекомендована, когда мать является носителем патогенного гена. Если ребенок мужского пола, то вероятность развития заболевания у него составляет 50%. Биопсия хориона может проводиться в сроке 11-14 нед. Беременности, амниоцентез — после 15-й недели, забор пуповинной крови (кордоцентез) — на сроке больше 18 нед.
Лечение
На современном этапе несколькими группами ученых ведутся настойчивые исследования в области поиска эффективных методов лечения прогрессирующих миодистрофий. В настоящее время пациенты получают в основном метаболическую и симптоматическую терапию. Разработаны различные схемы лечения, позволяющие улучшить двигательные возможности больного и несколько замедлить прогрессирование болезни. Пациентам назначают актопротекторы (этилтиобензимидазол), неостигмин, АТФ, анаболические стероиды (метиландростендиол), сердечные средства. По вопросу длительной терапии глюкокортикоидами (преднизолоном) клиницисты имеют различные мнения. Одни считают, что подобное лечение тормозит прогрессирование миодистрофии, другие отвергают это предположение.
Наблюдения показали, что постельный режим усугубляет мышечную слабость. Поэтому пациентам рекомендуется умеренная физическая активность, занятия плаваньем. Поддержание мышечной эластичности и силы, а также профилактика контрактур проводится средствами массажа, физиотерапии и лечебной гимнастики. По показаниям проводится хирургическое лечение контрактур. Применение различных ортопедических средств (ходунков, инвалидных колясок, фиксаторов для ног, экзоскелетов) позволяет расширить двигательные возможности пациентов и их способность к самообслуживанию. По показаниям проводится хирургическое лечение контрактур.
Источник
