Диагноз мкб код g93
Содержание
- Описание
- Причины
- Патогенез
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: G93,5 Сдавление головного мозга.

Сдавление головного мозга гематомой
Описание
Сдавление головного мозга (син. Компрессия головного мозга) — сочетание признаков повышенного внутричерепного давления с очаговыми неврологическими симптомами, обусловленное наличием в полости черепа объемного образования (например, опухоли, гематомы). Сдавление (компрессия) головного мозга отмечается у 3-5% пострадавших.
Причины
Среди причин, вызывающих сдавление мозга, на первом месте стоят внутричерепные гематомы (эпи-, субдуральные, внутримозговые, внутрижелудочковые). Далее следуют вдавленные переломы костей черепа, очаги размозжения мозга, нарастающий отек-набухание головного мозга, острые субдуральные гидромы, возникающие в результате разрыва субарахноидальных цистерн, чаще — основания мозга, и быстрого накопления спинномозговой жидкости в субдуральном пространстве, пневмоцефалия воникновение воздуха в полость черепа, возникающее при переломе основания черепа (решетчатого лабиринта). В последнем случае образуется клапанный механизм, при чиханье, кашле, натуживании воздух нагнетается в полость черепа.
Патогенез
Сдавление головного мозга характеризуется жизненно опасным нарастанием через различный промежуток времени после травмы или непосредственно после нее общемозговых симптомов. Сдавление мозга характеризуется объемным скоплением жидкой или свернувшейся крови, спинномозговой жидкости или воздуха под оболочками. Это вызывает местное и общее сдавление вещества со смещением срединных структур мозга, деформацией и сжатием желудочков, ущемлением ствола.
Сдавление головы — особый вид травмы, возникающий в результате последовательного воздействия динамической (кратковременной) или статической (длительной) механической нагрузки.
Он характеризуется повреждениями мягких покровов головы, черепа и мозга. Более точным является термин «длительное сдавление головы» (минуты, часы, сутки) в отличие от менее значимого кратковременного сдавления головы (секунды).
Длительное сдавление головы встречается у пострадавших вследствие землетрясений, взрывов и обвалов в шахтах и рудниках. Для адекватной и однозначной оценки клинических форм черепно-мозговых травм необходимо правильно квалифицировать нарушения сознания.
Симптомы
Сдавление (компрессия) головного мозга характеризуется нарастанием через тот или иной промежуток времени после травмы либо непосредственно после нее общемозговых симптомов (появление или углубление нарушений сознания, усиление головной боли, повторная рвота, психомоторное возбуждение ), очаговых (появление или углубление гемипареза, одностороннего мидриаза, фокальных эпилептических припадков и ) и стволовых симптомов (появление или углубление брадикардии, повышение АД, ограничение взора вверх, тоничный спонтанный нистагм, двусторонние патологические знаки и ).
В зависимости от формы повреждения (сотрясение, ушиб мозга различной степени), на фоне которой развивается травматическое сдавление головного мозга, светлый промежуток перед нарастанием жизненно опасных проявлений может быть развернутым, стертым либо отсутствует.
Симптомы сдавления головного мозга без сопутствующего ушиба его в начальных стадиях протекает легче и имеет несколько отличную характеристику за счет более отчетливой динамики неврологической симптоматики, когда клинический синдром сдавления мозга развивается не остро в момент травмы, а развивается постепенно. В первый период после травмы наблюдаются клинические проявления, характерные для легкой черепно-мозговой травмы, затем на протяжении периода от нескольких часов или даже дней наблюдается относительное благополучие, после чего состояние и самочувствие вновь ухудшаются, может развиться потеря сознания, усиливается головная боль, развивается психомоторное возбуждение, усиливается астено-вегетативный синдром. По мере формирования внутричерепной гематомы и развития декомпенсации зти явления нарастают, за счет раздражения коры головного мозга нередко развивается эпилептический приступ, повторные рвоты, на стороне компрессии сужение (?) зрачка, замедление пульса. На этом фоне постепенно углубляются нарушения сознания и усили вается симптоматика очагового поражения мозга. В начальном периоде компрессии мозга отмечается тахипноэ, сменяющееся через несколько часов брадипноэ, вплоть до появления патологического дыхания за счет дислокационного синдрома. На вторые — третьи сутки при формировании внутричерепной гематомы на глазном дне могут быть выявлены признаки застоя дисков зрительных нервов, иногда больше на стороне компрессии. Более отчетливо определяются менингеальные симптомы. При несвоевременности оказания помощи развивается терминальное состояние, характеризующееся грубыми дислокационными явлениями с резким нарушением витальных функций. Виды внутричерепных гематом.
Виды внутричерепных гематом.
Эпидуральные гематомы чаще формируются при локальной травме на фоне легкого ушиба мозга пли ушиба средней тяжести.
Субдуральные и внутримозговые гематомы развиваются, как правило, на фоне ушиба мозга средней тяжести или тяжелого его ушиба.
Пневмоцефалия свидетельствует о переломе основания черепа.
Сдавления вдавленными переломами могут быть ограниченными и распространенными. Они возникают на фоне ушиба головного мозга средней тяжести или тяжелого его ушиба.
Сдавление головного мозга нарастающим отеком мозга, как правило, наблюдается при тяжелой черепно-мозговой травмы.
Внутричерепные гематомы бывают острыми (проявляющимися в течение первых 3 сут), подострыми (в течение 4-14 сут) и хроническими (через 2 нед после травмы). При хронической гематоме вокруг кровоизлияния формируется капсула.
Эпидуральная гематома. Травматическое кровоизлияние локализуется между внутренней поверхностью кости черепа и твердой мозговой оболочкой. Механизм травмы импрессионный.
Источниками кровотечения могут быть:
- средняя оболочечная артерия, проходящая в дупликатуре твердой мозговой оболочки. Разрыв артерии происходит в борозде на месте пересечения ее с линией перелома. Надрыв стенки сосуда может произойти и в результате деформации кости;
- оболочечные вены, синусы, вены диплоэ.
Эпидуральные гематомы характеризуются триадой симптомов:
1. Наличием светлого промежутка;
2. Мидриазом и птозом на стороне гематомы;
3. Пирамидной недостаточностью преимущественно.
Основным признаком нарастания внутричерепного давления является углубление степени нарушения сознания (вялость, оглушение, психомоторное возбуждение, сопор и кома в поздней стадии).
Появляются вегетативные нарушения, обусловленные нарастанием внутричерепного давления и гипоксией мозга — изменение пульса, артериального давления, расстройства дыхания. Оно учащается, а в стадии декомпенсации — угнетается, появляются поверхностное дыхание и периодическое дыхание по типу Чейна-Стокса и.
Вследствие повышения внутричерепного давления и дислокации ствола рефлекторно возбуждаются ядра блуждающего нерва — появляется брадикардия. Пульс урежается до 50 — 60 в 1 мин, как правило, он напряженный, хорошего наполнения.
Постоянный уровень кровотока в условиях повышения внутричерепного давления и гипоксии мозга поддерживается за счет рефлекса Кушинга (повышение артериального давления на 20-30 мм и более).
При дальнейшем нарастании гематомы, распространении отека и набухания мозга смещаются и ущемляются стволовые образования (височно-тенториальное, позже — затылочно-дуральное вклинения).
Развиваются мезенцефально-стволовые симптомы: мидриаз, отсутствие реакции зрачка на свет, парез взора кверху, симптом Гертвига — Мажанди. Могут быть горметонические судороги, тонус мышц иногда повышается до степени децеребрационной ригидности, появляется тетрапарез. Среднемозговой синдром развивается чаще всего вследствие височно-тенториального вклинения, дислокации и ущемления ствола мозга в отверстие мозжечкового намета. При дальнейшей дислокации появляются «плавающие» движения глазных яблок, развиваются кома, тонические судороги, нарастают нарушения дыхания и гемодинамики, наблюдается гипертермия.
В дальнейшем снижаются мышечный тонус, дыхательная и сердечно-сосудистая деятельность, пульс становится частым и слабым, артериальное давление снижается, что свидетельствует об ущемлении ствола в большом затылочном отверстии (аксиальное смещение ствола).
Диагностика эпидуральных гематом на догоспитальном этапе основывается на выяснении таких факторов:
1. Механизма травмы;
2. Динамики неврологической симптоматики- общемозговой и очаговой, нарушения сознания и вегетативных функций — пульса, артериального давления, дыхания;
3. Обнаружения боли при перкуссии черепа;
4. Анталгической позы (больной лежит на стороне гематомы);
5. Наличия менингеальных симптомов;
6. Наличия перелома костей свода черепа, пересекающего борозды оболочечных сосудов;
7. Припухлости по ходу переломов в височной области.
Данные компьютерной и магнитно-резонансной томографии, а также каротидной ангиографии подтверждают диагноз.
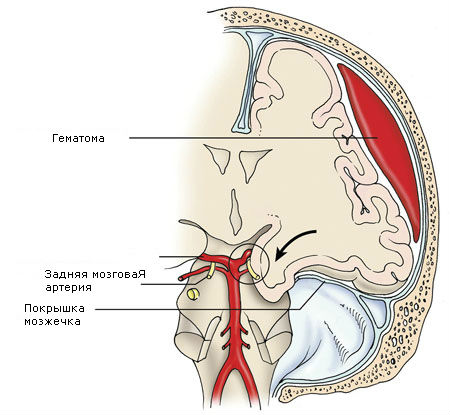
Гематомы задней черепной ямки бывают редко и обычно образуются при тяжелой травме задних отделов головы.
Местом приложения травмирующего агента чаще бывает шейно-затылочная область, где и определяется перелом затылочной кости.
Объем гематом обычно небольшой (до 30 мл) из-за малых размеров субтенториального пространства.
Рано возникают окклюзионная гидроцефалия, стволовые нарушения.
Источником эпидуральных гематом часто является венозное кровотечение из поперечного синуса, что обусловливает подострое течение гематом. Нередко они имеют супратенториальное распространение.
Для эпидуральных гематом задней черепной ямки характерны следующие клинические признаки:
1. Отек и уплотнение мягких тканей в шейно-затылочной области. При краниографии выявляют перелом затылочной кости.
2. Локальная боль в шейно-затылочной области, которая резко усиливается при перемене положения головы.
3. Тенденция к фиксированному положению головы: больной, как правило, лежит на стороне гематомы.
4. Отчетливая ригидность мышц затылка.
5. Синдром компрессии головного мозга носит окклюзионный характер: усиление головной боли в шейно-затылочной области, при попытке изменить положение головы или тела появляются головокружение, рвота, усиливается головная боль.
6. Очаговая симптоматика указывает на поражение мозжечка и ствола мозга: гипотония мышц конечностей, нарушения координации, спонтанный нистагм, бульбарные расстройства, пирамидная симптоматика. При этом на стороне гематомы может быть более выражена мозжечковая патология, а на противоположной — мягкая пирамидная симптоматика.
Светлый промежуток длится несколько десятков минут, чаще стертый. После потери сознания развивается сопор, сменяющийся через несколько часов или суток оглушением и комой.
Субдуральные гематомы задней черепной ямки возникают при тяжелом ушибе мозга. Повреждений костей черепа может не быть. Образование субдуральных гематом связано с повреждением поперечного или сигмовидного синуса, а также вен, впадающих в эти синусы, или с повреждением корковых сосудов мозжечка.
Клиническая картина вариабельна. Развиваются выраженные общемозговые симптомы: вторичное нарушение сознания после светлого промежутка, головная боль, рвота. Повышается внутричерепное давление. Появляются очаговые симптомы, в частности мозжечково-стволовые нарушения — мышечная гипотония, атаксия, нистагм, бульбарная симптоматика, угнетение роговичных рефлексов и.
Субдуральные гематомы — скопление крови между твердой мозговой и арахноидальной оболочками. Субдуральные гематомы развиваются при черепно-мозговой травме различной степени тяжести.
Острые субдуральные гематомы проявляются в первые 3 сут после травмы. Они формируются на месте тяжелого ушиба мозга, возникают при травме ускорения и ротационной травме, ведущих к разрыву сосудов.
Подострые и особенно хронические субдуральные гематомы развиваются при среднетяжелой или легкой черепно-мозговой травме.
В отличие от эпидуральных, субдуральные гематомы возникают не только на стороне приложения травмирующего агента, но и на противоположной.
Местом приложения травмирующего агента чаще всего являются затылочная, лобная и сагиттальная области.
Объем субдуральных гематом составляет 80-150 мл. Они свободно растекаются по субдуральному пространству (над 2-3 долями мозга), вызывают выраженный отек мозга.
Источниками кровотечения являются вены, впадающие в верхний сагиттальный синус («мостовые» вены). Возможны кровотечения из синуса, из поврежденных корковых артерий, а также разрыв сосудов твердой мозговой оболочки, разрывы при травме артериальных и артериовенозных аневризм.
При острых субдуральных гематомах светлый промежуток бывает стертым или вообще отсутствует. Характерно прогрессирующее ухудшение общего состояния больного. Общемозговые (головная боль, тошнота, рвота, нарушение сознания) и очаговые симптомы (анизокория, пирамидная недостаточность, судороги) нарастают на фоне вегетативных нарушений. Брадикардия и артериальная гипертензия сменяются тахикардией и артериальной гипотензией, тахипноэ — патологическими типами дыхания.
Подострые субдуральные гематомы проявляются на 4 — 14-е сутки после черепно-мозговой травмы. Их следует дифференцировать с сотрясением или ушибом головного мозга, а иногда и с такими заболеваниями, как грипп, менингит, субарахноидальное кровоизлияние, алкогольная интоксикация.
Для подострых субдуральных гематом характерна трехфазность изменения сознания. Длительность первичной потери сознания от нескольких минут до часа, затем наступает светлый промежуток. Сознание ясное, либо имеется умеренное оглушение. Функции жизненно важных органов не нарушены, могут отмечаться легкая артериальная гипертензия и брадикардия. Неврологическая симптоматика нередко минимальная.
Могут наблюдаться изменения психики — дезориентировка во времени, эйфория, неадекватность поведения, психомоторное возбуждение.
Основная жалоба — головная боль. Если страдает доминантное полушарие, то могут наблюдаться речевые нарушения.
Подострая гематома нередко манифестирует очаговыми судорогами на противоположной стороне.
При нарастании гематомы появляются рвота, повышается артериального давления, замедляется пульс. Развиваются гомолатеральный мидриаз и пирамидная недостаточность на противоположной стороне. На глазном дне выявляют застойные явления, которые вначале появляются на стороне гематомы.
Диагностика
Учитывают наличие следующих моментов:
1. Первичное нарушение в момент травмы;
2. Светлый промежуток;
3. Повторное компрессионное выключение сознания.
При тяжелых повреждениях мозга светлый промежуток отсутствует или стертый. Следует учитывать биомеханику черепно-мозговой травмы (травма ускорения или ротационная травма), общемозговую симптоматику, которая доминирует над очаговой, и данные дополнительных методов исследования.
Лечение
Всем больным с клиническими признаками сдавления головного мозга, а так же при выявлении этого сдавления на КТ или МРТ у тяжелых больных показана срочная операция — удаление гематомы.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Лечение
- Прогноз
Названия
Название: G93,7 Синдром Рейе.
Предполагаемые механизмы нарушения b-окисления липидов при синдроме Рея
Описание
Синдром Рея. Быстро прогрессирующая, жизненно угрожающая острая энцефалопатия, сочетающаяся с поражением печени и в классическом варианте обусловленная приемом ацетилсалициловой кислоты на фоне вирусного инфекционного заболевания. Манифестирует внезапной рвотой, затем возникает психомоторное возбуждение, сменяющееся апатией, заторможенностью, дезориентацией с переходом в кому. Диагностируется по клиническим данным с учетом анамнеза, результатов биохимического и клинического анализов крови, исследования ликвора, УЗИ брюшной полости, коагулограммы, пункционной биопсии печени. Основу лечения составляет интенсивная терапия гемодинамических, коагуляционных, дыхательных нарушений и отека мозга. Чем ранее начато лечение, тем больше надежд на благоприятный исход.
Дополнительные факты
Синдром Рея (белая печеночная болезнь, синдром Рейе) — острая быстро прогрессирующая энцефалопатия, возникающая у детей до 16-летнего возраста. Единичные случаи описаны у взрослых. Впервые полное изложение клиники синдрома дал в 1963 г. Австралийский патологоанатом Reye, после чего заболевание стало носить его имя и было признано самостоятельной нозологией. Первоначально специалистами в области неврологии и педиатрии синдром Рея ассоциировался только со случаями острой энцефалопатии, возникающей после приема аспирина на фоне вирусной инфекции. Позже были описаны т. Н. Рея-подобные заболевания. В связи с этим в настоящее время классифицируют аспирин-ассоциированный, или классический синдром Рея и атипичный синдром Рея, включающий Рея-подобные синдромы.
Наиболее часто синдром встречается среди детей в возрасте от 5 до 14 лет, не зависимо от пола ребенка. Заболеваемость варьирует: в Великобритании у детей до 18 лет она составляет 0,1 случай на 100 тыс. , в США — 1 случай на 100 тыс. В 80-е годы отмечалось существенное снижение заболеваемости после введения ограничений на применение аспирина у детей.
Причины
Этиопатогенез синдрома до конца не исследован. Классический синдром Рея развивается в результате приема в качестве антипиретиков препаратов салициловой кислоты детьми, заболевшими ОРВИ и другими вирусными инфекциями (чаще гриппом, ветряной оспой, герпесом, парагриппом). Следует подчеркнуть, что речь идет не о передозировке салицилатов, а об их приеме в пределах рекомендованных возрастных дозировок. Этиофакторами Рея-подобных синдромов могут выступать другие медикаменты, гипоглицин, вальпроат, эндотоксины бактерий, инсектициды и прочие вещества, действующие как митохондриальные яды. По данным проведенных в Великобритании исследований, в 10% случаев синдром Рея сопровождался врожденными метаболическими нарушениями (дисметаболизмом жирных кислот, дефицитом карнитинтрансферазы, нарушениями в цикле мочевины, недостатком глицеринкиназы и тд ).
Главным патогенетическим субстратом синдрома Рея является расстройство функционирования митохондрий, приводящее к клеточному апоптозу (гибели). Триггерами митохондриальных нарушений могут выступать различные экзогенные (медикаменты и тд вещества) и эндогенные (дисметаболические расстройства) факторы. Высказано предположение о том, что синдром Рея возникает у детей, имеющих врожденную субклиническую недостаточность митохондриальных ферментов. Известно, что после всасывания салицилатов и тд веществ их метаболиты попадают в печень, где оказывают токсическое воздействие на митохондрии. Результатом является апоптоз гепатоцитов, жировая инфильтрация печени и нарушение ее детоксикационной функции. Это сопровождается резким повышением концентрации печеночных трансаминаз и аммиака в крови, в несколько раз превышающей норму. Указанные метаболиты оказывают токсическое действие на церебральные ткани, приводя к развитию быстро прогрессирующей токсической энцефалопатии и отеку головного мозга.
Морфологически синдром Рея характеризуется мелко-капельным жировым гепатозом, имеющим распространенный характер и особенно проявленным по периферии печеночных долек. Выраженная в более легкой степени жировая дистрофия наблюдается в других соматических органах: поджелудочной железе, сердечной мышце, эпителии почечных канальцев. В церебральных тканях отмечаются дегенеративные изменения нейронов и отек астроцитов.
Симптомы
Классический синдром Рея в среднем манифестирует через 3 суток после перенесенной вирусной инфекции, хотя этот период может колебаться от 12 ч до 21 дня. При ветряной оспе дебют синдрома приходится на 4-5 день сыпи. Обязательным симптомом является рвота. Как правило, она носит многократный характер. Через 24-48 ч после начала рвоты отмечаются изменения в поведении ребенка, варьирующие от раздражительности и необычного возбуждения до заторможенности и сонливости. Ребенок перестает разговаривать, не хочет есть и пить, контакт с ним затруднен. Достаточно быстро больной перестает ориентироваться в окружающей обстановке и во времени, возникает делирий. Эти состояния сопровождаются гипервентиляцией. Затем ребенок впадает в кому, которая вначале имеет интермиттирующий тип и продолжается не более 3 ч, а потом может длиться от 1-4 суток до нескольких недель. В последней стадии синдрома возникает остановка дыхания.
Диагностика
Заподозрить синдром Рея педиатру или неврологу позволяют выявление в анамнезе связи с вирусной инфекцией, приемом аспирина и других источников митохондриальных токсинов, типичная клиника заболевания (рвота с последующими психо-неврологическими нарушениями), увеличение печени. Верифицировать синдром Рея помогает биохимический анализ крови с определением уровня печеночных ферментов, УЗИ брюшной полости, биопсия печени, исследование ликвора.
Биохимия крови констатирует увеличение АСТ и АЛТ в 3 и более раз (в ряде случаев в 20 раз) при нормальном содержании билирубина. Патогномоничным признаком является резкое повышение уровня аммиака. У 40% заболевших наблюдается гипогликемия, как правило, это дети до 5-летнего возраста. Концентрация электролитов крови может изменяться соответственно степени дегидратации, развивающейся вследствие рвоты и отказа от питья. В большинстве случаев синдром Рея сопровождается нарушением свертывающей системы, что находит отражение в данных коагулограммы. Клинический анализ крови остается в пределах нормы, иногда наблюдается некоторое увеличение лейкоцитов.
С целью исключения инфекционной патологии ЦНС проводится люмбальная пункция. Исследование цереброспинальной жидкости свидетельствует о ее стерильности и не выявляет существенных отклонений в ее составе, что позволяет исключить инфекционно-воспалительный характер энцефалопатии. УЗИ органов брюшной полости определяет увеличение печени — гепатомегалию, ее диффузно повышенную эхогенность и структурную уплотненность; возможны подобные изменения поджелудочной железы. Если синдром Рея не может быть установлен по данным вышеперечисленных методов диагностики, проводится биопсия печени. Морфологическое исследование биоптатов выявляет типичную для синдрома картину: отсутствие воспалительных изменений и наличие признаков выраженной жировой дистрофии.
Синдром Рея является диагнозом исключения.
Дифференциальная диагностика
Дифференциальная диагностика проводится с вирусными инфекциями, энцефалитом, менингитом, различными интоксикационными синдромами, субарахноидальным кровоизлиянием и пр. После выздоровления дети, перенесшие синдром, направляются на консультацию генетика для исключения наличия у них врожденных метаболических заболеваний.
Лечение
Подозрение на синдром Рея является показанием к срочной госпитализации в отделение интенсивной терапии. Лечение является скорее симптоматическим и направлено на купирование происходящих в организме патологических процессов и поддержание жизненно важных органов. Применяют кортикостероиды (в основном преднизолон), инфузии электролитов и витамина К, маннитол для купирования отека мозга. Внутривенное введение жидкости с одной стороны необходимо для скорейшего выведения аммиака и прочих токсических веществ из организма, а с другой стороны ограниченно из-за опасности прогрессирования церебрального отека. Осуществляется коррекция нарушений кровообращения и расстройств гемостаза. При дыхательных нарушениях производят интубацию трахеи с гипервентиляцией. Лечение осуществляется при постоянном мониторинге артериального давления, газового состава крови, внутричерепного давления.
Смертность на начальной стадии синдрома составляет 5%, в стадии интермиттирующей комы — 50-60% , на последней стадии — 95%. Причиной летального исхода обычно выступает отек мозга, реже — дыхательная недостаточность, желудочное кровотечение вследствие коагулопатии, сердечная недостаточность, сепсис или ОПН. Если синдром Рея распознан в ранней стадии и незамедлительно начата соответствующая терапия, то можно надеяться на благополучный исход. Благодаря совершенствованию методов диагностики и лечения показатель летальности удалось снизить с 40%, регистрируемых в 1970-х гг. До 20% в 1990-х гг. У выживших детей, как правило, отмечается полное нейро-психическое восстановление.
Прогноз
Предупредить возникновение синдрома позволяет отказ от применения салицилатов у детей. В настоящее время во многих странах проводится политика замены салицилатов препаратами парацетамола или ибупрофена при необходимости проведения антипиретической терапии.
Источник
