Дефицит протеина с код по мкб 10
Связанные заболевания и их лечение
Описания заболеваний
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Дефицит протеина С.

Нарушения в системе протеина С
Описание
Протеин С — естественный антикоагулянт, зависимый от витамина К гликопротеин, синтезируется в печени в неактивной форме.
Активированный протеин С — сериновая протеаза, функция которой направлена на инактивацию факторов Va и VIIIa, важный регулятор активности тромбина на поверхности эндотелия. Протеин С активируется при взаимодействии тромбина с тромбомодулином. Эта связь ускоряет образование тромбина в форму активированного протеина С. Активность протеина С усиливается его кофактором — протеином S. Активированный протеин С протеолитически инактивирует факторы Va и VIIIa в присутствии протеина S, фосфолипида (поверхность эндотелия) и кальция, ингибируя дальнейшую активацию тромбина.
В норме уровень протеина С составляет 65–145%. При беременности он несколько повышается и составляет 70–150%, еще больше он повышается в послеродовом периоде.
Симптомы
- привычная потеря беременности, мертворождения, плодовые потери (до 27,9%);
- венозные тромбозы и тромбоэмболии в возрасте 20–30 лет любых локализаций;
- некрозы кожи, подкожной клетчатки (особенно при лечении непрямыми антикоагулянтами);
- повышение риска тромбозов при применении оральных контрацептивов;
- практическое отсутствие артериальных тромбозов.
Причины
Врожденный дефицит протеина С обусловлен мутацией гена. Ген протеина С расположен на хромосоме 2. Известно более 150 мутаций гена. Очень часто дефицит протеина С сочетается с мутацией фактора V.
Дефицит протеина С встречают несколько чаще, чем дефицит антитромбина III, среди больных с тромбозами и тромбоэмболиями эту патологию отмечают примерно у 10% больных.
Дефицит протеина С наследуется аутосомно-доминантно. Уровень протеина С у гетерозиготных носителей равен 30–60% от нормы, гомозиготные практически не имеют протеина С и погибают внутриутробно или сразу после рождения.
Наследственный дефицит протеина С может быть 2 типов:
• I тип — снижение количества протеина С;
• II тип — снижение активности протеина С при его нормальном уровне.
Лечение
Больные с гетерозиготным дефицитом протеина С при острых тромбозах должны получатьгепарин , а позднее — переходить на непрямыеантикоагулянты. При этом, однако, следует помнить, что непрямые антикоагулянты могут снизить уровень не толькофактора II ,фактора VII ,фактора IX ифактора X , но и протеина С , что сведет на нет его антитромботическое действие. Учитывая при этом тот факт, что дефицит протеина С предрасполагает к развитиюварфариновых некрозов кожи.
При гомозиготном дефиците протеина С для профилактики тромбозов и ДВС-синдрома вместо непрямых антикоагулянтов используются периодические переливания плазмы.
Основные медуслуги по стандартам лечения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Рубрика МКБ-10: D68.5
МКБ-10 / D50-D89 КЛАСС III Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм / D65-D69 Нарушения свертываемости крови, пурпура и другие геморрагические состояния / D68 Другие нарушения свертываемости
Определение и общие сведения[править]
Наследственная тромбофилия из-за врожденного дефицита белка S
Врожденный дефицит белка S является наследственным нарушением свертывания крови, характеризуется повторяющимися венозными тромбозами в связи со снижением уровня синтеза и/или активности белка S.
Распространенность частичного дефицита белка S (гетерозиготные особи) оценивается в 0.16-0.21% в общей популяции. Распространенность полного дефицита белка S (гомозиготные или компаундные гетерозиготные особи) неизвестна, но, вероятно, сопоставима с острым дефицитом белка С, которая оценивается на уровне 1 / 500,000. Мужчины и женщины в равной степени подвержены заболеванию.
Передача аутосомно-рецессивная.
Этиология и патогенез[править]
Дефицит белка S вызывается мутациями гена PROS1 (3К11-q11.2).
Клинические проявления[править]
При тяжелом дефиците белка S, болезнь проявляется в течение от нескольких часов до дней после рождения развитием молниеносной пурпуры или массивного венозного тромбоза. Молниеносная пурпура является опасным для жизни состоянием выраженной повышенной свертываемости во всем организме и вызывает некроз тканей. Тяжелая ретинопатия недоношенных также может развиваться у пациентов. Гетерозиготные пациенты, как правило, бессимптомны до взрослой жизни. Эпизоды тромбозов в основном вызываются действием факторов риска, такими как хирургическое вмешательство, беременность или длительная иммобилизация. Тромбоз глубоких вен нижних конечностей с или без легочной эмболии является наиболее распространенным проявлением заболевания. Артериальный тромбоз также может наблюдаться.
Первичная тромбофилия: Диагностика[править]
Диагноз основан на измерении уровней антигеннов белка S (содержание общего белка S или свободного белка S) и его антикоагулянтной активности. Существуют три биологические формы дефицита: тип I и тип III являются количественными дефицитами с низким содержанием уровня свободного антигена (нормальный уровень общего количества протеина S при типе III и сниженном уровне общего белка S при I типа дефицита). Тип II представляет собой качественный дефицит с нормальными уровнями общего и свободного белка S. Молекулярное тестирование доступно, но не является необходимым для постановки диагноза.
Дородовая диагностика возможна с помощью идентификации причинной мутации ДНК, полученной с помощью анализа ворсин хориона.
Дифференциальный диагноз[править]
Дифференциальный диагноз включает другие наследственные тромбофилии включая дефицит антитромбина и протеина С.
Первичная тромбофилия: Лечение[править]
Введение свежезамороженной плазмы может потребоваться для лечения неонатальной молниеносной пурпуры. Хирургическое вмешательство может потребоваться для удаления тромботических поражений. У пациентов с тромбозом используют антикоагулянты (гепарин, варфарин). Следует обратить внимание на риск кумарин-индуцированного некроза кожи. Профилактическое лечение в течение перипартального или периоперационного периодов показано в случаях семейной истории тяжелых тромботических заболеваний.
Прогноз
Прогноз неблагоприятный у гомозиготных или компаундных гетерозиготных пациентов. Прогноз благоприятный для гетерозиготных пациентов. При адекватной терапии и мониторинге, риск тромбоэмболических заболеваний заметно снижается. Смертность может быть результатом эмболии легочной артерии.
Профилактика[править]
Прочее[править]
Дефицит антитромбина ІІІ
Определение и общие сведения
Антитромбин III — эндогенный антикоагулянт, на долю которого приходится 75% всей антикоагулянтной активности плазмы, гликопротеин с молекулярной массой 58 200 и содержанием в плазме 125-150 мг/мл. Первичная структура антитромбина III состоит из 432 аминокислот. Он блокирует протромбиназу — инактивирует факторы ХПа, XIa, Xa, IXa, VIIIa, калликреин и тромбин.
В присутствии гепарина активность антитромбина III увеличивается более чем в 2000 раз.
Этиология и патогенез
Дефицит антитромбина III наследуется аутосомно-доминантно. Большинство носителей этой патологии гетерозиготы, гомозиготы погибают очень рано от тромбоэмболических осложнений.
В настоящее время описано до 80 мутаций гена, расположенного на длинном плече хромосомы 1. Частота этой патологии сильно отличается у разных этнических групп.
У европейского населения частота дефицита антитромбина III составляет 1:2000-1:5000; по некоторым данным, — 0,3% в популяции. Среди больных с тромбоэмболическими осложнениями частота дефицита антитромбина III составляет 3-8%.
Различают два типа наследственного дефицита антитромбина III:
— I тип — снижение синтеза антитромбина III как следствие мутации гена;
— II тип — снижение функциональной активности антитромбина III при его нормальной продукции.
Клинические проявления
— тромбозы глубоких вен ног, илеофеморальные тромбозы (артериальные тромбозы не характерны для этой патологии);
— привычное невынашивание беременности;
— антенатальная гибель плода;
— тромбофилические осложнения после приема пероральных контрацептивов.
Диагностика
Функциональную активность антитромбина III определяют по способности образца плазмы ингибировать известное количество тромбина или фактора Ха, добавленного к образцу в присутствии или отсутствии гепарина.
При низкой активности антитромбина III основные тесты коагуляции не изменены, тесты на фибринолиз и время кровотечения нормальные, агрегация тромбоцитов в пределах нормы. При гепаринотерапии нет характерного адекватного увеличения АЧТВ (активированное частичное тромбиновое время).
В норме уровень антитромбина III составляет 85-110%. При беременности он несколько снижен и составляет 75-100%. Нижняя граница концентрации антитромбина III изменчива, поэтому необходимо учитывать не только уровень, но и клиническую ситуацию. Однако при снижении уровня антитромбина III ниже 30% пациентки погибают от тромбозов.
Лечение
Основу лечения дефицита антитромбина III составляют противотромботические средства. При наличии симптомов тромбофилии лечение абсолютно необходимо. Для этих целей используют свежезамороженную плазму (как источник антитромбина III), низкомолекулярные гепарины (эноксапарин натрия, надропарин кальция, далтепарин натрия).
При низком уровне антитромбина III гепарин натрия не применяют, так как возможны гепаринорезистентность и гепарин-индуцированные тромбозы.
При беременности препараты выбора — низкомолекулярные гепарины (НМГ), дозы их подбирают индивидуально под контролем гемостазиограммы. Критическими признают II и III триместры беременности, когда растет коагуляционный потенциал крови, а уровень антитромбина III снижается.
Вне беременности пациенткам может быть рекомендован длительный прием антагонистов витамина К (варфарин).
Источники (ссылки)[править]
https://www.orpha.net
Акушерство [Электронный ресурс] : национальное руководство / под ред. Г. М. Савельевой, Г. Т. Сухих, В. Н. Серова, В. Е. Радзинского. — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2015. — (Серия «Национальные руководства»). — https://www.rosmedlib.ru/book/ISBN9785970433652.html
Дополнительная литература (рекомендуемая)[править]
Источник
Содержание
- Описание
- Характеристика
- Классификация
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Тромбофилия.

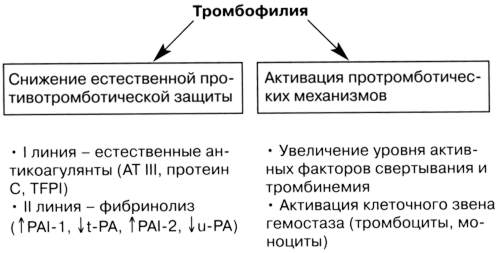
Патогенез тромбофилии
Описание
Тромбофилия является состоянием, при котором кровь имеет повышенную склонность к образованию тромбов. Сгустки крови могут вызвать проблемы, такие как тромбоз глубоких вен (ТГВ) и легочная эмболия (ЛЭ). Существуют различные типы тромбофилии, которые подразделяются на наследственные и приобретенные. Часто тромбофилия протекает мягко, и многие люди с тромбофилией не имеют проблем со здоровьем. Анализы крови могут диагностировать проблему. Тромбофилия не всегда требует лечения, но некоторые люди должны принимать аспирин или варфарин.
Характеристика
В организме существует естественный процесс свертывания в крови, который нарушается при тромбофилии.
Процесс нормальной свертываемостикрови называется гемостазом. Гемостаз помогает остановить кровотечение в случае травмы или другого патологического состояния. Когда кровеносный сосуд получает травму, срабатывает процесс свертывания крови. Это цепная реакция различных химических веществ в крови, которые называются факторами свертывания. Свертывание крови способствует образованию сгустка (тромба), который прилипает к поврежденной части кровеносного сосуду. Формированию сгустка также способствуют свойства тромбоцитов.
В крови есть также природные химические вещества, которые действуют против свертывания системы, чтобы остановить чрезмерное свертывание крови.
Тромбофилия происходит, если нормальный баланс свертывающей системы нарушен. В крови может быть слишком много факторов свертываемости крови, или слишком мало веществ, которые выступают против свертывания крови.
Тромбофилия может вызвать нежелательные сгустки крови. Это не значит, что у каждого человека с тромбофилией формируются тромбы. Но это означает, что у пациента есть более высокий риск тромбообразования, чем у остальной популяции.
Классификация
Наследственные тромбофилии.
1. Фактор V Лейдена. Довольно часто эта патология встречается у людей европейского происхождения, и примерно 1 из 20 европейцев являются носителями фактора V Лейдена. Этот ген влияет на часть V фактора свертывания, что делает процесс свертывания более длительным. При этом повышается риск развития тромбов в венах примерно в восемь раз, что все еще является относительно низким риском, поэтому у большинства людей с фактором V Лейдена не развиваются осложнения. Некоторые люди наследуют два фактора V Лейдена — один ген от каждого родителя (известный как «гомозиготных фактор V Лейдена). Это состояние менее распространенное, но при нем риск осложнений гораздо выше (риск тромбообразования увеличивается в 80 раз).
2. Дефицит протеина С. Белок С является природным химическим антикоагулянтом в крови. Дефицит может быть генетическим, или в силу других условий, таких как болезни почек. Для определения риска при этой патологии следует установить, были ли случаи тромбообразования у близких родственников. Если ребенок наследует два гена с дефицитом протеина С (по одному от каждого родителя, что бывает очень редко), он будет иметь более серьезные проблемы. Возможно тромбообразование уже вскоре после рождения(состояние, называемое пурпура Fulminans). Это состояние лечится концентратом протеина С и антикоагулянтами.
3. Дефицит протеина S. Белок S также является естественным химическим антикоагулянтом в крови. Дефицит протеина S развивается редко. Риск формирования кровяного сгустка колеблется в различных семьях.
4. Дефицит антитромбина. Антитромбин — еще одинестественный антикоагулянт крови. Существуют различные типы дефицита антитромбина: наследственный и приобретенный. Наследственная форма встречается редко, и выявляется примерно у 1 из 2000 человек.
Риск возникновения тромбов колеблется, но может быть увеличен в 25-50 раз по сравнению с остальной популяцией. При этой патологии сгусток крови может формироваться не только в ногах и легких, а также в венах рук, кишечника, мозг или печени. Примерно 1 из 2 человек с дефицитом антитромбина тромб формируется в возрасте до 30 лет, но другие могут дожить до старости без проблем.
При дефиците антитромбина рекомендован долгосрочный прием варфарина. Кроме того, может быть назначено лечение концентратом антитромбина, когда есть более высокий риск возникновения тромбов — например, если у пациента планируется операция.
При беременности, лечение антикоагулянтами, как правило, необходимо. Концентрат антитромбина также может быть использован.
5. Дисфибриногенемия. Это редкий генетический дефект, при котором нарушается нормальная функция фибрина. При этом может быть увеличено свертывание крови и/или повышенная кровоточивость.
6. Комбинированные наследственные тромбофилии. Некоторые люди наследуют более одного гена тромбофилии. При комбинированной тромбофилии риск развития тромбов умножается.
Приобретенные тромбофилии.
Приобретенные тромбофилии не наследуются, и обычно начинается в зрелом возрасте.
1. Антифосфолипидный синдром.
Этот синдром также известен как синдром Хьюза. Он обусловлен антифосфолипидными антителами. APS, как иногда называют антифосфолипидный синдром для краткости, может стать причиной кровяных сгустков в артериях и мелких кровеносных сосудов, а также в венах.
APS может повлиять на беременность в некоторых случаях. Многие женщины с APS не имеют проблем во время беременности. Тем не менее, APS может привести к выкидышу или другим проблемам — ограничение роста плода, преэклампсии или, реже, гибели плода. Эти проблемы могут быть уменьшены путем профилактики.
APS можно лечить с помощью низких доз аспирина. Если у пациентки уже был тромб, то, как правило, рекомендуется варфарин.
Смешанные тромбофилии.
Они обусловлены как генетическими, так и не генетическими причинами.
1. Гипергомоцистеинемия. При этой патологии наблюдается повышенный уровень химического вещества, называемого гомоцистеин, в крови, который, как считается, увеличивает риск артериальных и венозных тромбов, потому что гомоцистеин повреждает кровеносные сосуды. Для лечения назначают витамин В12 и фолиевую кислоту.
2. Пароксизмальная ночная гемоглобинурия. Это редкое состояние, влияющее на костный мозг. Оно может привести к сгусткам венозной крови, часто в необычных местах, таких как вены кишечника, печени или головного мозга.
3. Повышенный фактор VIII. Эта патология связана с аномально высоким уровни фактора VIII, который является одним из естественных факторов свертывания крови. При повышении фактора 8 риск тромбообразования увеличивается примерно в 6 раз.
Симптомы
Даже если пациент страдает тромбофилией, у него могут не наблюдаться никакие симптомы. У многих людей с тромбофилией не формируются тромбы.
Однако, если возникает тромб, появляются характерные симптомы. Тромбы могут образовываться в артериях и венах. Артерии кровеносные сосуды принимают кровь от сердца к органам и тканям тела. Венами являются кровеносные сосуды, приносящие кровь обратно к сердцу, от других частей тела.
Тромб в вене является наиболее распространенной проблемой при тромбофилии. Это состояние называется венозным тромбозом.
Возможные симптомы:
1. Боль и отек ног. Эти симптомы возникают при тромбозе глубоких вен.
2. Тромб может добраться до сердца и легких, что приводит к легочной эмболии. Возможные симптомы включают в себя боли в груди, боли при глубоком вдохе, одышку или, реже, коллапс.
3. Некоторые виды тромбофилии могут вызвать кровяной сгусток в необычном месте, например, в головном мозге, кишечнике или печени. Это может вызвать симптомы боли живот, цефалгии. Тромбоз в венах печени называется синдромом Бадда-Киари.
Тромб в артерии может наблюдаться при некоторых типах тромбофилии. Это состояние называется артериальным тромбозом. В зависимости от пораженной артерии тромб может вызвать инсульт, сердечный приступ или проблемы с плацентой во время беременности. Таким образом, возможные симптомы артериальных тромбозов из-за тромбофилии являются:
1. Инсульт в сравнительно молодом возрасте.
2. Повторные выкидыши.
3. Осложнения беременности: преэклампсия, снижение роста плода или, реже, внутриутробная гибель плода.
Тромбоцитоз.
Диагностика
Тромбофилию можно заподозрить, если кровный родственник страдал тромбозом в молодом возрасте (до 40 лет), или, если развивается тромбоз, который не стал неожиданностью, учитывая возраст и общее состояние здоровья пациента.
Тромбофилия диагностируется по анализам крови.
Обследование проводится через несколько недель или месяцев после эпизода тромбоза глубоких вен или легочной эмболии, так как наличие этой патологии может повлиять на результаты. Обычно необходим перерыв от приема антикоагулянтов в течение 4-6 недель. Тест на тромбофилию должен быть отложен на срок 8 недель после родов, так как результаты во время беременности могут быть недостоверны.
Для теста берется образец крови, анализируются части процесса свертывания. Как правило, испытания проводятся в два этапа. Первый этап предполагает оценку основных показателей. Если на первой этапе обнаруживается патология, проводится второй этап, который предполагает более тщательное исследование.
Таким образом, отрицательные тесты не исключают возможности того, что у вас есть унаследованных увеличить риск возникновения тромбов.
Тестирование на тромбофилию показано в следующих ситуациях:
-в случае венозного тромбоза или легочной эмболии в возрасте до 40 лет;
- приповторных эпизодах венозного тромбоза или легочной эмболии, или тромбофлебита (воспаление вен);
- при тромбозах в нетипичных местах (например, органы брюшной полости или мозг);
- необъяснимые тромбозы у новорожденных;
- у младенцев и детей с редким состоянием, которое называется пурпурой Fulminans;
- при некрозе кожи за счет лекарств, таких как варфарин;
- если у пациента есть родственники с определенными типами высокого риска тромбофилии, например, дефицит белков С и S.
- при тромбозах у беременной женщины;
- при наличии семейного анамнеза венозного тромбоза, по крайней мере, у двух родственников;
- при других заболеваниях: при повторном выкидыше или смерти плода, идиопатической тромбоцитопенической пурпуре (ИТП), системной красной волчанке (СКВ).
Лечение
На первом этапе для пациента и врача, важно определить риск образования тромбов. Этот риск зависит от сочетания факторов, таких как:
1. Какой тип тромбофилии имеется у пациента (некоторые из них имеют более высокий риск тромбообразования, чем другие).
2. Возраст, вес, образ жизни и другие заболевания у пациента.
3. Настоящая беременность или недавние роды.
4. Образование тромбов в анамнезе.
5. Наследственный анамнез по тромбообразованию.
Возможными методами лечения тромбофилии являются:
1. Низкие дозы аспирина.
Низкие дозы аспирина подавляют действие тромбоцитов, таким образом, могут помочь предотвратить образование тромбов. Это может также помочь предотвратить выкидыш или осложнения беременности при некоторых видах тромбофилии.
2. Лечение антикоагулянтами.
Антикоагулянтную терапию часто называют разжижением крови. Однако, этот метод лечения на самом деле не разжижает кровь. Он изменяет определенные химические вещества в крови, чтобы замедлить процесс свертывания. Антикоагулянты не растворяет тромб. Антикоагулянты могут значительно уменьшить вероятность тромбообразования. Эти препараты обычно используются для лечения венозных тромбозов и легочной эмболии.
При тромбофилии антикоагулянт может быть рекомендован, если:
- при наличии тромба, чтобы предотвратить еще один;
- при высоком риске образования тромба;
- в случае беременности, в течение 6 недель после родов, или в случае вынужденного неподвижного образа жизнив течение длительного периода.
Есть два основных типа антикоагулянта: гепарин и варфарин. Гепарин применяется в виде инъекций один или два раза в день. Варфарин принимается в виде таблеток один раз в день.
Варфарин является обычным антикоагулянтом. Тем не менее, период, когда варфарин начинает проявлять свои антикоагулянтные свойсвтва, может занять до нескольких дней. Таким образом, инъекции гепарина (часто даются только подкожно) используются наряду с варфарином в первые несколько дней (обычно 5 дней) для немедленного эффекта, если у пациента уже образовался. При отсутствии тромба прием варфарина не сопровождают инъекциями гепарина.
Цель терапии состоит в том, чтобы подобратьдозу варфарина так, кровь не сворачивалась легко, или, наоборот, слишком долго, что может вызвать проблемы с кровотечением. Пациенту необходимо проводить регулярные анализы крови, в первую очередь, МНО, в то время как он принимает варфарин. Дозу устанавливают индивидуально в зависимости от результатов анализа крови. МНО кровиизмеряет способность свертывания крови.
Гепарин является инъекционным антикоагулянтом.
Гепарин с низкой молекулярной массой вводится в кожу на нижней части живота. Различные дозы используются для профилактики и лечения существующих сгустков крови.
Лечение тромбофилии во время беременности.
Лечение тромбофилии может быть различным в период беременности, потому что:
1. Некоторым женщинам с определенным типом тромбофилии рекомендуется принимать низкие дозы аспирина во время беременности, чтобы предотвратить выкидыш или осложнения беременности.
2. Сама беременность увеличивает риск венозного тромбоза — это относится ко всей беременности и особенно к периоду до 6 недель после родов. Таким образом, пациентке может быть рекомендовано лечение антикоагулянтами во время беременности или после родов. Это будет зависеть от типа тромбофилии.
3. При приеме варфарина обычно рекомендуется перевод на гепарин. Это связано с тем, что гепарин более безопасен для плода (имеется значительная вероятность того, что варфарин может вызвать аномалии развития плода). Как гепарин, и варфарин являются безопасными для грудного вскармливания.
Основные медуслуги по стандартам лечения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
