Что такое синдром хрупкой хромосомы х
Генетические особенности синдрома ломкой Х-хромосомы
Среди группы наследственных болезней есть два заболевания, относящихся к самым частым причинам интеллектуальной недостаточности. Самая известная и наиболее распространённая патология – синдром Дауна, связанный с наличием лишней 21-ой хромосомы в геноме человека. В этой статье мы расскажем о втором по распространенности наследственном заболевании, которое приводит к умственной отсталости, а также может сопровождаться другими клиническими проявлениями.
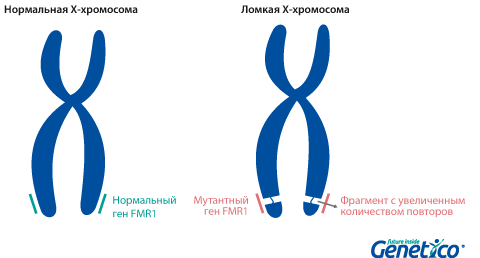
Синдром ломкой X-хромосомы или синдром Мартина-Белл является результатом нарушения в гене FMR1 (fragile X mental retardation-1), который расположен на Х-хромосоме и играет важную роль в появлении и развитии нервных связей, обучении и запоминании. Частота этого синдрома среди мальчиков составляет 1:4000.

Так называемая «ломкость» X-хромосомы проявляется в том, что хромосома выглядит нетипично при специальном окрашивании, как будто один кусок отделился, хотя физически она остается цельной. Генетическая основа этого явления заключается в увеличении числа тринуклеотидных повторов CGG в гене FMR1, расположенном на X-хромосоме.
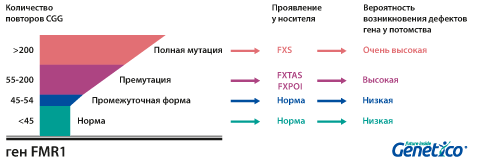
У здоровых людей число повторов в этом гене колеблется от 5 до 54. Если повторов больше 200, то наработка белка с гена FMR1 нарушается, что приводит к развитию синдрома Мартина-Белл и клиническому проявлению заболевания. Премутационное состояние — это количество повторов CGG от 55 до 200. В таком состоянии заболевание у людей в типичной форме не проявляется, но чем больше повторов в этом гене у носителя, тем больше вероятность того, что у ее или его детей количество повторов будет больше 200 и заболевание разовьется. В случае носительства премутации при формировании половых клеток количество повторов может увеличиваться, поэтому если у родителя количество повторов от 55 до 200, то высока вероятность рождения ребенка с мутантным геном FMR1 и синдромом Мартина-Белл. При этом носительство премутационного состояния будущим папой и мамой неравнозначно по вероятности возникновения мутантного аллеля у их детей: если носитель – мама, то вероятность значительного увеличения числа повторов гораздо выше. Количество повторов от 45 до 54 является промежуточной формой, которая не имеет никакого влияния на здоровье человека, но может приводить к проблемам у будущих поколений, как и в случае премутационного состояния гена.
Важно учитывать, что наследование и развитие заболевания зависит от пола, так как ген FMR1 находится на Х-хромосоме. У мужчин только одна Х-хромосома, которую они получают от матери. Поэтому, в случае, если эта одна хромосома оказалась «ломкой», у них проявляется заболевание. У женщин две Х-хромосомы, однако активно работает только одна из них. Поэтому наличие одной Х-хромосомы с мутантным геном FMR1 может не проявляться клинически, в случае инактивации именно «ломкой» хромосомы, или приводить к развитию заболевания в 30-50% случаев. Мужчина с ломкой Х-хромосомой может передать её всем дочерям, но ни одному из сыновей. Женщина с мутантной хромосомой имеет шансы передать её как сыновьям, так и дочерям с равной вероятностью.
Премутационное состояние гена влияет как на судьбу потомков носителя такого гена, так и непосредственно на его здоровье:
Развитие первичной недостаточности яичников (FXPOI) (снижение овариального резерва и наступление менопаузы до 40 лет). Мутация FMR1 является причиной преждевременного истощения яичников у 5% женщин с этим диагнозом. Среди носительниц премутации примерно у четверти развивается это состояние. Оно влияет не только на общие репродуктивные возможности, но и на подбор протокола стимуляции при ВРТ, так как часто оказывается причиной бедного ответа яичников на стимуляцию. Интересно, что по данным, полученным в центре Genetico, хотя бедный ответ яичников на стимуляцию влияет на число получаемых в цикле эмбрионов, он не приводит к увеличению доли анеуплоидных эмбрионов.
Тремор/атаксия, ассоциированные с ломкой Х-хромосомой (FXTAS). Это состояние чаще развивается у мужчин: при носительстве премутации мужчиной проявляется в 33% случаев, а при носительстве премутации женщиной – лишь в 5-10%. Синдром FXTAS начинает проявляться в пожилом возрасте. Наблюдается тремор, шаткая походка, может страдать речь.
Метод диагностики, используемый в лаборатории Genetico, основан на использовании полимеразной цепной реакции с особым набором праймеров, позволяющих не только детектировать нормальное, премутационное и мутационное состояния, но и точно определить количество повторов в случаях, когда их меньше 200. Такая диагностика позволяет выявить синдром ломкой X-хромосомы на молекулярном уровне, а также оценить вероятность рождения ребенка с этим синдромом и возможность развития у пациента расстройств, связанных с увеличенным количеством повторов в гене FMR1. Такая диагностика также позволяет детектировать наличие AGG повторов среди повторов CGG. Полагают, что участки AGG, прерывающие длинную последовательность из CGG повторов, придают ДНК устойчивость и снижают риск увеличения количества повторов в следующем поколении.
Генетический тест, определяющий количество повторов в гене FMR1, рекомендуется пройти в первую очередь женщинам с синдромом преждевременного истощения яичников или с выявленной неслучайной инактивацией Х-хромосомы (косвенный признак), семьям, в которых есть сыновья с интеллектуальной недостаточностью. Также анализ состояния гена FMR1 необходим:
1) женщинам с репродуктивными проблемами или нарушениями фертильности, связанными с повышенным уровнем фолликулостимулирующего гормона (ФСГ)
2) пациентам с интеллектуальной недостаточностью и их родственникам
3) тем, у кого в семье были случаи синдрома ломкой Х-хромосомы или умственной отсталости без точного диагноза
4) женщинам, у родственников которых наблюдались нарушения, связанные с премутационным состоянием FMR1
5) пациентам с поздно проявившимся тремором и мозжечковой атаксией (нарушения согласованности работы мышц из-за поражения систем мозга, управляющих движением мышц).
В случае обнаружения бессимптомного носительства мутации в гене FMR1 у женщины может быть рекомендовано использование донорских ооцитов или проведение преимплантационной генетической диагностики (ПГД) с целью исключить возможность проявления синдрома у ребенка. Также важно правильно оценивать риск рождения больного ребенка в случае премутационного состояния гена FMR1 у будущих родителей. В таком случае по результатам теста рекомендуется консультация врача-генетика.
Автор: Очир Мигяев
Стажер лаборатории Genetico
Источник
Ломкие сайты хромосом, или фрагильные сайты (от англ. fragile — ломкий, хрупкий) — участки хромосом человека, склонные к образованию разрывов, которые выявляются при цитогенетическом анализе препаратов метафазных хромосом. Различают редкие, или наследуемые, и обычные, или конститутивные, ломкие сайты. Ломкие сайты имеются во всех хромосомах человека, в целом их насчитывается около сотни[1]. Молекулярная природа этого явления ещё не известна.
Номенклатура[править | править код]
Ломкие сайты обозначают в соответствии с тем, в каком хромосомном сегменте они находятся, например, ломкий сайт, ассоциированный с синдромом Мартина — Белл, имеет обозначение fra(X)(q27.3). Кроме того, существуют названия для ломких сайтов, утверждаемые комитетом по номенклатуре HUGO. Например, вышеупомянутый ломкий сайт fra(X)(q27.3) имеет название FRAXA, что означает «ломкий сайт на хромосоме X в локусе А», причём буква «А» означает, что это был первый описанный ломкий сайт для хромосомы Х[2].
Наследуемые сайты ломкости[править | править код]
Явление повышенной ломкости хромосом в определённых сайтах было обнаружено в 70-х годах XX века. При цитогенетическом анализе метафазных хромосом у некоторых индивидов было обнаружено, что в большинстве проанализированных клеток один и тот же участок хромосом имел разрыв или пробел в окрашивании. Частота встречаемости отдельных ломких сайтов в популяции не превышает обычно 5 %[2]. Для наследуемых ломких сайтов характерно менделевское наследование[1]. Выявлению большей части наследуемых ломких сайтов способствует культивирование клеток in vitro в среде, обеднённой фолиевой кислотой.
Большинство наследуемых фрагильных сайтов не связано с какой-либо клинически значимой патологией, кроме наследуемого сайта ломкости FRAXA, который наблюдается у больных синдромом хрупкой Х-хромосомы (Синдром Мартина — Белл). До развития молекулярно-генетических методов диагноз у пациентов с синдромом Мартина — Белл верифицировали по наличию ломкого сайта в локусе Xq27.3[3]. Наследуемый фрагильный сайт FRAXA находится в 5′-нетранслирумой области гена FMR1 и содержит повтор из триплетов ЦГГ. Аномальная длина этого повтора у больных вызывает гиперметилирование промотора гена FMR1 и, как следствие, нарушение экспрессии гена[4].
Конститутивные фрагильные сайты[править | править код]
Конститутивные фрагильные сайты — это разрывы и пробелы в окрашивании хромосом, которые появляются в определённых хромосомных сайтах в клетках у всех людей при умеренном репликативном стрессе, например, при применении в небольших концентрациях ингибиторов репликации ДНК[5]. Это гораздо более обширный класс фрагильных сайтов по сравнению с наследуемыми сайтами.
Конститутивные фрагильные сайты вызывают особенный интерес, потому что они являются «горячими точками» для хромосомных перестроек при различных раковых заболеваниях. Наиболее ярким примером является ломкий сайт FRA3B, располагающийся в хромосомном сегменте 3p14.2. Этот ломкий сайт находится в гене-супрессоре опухолевого роста FHIT[en], который часто утрачивается в опухолях различных локализаций, включая раки кишечника, головы-шеи, лёгких и раке молочной железы[2].
Природа явления ломкости хромосом до конца не изучена. Известно, что конститутивные фрагильные сайты обычно ассоциированы с позднореплицирующимся хроматином[6]. Они нередко находятся в пределах очень длинных генов (около 1 млн пар оснований и более), таких как FHIT и WWOX[en][7]. Многие обычные сайты ломкости являются тканеспецифичными. Недавние исследования связывают ломкость хромосом с дефицитом сайтов инициации репликации в этих районах. Предполагают, что недостаточность сайтов инициации в конце S-фазы клеточного цикла может приводить к локальной незавершенности процесса репликации при репликативном стрессе и формировании в некоторых случаях двунитевого разрыва ДНК[8].
Примечания[править | править код]
- ↑ 1 2 Durkin S. G., Glover T. W. Chromosome fragile sites. // Annu Rev Genet. — 2007. — Т. 41. — С. 169-192. — doi:10.1146/annurev.genet.41.042007.165900.
- ↑ 1 2 3 Генетика человека по Фогелю и Мотулски / М. Р. Спейчер, С. Е. Антонаракис, А. Г. Мотулски. — 4-е издание. — СПб: Н-Л. — С. 138-139. — 1056 с. — ISBN 978-5-94869-167-1.
- ↑ Oostra B. A. et al. Guidelines for the diagnosis of fragile X syndrome. National Fragile X Foundation (англ.) // Journal of medical genetics. — Vol. 30, no. 5. — P. 410-413.
- ↑ Naumann A. et al. A Distinct DNA-Methylation Boundary in the 5′-Upstream Sequence of the FMR1 Promoter Binds Nuclear Proteins and Is Lost in Fragile X Syndrome (англ.) // The American Journal of Human Genetics. — 2009. — Vol. 85, no. 5. — P. 606-616.
- ↑ Debatisse M. et al. Common fragile sites: mechanisms of instability revisited (англ.) // Trends in genetics : TIG. — 2012. — Vol. 28, no. 1. — P. 22-32.
- ↑ Wang L. et al. Allele-specific late replication and fragility of the most active common fragile site, FRA3B (англ.) // Human molecular genetics. — 1999. — Vol. 8, no. 3. — P. 431-437.
- ↑ Smith D. I. et al. Common fragile sites, extremely large genes, neural development and cancer //Cancer letters. – 2006. – V. 232. – №. 1. – P. 48-57.
- ↑ Letessier A. et al. Cell-type-specific replication initiation programs set fragility of the FRA3B fragile site //Nature. – 2011. – V. 470. – №. 7332. – P. 120-123.
Источник
X-хромосо́ма — половая хромосома. У всех млекопитающих и других организмов с гетерогаметным мужским полом у самок две X-хромосомы (XX), а у самцов — одна X-хромосома и одна Y-хромосома (XY). Существуют и организмы (например, утконосы), у которых несколько негомологичных X-хромосом.
X-хромосома человека[править | править код]
X-хромосома человека содержит около 150 миллионов пар оснований, что составляет примерно 5 % ДНК в клетках женщин, 2,5 % в клетках мужчин[1]. Несёт более 1400 генов, из них белок-кодирующих — около 800[2] (ср. с Y-хромосомой, которая несёт всего 78 генов[3]). У женщин две X-хромосомы; у мужчин одна X-хромосома и одна Y-хромосома. Одна X-хромосома наследуется от матери, а вторая (только у женщин) от отца.
Хотя у женщин две X-хромосомы, в соматических клетках одна из них инактивирована и образует тельце Барра.
Хромосомные болезни по X-хромосоме[править | править код]
- Синдром Клайнфельтера — полисомия по X-хромосоме у мужчины
- Трисомия по X-хромосоме
- Синдром Шерешевского — Тёрнера — отсутствие или повреждение одной из X-хромосом у женщины
- Болезнь Фабри — повреждение единственной X-хромосомы у мужчин и одной из Х-хромосом у женщин
X-сцепленные заболевания[править | править код]
- X-сцепленная эндотелиальная дистрофия роговицы
- Мегалокорнеа
- Болезнь Менкеса
- X-сцепленный ихтиоз
- Гемофилия
- Дальтонизм
Гены[править | править код]
Плечо p[править | править код]
- BMX — нерецепторная тирозинкиназа семейства Tec;
- NOX2 — NADPH-оксидаза;
- STS — стероидная сульфатаза;
- TIMP1 — тканевый ингибитор металлопротеиназ;
- WASp — белок синдрома Вискотта — Олдрича.
Плечо q[править | править код]
- AGTR2 — ангиотензиновый рецептор 2;
- ATP7A;
- DCX — даблкортин;
- HEPH — гефестин;
- LAMP2 — мембранный белок, ассоциированный с лизосомами;
- OGT — O-GlcNAc-трансфераза.
История[править | править код]
X-хромосома издавна славится своими особыми свойствами среди генетиков, которые назвали её буквой X не за форму, как можно было бы предположить[4] (аутосомы также похожи на букву X), а потому, что первые исследователи были сбиты с толку тем, насколько X-хромосома отличается от других хромосомных пар. Y-хромосома была названа следующей буквой алфавита потому, что была открыта следующей. Тот факт, что Y-хромосома во время митоза имеет два очень коротких плеча, которые выглядят под микроскопом Y-образно, является случайным совпадением[5].
X-хромосома была впервые выявлена в 1890 году Германом Хенкингом в Лейпциге. Хенкинг занимался исследованиями яичек клопов и заметил, что одна хромосома не принимает участие в мейозе. Хенкинг не был уверен, была ли это хромосома или объект другого класса, поэтому назвал его X-элементом[6], позже было установлено, что это была действительно хромосома, которая получила название X-хромосома[7].
В 1901 году Кларенс Эрвин Мак-Кланг (англ. Clarence Erwin McClung) впервые предположил, что X-хромосома участвует в определении пола, на основании сравнения своего исследования саранчи с работами Хенкинга и других. Мак-Кланг заметил, что только половина сперматозоидов получают X-хромосому. Он посчитал её дополнительной хромосомой, определяющей мужской пол. Позднее было установлено, что Мак-Кланг ошибся, а хромосомой, определяющей мужской пол, скорее является Y-хромосома[6].
См. также[править | править код]
- Закон Оно
- Хромосомные болезни
- Наследование, сцепленное с полом
- Инактивация X-хромосомы
- Y-хромосома
Примечания[править | править код]
- ↑ Ross M. T., Grafham D. V., Coffey A. J., et al. The DNA sequence of the human X chromosome (англ.) // Nature. — 2005. — March (vol. 434, no. 7031). — P. 325—337. — doi:10.1038/nature03440. — PMID 15772651.
- ↑ Chromosome X: chromosome summary (англ.). The Ensembl project. Дата обращения 28 мая 2013. Архивировано 29 мая 2013 года.
- ↑ Richard Harris. Scientists Decipher Y Chromosome (2003). Дата обращения 16 августа 2009. Архивировано 13 марта 2012 года.
- ↑ Angier, Natalie For Motherly X Chromosome, Gender Is Only the Beginning. New York Times (1 мая 2007). Дата обращения 1 мая 2007.
- ↑ David Bainbridge, The X in Sex: How the X Chromosome Controls Our Lives, pages 65-66, Harvard University Press, 2003 ISBN 0674016211.
- ↑ 1 2 James Schwartz, In Pursuit of the Gene: From Darwin to DNA, pages 155—158, Harvard University Press, 2009 ISBN 0674034910
- ↑ David Bainbridge, The X in Sex: How the X Chromosome Controls Our Lives, pages 3-5, Harvard University Press, 2003 ISBN 0674016211.
Ссылки[править | править код]
- Chromosome X на сайте National Center for Biotechnology Information (англ.)
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 мая 2015;
проверки требуют 16 правок.
Синдром Э́двардса (синдром трисомии 18) — хромосомное заболевание, характеризуется комплексом множественных пороков развития и трисомией 18 хромосомы. Описан в 1960 году Джоном Эдвардсом (John H. Edwards). Популяционная частота примерно 1:3000 в США, и 1:5000 в мире на 2016 год. Дети с трисомией в 18 хромосоме чаще рождаются у пожилых матерей, взаимосвязь с возрастом матери менее выражена, чем в случаях трисомии хромосомы 21[3] и 13[4]. Для женщин старше 45 лет риск родить больного ребёнка составляет 0,7 %. Девочки с синдромом Эдвардса рождаются в три раза чаще мальчиков. Выживание после года жизни составляет около 5–10%[5].
Причины заболевания[править | править код]
Причиной заболевания является наличие дополнительной 18-й хромосомы (трёх вместо двух в норме для диплоидного набора) в кариотипе зиготы.
Лишняя хромосома обычно появляется до оплодотворения. У человека нормальные половые клетки — гаметы — содержат по 23 хромосомы (гаплоидный набор) и, сливаясь, они дают кариотип зиготы — 46 хромосом. К появлению лишней хромосомы у гамет обычно приводит нерасхождение хромосом при мейотическом делении, вследствие чего в половой клетке оказывается 24 хромосомы. В случае, если такая клетка встретит при оплодотворении гамету от противоположного пола, они образуют зиготу с трисомией.
В одном случае из десяти наблюдается мозаицизм в явлении трисомии 18: лишнюю хромосому несут не все клетки организма. Это говорит о том, что нерасхождение произошло на ранней стадии развития зародыша, а все клетки с трисомией — потомки неправильно поделившейся клетки зародыша.
Проявления синдрома[править | править код]
Дети с трисомией 18 рождаются с низким весом, в среднем около 2200 грамм, при этом длительность беременности — нормальная или даже превышает норму. Фенотипические проявления синдрома Эдвардса многообразны. Чаще всего возникают аномалии мозгового и лицевого черепа, мозговой череп имеет долихоцефалическую форму. Нижняя челюсть и ротовое отверстие маленькие. Глазные щели узкие и короткие. Ушные раковины деформированы и в подавляющем большинстве случаев расположены низко, несколько вытянуты в горизонтальной плоскости. Мочка, а часто и козелок отсутствуют. Наружный слуховой проход сужен, иногда отсутствует. Грудина короткая, из-за чего межреберные промежутки уменьшены и грудная клетка шире и короче нормальной. В 80 % случаев наблюдается аномальное развитие стопы: пятка резко выступает, свод провисает (стопа-качалка), большой палец утолщён и укорочен. Из дефектов внутренних органов наиболее часто отмечаются пороки сердца и крупных сосудов: дефект межжелудочковой перегородки, аплазии одной створки клапанов аорты и лёгочной артерии. У всех больных наблюдаются гипоплазия мозжечка и мозолистого тела, изменения структур олив, выраженная умственная отсталость, снижение мышечного тонуса, переходящее в повышение со спастикой.
Прогноз[править | править код]
Продолжительность жизни детей с синдромом Эдвардса невелика: 60 % детей умирают в возрасте до 3 месяцев, до года доживает лишь 5-10 %. Основной причиной смерти служат остановка дыхания и нарушения работы сердца. Оставшиеся в живых — глубокие олигофрены.
Частота появления[править | править код]
Частота появления синдрома Эдвардса составляет ~ 1:7000 зачатий и 1:8000 рождений живых детей. Риск рождения больного ребёнка увеличивается с возрастом, особенно, если мать болеет диабетом.
Вариации[править | править код]
Кроме трисомии 18, присутствующей во всех клетках организма, а также мозаичной трисомии 18, возможна и частичная трисомия. При этом часть хромосомы 18 присоединяется к другой хромосоме. Такой эффект называется транслокация, и он может произойти как при созревании гамет, так и после оплодотворения в клетках зародыша. В клетках организма при этом оказываются две гомологичные хромосомы 18 и, дополнительно, часть хромосомы 18, прикреплённая к другой хромосоме. У людей, страдающих частичной трисомией 18, аномалии проявляются слабее, нежели при типичном синдроме Эдвардса.
См. также[править | править код]
- Анеуплоидия
- Хромосомные болезни
- Синдром Дауна
- Синдром Патау
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Синдром Дауна
- ↑ Синдром Патау
- ↑ Genetics Home Reference. Trisomy 18 (англ.). Genetics Home Reference. Дата обращения 20 сентября 2019.
Ссылки[править | править код]
- https://rh-conflict.narod.ru/student/lectures/hrombol.htm
Источник
