Болевой синдром при полиневропатиях подходы к лечению
Полиневропатии (ПНП) – одно из наиболее распространенных заболеваний периферической нервной системы, обусловленное системным поражением периферических нервов. По российским данным, ПНП составляют не менее 60% от всех поражений периферической нервной системы [1]. Общая распространенность ПНП в европейских странах составляет 2400×105, возрастая в когорте лиц пожилого возраста в 3–4 раза [2]. Этиология ПНП очень разнообразна. Они могут быть следствием первичного поражения структур нервной системы, что имеет место при наследственных и идиопатических воспалительных и невоспалительных ПНП, либо могут развиваться вторично на фоне соматической патологии (сахарного диабета (СД), токсических поражений, онкологических заболеваний, метаболических нарушений и т. д.).
Клинические проявления и их патогенез
Болевой синдром при ПНП, как правило, является следствием поражения аксонов, в частности Аσ и С-волокон, т. е. сенсорных слабомиелинизированных и немиелинизированных нервных проводников. Основными патофизиологическими механизмами формирования болевого синдрома при ПНП считаются: сенситизация ноцицепторов и С-волокон, эктопическая спонтанная активность поврежденных и регенерирующих волокон, эфаптическая передача импульсов при контакте соматосенсорных и болевых волокон, а также центральная сенситизация [3, 4].
По характеру течения выделяют острые, подострые и хронические формы ПНП. По преобладающим клиническим проявлениям ПНП разделяют на сенсорные, моторные, сенсомоторные, сенсорные вегетативные, вегетативные и смешанные. При ПНП первично чаще страдают аксоны нервных волокон с последующим присоединением миелинопатии, реже изначально повреждается миелиновая оболочка (при демиелинизирующих ПНП) или имеется сочетанное поражение аксона и оболочки [1].
ПНП проявляются негативными и позитивными симптомами. К негативным симптомам, или симптомам выпадения, относят снижение или утрату рефлексов и чувствительности, снижение мышечного тонуса и мышечной силы, гипотрофию/атрофию мышц; к позитивным симптомам, или симптомам раздражения – болезненные судороги, фасцикуляции, парестезии и боли. Часто именно болевой синдром становится ведущим в клинической картине ПНП. Болевыми проявлениями могут сопровождаться ПНП различного происхождения (табл. 1), однако наиболее часто встречающиеся варианты болевых ПНП – это диабетическая и алкогольная [5]. 
Боль при ПНП – классическая периферическая невропатическая боль со всеми ее клиническими особенностями: жгучим, глубоким, изнуряющим характером, аллодиниями, парестезиями, гипералгезией, часто – пароксизмальностью. Боль может быть спонтанной или вызванной повышенной болевой чувствительностью (гипералгезия) либо восприятием неболевого стимула как болевого (аллодиния). Следует отметить, что клинические характеристики невропатической боли не зависят от этиологии, пола, возраста, давности заболевания, а отражают основные патофизиологические механизмы формирования боли.
Лечение
Лечение невропатической боли – сложная задача, купировать болевой синдром редко удается с помощью монотерапии. Это объясняется необходимостью воздействовать на различные уровни и патофизиологические феномены ноцицептивной системы. Так, гипервозбудимость периферических нейронов с развитием центральной сенситизации способны подавлять лидокаин, габапентин и прегабалин. Эктопическую активность ноцицепторов снижают лидокаин и карбамазепин. При центральной сенситизации эффективны флупиртин, антиконвульсанты, антидепрессанты, опиоиды [6]. Именно препараты этих групп представлены в EFNS guidelines on the pharmacological treatment of neuropathic pain (Рекомендации по фармакологическому лечению невропатической боли, разработанные Европейской федерацией неврологических сообществ) от 2010 г. как препараты с доказанной эффективностью при лечении невропатической боли [7].
При ведении пациентов с болевыми ПНП, безусловно, необходимо в первую очередь использовать препараты этиотропной терапии. Однако это не исключает проведения анальгетической терапии с учетом рекомендаций по лечению невропатической боли. Для лечения болевого синдрома при ПНП в качестве препаратов первого ряда называются прегабалин, габапентин и трициклические антидепрессанты, к препаратам второго и третьего ряда относят ламотриджин, опиоиды, селективные ингибиторы обратного захвата серотонина и трамадол. Однако с 1950 г. во многих странах в качестве дополнительной, а иногда и самостоятельной анальгетической терапии стали применять витамины группы В. Их нейротропные эффекты давно известны и хорошо доказаны. Вместе с тем клинический опыт показывает, что парентеральное использование комплекса витаминов В1 (тиамина), В6 (пиридоксина) и В12 (цианкобаламина) хорошо купирует боль, нормализует рефлекторные реакции, устраняет нарушения чувствительности. Уменьшение болевого синдрома при различных вариантах периферической невропатической и смешанной боли продемонстрировано более чем в 100 клинических исследованиях, опубликованных на сегодняшний день [8]. Механизмы анальгетического действия витаминов группы В до конца не изучены, однако экспериментальными исследованиями подтверждены их антиноцицептивные эффекты:
• торможение ноцицептивной активности в нейронах задних рогов и таламусе;
• усиление норадренергической и серотонинергической антиноцицептивной активности;
• ингибирование синтеза и/или блокирование действия воспалительных медиаторов [9].
Комбинированные препараты витаминов группы В широко используются при лечении болевого синдрома у пациентов с диабетической и алкогольной ПНП [10–14].
Следует, однако, уточнить, что при лечении дизиммунных воспалительных демиелинизирующих ПНП, которые также встречаются у пациентов с хронической алкогольной интоксикацией и СД и сопровождаются болью, эффект может быть достигнут лишь при применении иммуномодулирующей терапии [15].
Одним из комплексных препаратов витаминов группы В является Нейробион, одна ампула которого содержит 100 мг тиамина гидрохлорида, 100 мг пиридоксина гидрохлорида и 1 мг цианкобаламина. В пероральной форме в состав одной таблетки входит 100 мг тиамина дисульфида, 200 мг пиридоксина гидрохлорида и 0,2 мг цианкобаламина. Составляющие препарата Нейробион не взаимодействуют друг с другом, что обеспечивается особой технологией изготовления. Разные формы выпуска препарата позволяют выбрать индивидуальную терапевтическую стратегию в зависимости от стадии и течения заболевания.
Ретроспективный анализ более тысячи пациентов с различными болевыми синдромами продемонстрировал высокую эффективность парентеральной формы препарата, в т. ч. в качестве монотерапии. У 86% пациентов с болевыми ПНП был достигнут положительный результат [16, 17].
Цель исследования: на примере собственного опыта оценить анальгезирующий эффект комплекса витаминов группы В – препарата Нейробион – при лечении алкогольной и диабетической ПНП.
Материал и методы
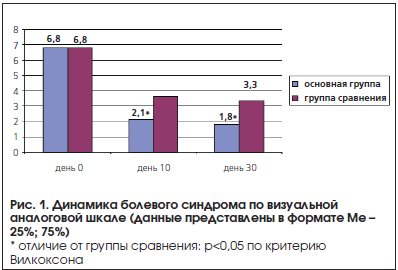
Под наблюдением в неврологической клинике ГБУЗ НО «НОКБ им. Н.А. Семашко» (Нижний Новгород) находился 41 пациент, среди которых 23 пациента наблюдались с хронической дистальной сенсорной диабетической ПНП аксонального типа и 18 пациентов – с хронической алкогольной сенсомоторной ПНП аксонального типа. Средний возраст пациентов составил 47,2 года (от 34 до 56 лет), среди них было 19 женщин и 22 мужчины. Диагноз был подтвержден клинически и методом электронейромиографии. У всех пациентов имелись жалобы на боли в ногах, существенно снижающие качество жизни. Боли описывались пациентами как жгучие, ноющие, стреляющие, усиливающиеся в ночное время, сопровождались парестезиями и судорогами икроножных мышц. Уровень невропатической боли по опроснику DN4 до лечения в среднем достигал 7 баллов, по 10-балльной визуальной аналоговой шкале – 6,8 балла.
Пациенты были поделены на две группы: основная группа – 13 пациентов с диабетической ПНП и 10 пациентов с алкогольной ПНП, группа сравнения – 10 пациентов с диабетической ПНП и 8 пациентов с алкогольной ПНП. Все пациенты получали общепринятую этиопатогенетическую терапию в соответствии со стандартами оказания медицинской помощи и национальными рекомендациями лечения ПНП. Больные с СД получали соответствующую диету и сахароснижающие препараты в стабильных дозировках. Помимо этого всем пациентам проводилась неспецифическая нейротропная и метаболическая терапия, включавшая пентоксифиллин внутривенно капельно и ипидакрин внутримышечно. С целью купирования нейропатического болевого синдрома назначались карбамазепин и амитриптилин внутрь. Прием антиконвульсантов и антидепрессантов рекомендовалось продолжить после выписки из стационара. Пациенты основной группы дополнительно получали комплекс витаминов группы В в виде препарата Нейробион. Во время пребывания в стационаре препарат вводился внутримышечно по 1 ампуле ежедневно в течение 9 дней, затем перорально по одной таблетке 3 р./день в течение 3-х недель.
Эффективность проводимого лечения оценивалась по окончании курса стационарного лечения – на 9-й день терапии и через месяц от начала терапии – на 30-й день. Динамика болевого синдрома оценивалась по шкале DN4 и визуальной аналоговой шкале. Группы сравнения были сопоставимы по полу, возрасту и выраженности болевого синдрома.
Результаты исследования
После проведенного лечения пациенты основной группы отметили более выраженный анальгезирующий эффект уже через 9 дней, хотя достоверное уменьшение болевого синдрома имелось в обеих группах (рис. 1). По опроснику DN4 также было отмечено достоверное уменьшение уровня невропатической боли на 9-й и 30-й дни лечения.
Наибольшая эффективность отмечена в отношении жгучих и приступообразных болей. При этом число пациентов, ощутивших снижение интенсивности боли не менее чем на 50%, было существенно выше в основной группе (рис. 2). При повторном осмотре через месяц в основной группе наблюдалось нарастание эффекта. Слабая выраженность динамики в течение месяца в группе сравнения может быть объяснена отсроченностью действия антидепрессанта. 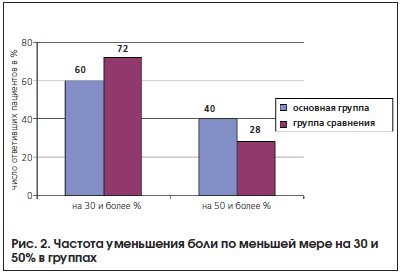
При повторном проведении электронейромиографии существенной динамики не обнаруживалось, что согласуется с современной концепцией анальгезирующего эффекта витаминов группы В, основанного не только на их нейрометаболическом действии, но в большей степени на ингибировании ноцицептивных и активировании антиноцицептивных механизмов невропатической боли. Следует отметить, что вариант хронической алкогольной ПНП с преимущественно аксональным поражением, имевший место у наблюдавшихся пациентов, чаще бывает токсического характера и, как правило, не связан с дефицитом тиамина, что также позволяет говорить о самостоятельном обезболивающем эффекте препарата Нейробион.
Заключение
Таким образом, применение комплексного препарата Нейробион, содержащего витамины В1, В6 и В12, в дополнение к терапии при болевых ПНП существенно уменьшает болевой синдром. С учетом экспериментальных и многочисленных клинических данных, подтверждающих влияние комплекса витаминов группы В на патогенез невропатической боли, его можно считать эффективным средством повышения качества лечения пациентов с болевыми полиневропатиями.
Источник
Полинейропатии (ПН) – это гетерогенная группа заболеваний, имеющих различную этиологию и патогенез, общим признаком которых является множественное диффузное поражение нервных волокон в составе периферических нервов [1]. В клинике нервных болезней ПН представляют собой актуальную проблему вследствие высокой распространенности заболевания, наличия различных клинических форм, что представляет определенные трудности при диагностике и выборе стратегии лечения.
ПН определяется как клиническое состояние, проявляющееся двигательными, чувствительными и вегетативными симптомами, которые возникают при поражении соответствующего типа волокон. Большинство ПН вовлекает все три типа волокон, что проявляется комбинированной сенсорной, моторной и вегетативной симптоматикой [1, 2].
По этиологии следует выделить следующие нозологические формы ПН:
– наследственные (наследственные моторно-сенсорные полинейропатии, семейная амилоидная полинейропатия и др.);
– паранеопластические (ассоциированные со злокачественными новообразованиями);
– при системных заболеваниях (при саркоидозе, диспротеинемии и т. д.);
– токсические (алкогольная, лекарственные, вследствие воздействия других токсических веществ);
– при инфекционных заболеваниях и вакцинации (дифтерии, боррелиозе, гриппе, кори и др.);
– при метаболических расстройствах (диабетическая, уремическая, вследствие дефицита витаминов);
– воспалительные/невоспалительные (хроническая воспалительная демиелинизирующая полинейропатия, синдром Гийена – Барре).
По течению ПН подразделяют на [1]:
– острые (развиваются в течение нескольких дней или недель);
– подострые (симптоматика нарастает в течение нескольких недель, но не более 2 мес.);
– хронические (течение заболевания охватывает несколько месяцев или лет).
Распространенность ПН в популяции составляет около 2400 на 100 тыс. (2,4%) и увеличивается с возрастом до 8 тыс. (8%). При этом частота встречаемости различных типов ПН вариабельна [3]. Так, распространенность синдрома Гийена – Барре, по данным разных авторов, составляет 0,4–4,0 случая на 100 тыс. населения ежегодно, в среднем 1,5–2 случая на 100 тыс. населения [4]. В России как у детей, так и у взрослых этот показатель составляет 0,6–1,7 на 100 тыс. населения [5]. Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) встречается значительно реже. Средняя распространенность данного заболевания составляет 1–3 случая на 100 тыс. населения в год, в популяции встречается с частотой 1–7,7 на 100 тыс. населения [6].
Недостаточно изученной остается группа паранеопластических ПН. Данная патология, по исследованиям разных авторов, встречается в 1–8% случаев верифицированной злокачественной опухоли. Одной из частых причин паранеопластических ПН являются парапротеинемические гемобластозы [7]. Частота лекарственных нейропатий составляет 1,5% от общего числа случаев [8]. Среди препаратов, обладающих побочным действием в отношении периферических нервных волокон, можно отметить мелфалан, циклофосфамид, левомицетин, метронидазол, нитрофураны, пенициллин, пиридоксин в высоких дозах, статины, доксорубицин, талидомид, бортезомиб, леналидомид.
Диабетическая полинейропатия
Наиболее распространенной дисметаболической ПН является диабетическая нейропатия (ДН). По данным анализа эпидемиологических исследований, ДН встречается примерно в 30% случаев у госпитальных больных сахарным диабетом (СД) и в 20% случаев у пациентов, наблюдающихся амбулаторно [9]. Распространенность дистальной ДН составляет от 12 до 95% общей выборки больных СД, что связано с различиями в сроках обследования больных, клинико-инструментальных критериях и чувствительности методов диагностики [9, 10]. По данным мультицентрового исследования DCCT, проведенного в 1999 г., распространенность ДН у адекватно леченных пациентов составила 2% при СД 1-го типа [11]. У 4% больных с СД ДН развивается уже через 5 лет после начала заболевания, а при длительности болезни около 20 лет эта величина возрастает до 15% [11, 12]. Главной задачей лечения больных с осложнением в виде ДН остается достижение и поддержание индивидуальных целевых значений гликемии, что обеспечивается назначением современных сахароснижающих препаратов. Однако наличие ДН в клинической картине пациента с СД требует тщательного мониторинга, междисциплинарного подхода к лечению и профилактике заболевания.
Поражение периферической нервной системы при СД является клинически гетерогенным, что представляет собой определенную трудность в детерминировании ведущего симптома поражения. Наиболее приемлемой в практике остается предложенная в 1997 г. классификация P.K. Thomas, основывающаяся на наличии клинических проявлений ДН [13]:
1. Обратимая нейропатия
• Гипергликемическая нейропатия
2. Генерализованная симметричная ПН (диабетическая ПН)
• Хроническая сенсомоторная нейропатия (дистальная симметричная ПН)
• Острая болевая нейропатия
• Автономная нейропатия
3. Фокальные и мультифокальные нейропатии
• Нейропатия черепных нервов
• Тораколюмбальная радикулонейропатия
• Фокальные нейропатии конечностей
• Проксимальная моторная нейропатия
4. Сосуществующая хроническая воспалительная демиелинизирующая полинейропатия.
Следует уточнить понятие «гипергликемическая обратимая нейропатия». Это патологическое состояние, связанное с декомпенсацией СД и значительным повышением уровня глюкозы крови, характеризуется развитием неврологической симптоматики и транзиторными нарушениями проводимости по периферическим нервным волокнам [14]. После нормализации уровня гликемии наблюдается восстановление функций, но прогноз риска развития в дальнейшем других форм ДН остается невыясненным. Среди всех форм ДН на первом месте по частоте развития находится симметричная дистальная сенсорная нейропатия (34%). Ее распространенность увеличивается до 58% при длительности заболевания более 30 лет [15].
В настоящее время патогенез развития нейропатии при СД представляется сложным каскадным механизмом, включающим различные биохимические звенья. Зарубежными исследователями было предложено условно разделить патогенетические процессы на функциональные и анатомические [16]. Изменение функции развивается на начальной стадии нейропатии и полностью или частично обратимо при поддержании адекватного уровня гликемии. Было показано, что на фоне приема сахароснижающих лекарственных средств, поддерживающих нормальное содержание глюкозы в крови, наблюдается регресс клинических проявлений у пациентов с недавно выявленной ДН [17]. Анатомические нарушения присоединяются позже, и регресс их практически невозможен. В основе патогенеза ДН лежат метаболические нарушения и микроангиопатия, вызывающая изменение трофики нервного волокна. В ходе исследования DCCT, проведенного в 1999 г., убедительно доказана связь гликемии с частотой развития ДН [11]. Однако ряд авторов придерживаются мнения, что длительность и выраженность декомпенсации СД коррелируют только с тяжестью нейропатии, а не с самим фактом ее развития [18].
Транспорт глюкозы в периферическое нервное волокно является инсулиннезависимым процессом, поэтому хроническая гипергликемия приводит к повышению уровня глюкозы в нервной ткани, что в свою очередь ведет к перенасыщению ферментов пути нормального гликолиза. Избыточное количество глюкозы запускает альтернативный путь метаболизма – полиоловый шунт, в котором под действием альдозоредуктазы и сорбитдегидрогеназы глюкоза превращается в сорбитол и фруктозу соответственно. Повышение активности ключевого фермента – альдозоредуктазы и накопление осмотически активных субстратов ведет к нарушению функции нервной проводимости. Показано, что гликирование затрагивает белок аксонального цитоскелета и белковые фракции миелиновой оболочки. Этот процесс оказывается сопряженным с оксидативным стрессом. В литературных источниках упоминается термин «гликоксидация», отражающий взаимосвязь гликирования и окисления. Выявлено, что оксидация потенцирует присоединение глюкозы к протеинам и накопление продуктов полиолового пути. Последнее приводит к снижению уровня миоинозитола и активности Na+/K+-АТФазы, нарушая, таким образом, аксональный транспорт и вызывая некорректное распространение потенциала действия. В то же время ряд авторов выявили отсутствие корреляции между уровнем миоинозитола и глубиной нарушения углеводного обмена [19]. Таким образом, патогенез ДН представляет собой сложный многокомпонентный процесс, обусловливающий гетерогенность клинических симптомов и требующий разностороннего подхода к терапии.
Клиническая картина ДН обусловлена симптомами поражения периферических нервных волокон. Существуют классификации, предложенные разными авторами, отражающие стадийность патологического процесса.
Классификация тяжести ДН по P.J. Dyck [20]:
– 0 – нормальная нервная проводимость;
– 1а – изменения при оценке нервной проводимости в отсутствие симптомов и признаков нейропатии;
– 1b – изменения при оценке нервной проводимости в сочетании с признаками нейропатии, но без клинической симптоматики;
– 2а – изменения при оценке нервной проводимости в сочетании или без признаков нейропатии при наличии клинической симптоматики;
– 2b – изменения при оценке нервной проводимости + умеренная (50%) мышечная слабость при тыльном сгибании стопы при наличии или отсутствии клинической симптоматики.
Характеристика клинических признаков в соответствии со стадией ДН представлена в классификации Boulton A.J.M. (табл. 1) [19].
![Таблица 1. Стадии диабетической нейропатии (по Boulton A.J.M) [19] Таблица 1. Стадии диабетической нейропатии (по Boulton A.J.M) [19]](https://www.rmj.ru/upload/medialibrary/e2d/1705-1.png)
Как правило, в патологический процесс первыми вовлекаются длинные нервные волокна, что объясняет манифестацию с симптомов в области стоп, затем изменения возникают в более проксимальных отделах. Наблюдаемая клиническая картина характеризуется симптомами поражения разных типов волокон (табл. 2) [15].
![Таблица 2. Симптомы диабетической нейропатии [15] Таблица 2. Симптомы диабетической нейропатии [15]](https://www.rmj.ru/upload/medialibrary/158/1705-2.png)
Диагностика ДН складывается из оценки жалоб пациента, данных клинико-неврологического осмотра и дополняется результатами электрофизиологической диагностики (электронейромиография (ЭНМГ), количественное сенсорное тестирование (КСТ)) [21].
Алкогольная полинейропатия
Другой формой ПН, часто встречающейся в практике врача, является алкогольная полинейропатия (АП), относящаяся к группе экзогенно-токсических поражений нервной системы. Следует отметить, что клинические проявления токсических поражений периферической нервной системы зависят от тропности химического вещества к тем или иным невральным структурам или их чувствительности к повреждающему фактору. По частоте встречаемости в общей клинической практике АП занимает 2-е место после ДН (12,5–29,6% случаев хронического алкоголизма) [22]. В то же время латентные бессимптомные формы АП при проведении комплексного ЭНМГ-исследования обнаруживаются у 97–100% больных, хронически злоупотребляющих алкоголем [23].
В настоящее время считается, что основными патогенетическими механизмами АП являются [24]: прямое токсическое действие этанола и его метаболитов; дефицит витаминов группы В, связанный с недостаточным питанием и/или нарушениями всасывания (синдромом мальабсорбции).
Кроме того, отмечается связь развития АП с оксидативным стрессом и избыточным образованием свободных кислородных радикалов, поражающих эндотелий и вызывающих эндоневральную гипоксию [25]. АП — наиболее показательный пример так называемой алиментарно-токсической ПН. Она относится к числу первичных аксонопатий, но по мере прогрессирования заболевания развивается также и демиелинизация.
Симптомами АП являются парестезии, крампи, боль и/или жжение в стопах и кистях, прогрессивно нарастающая слабость стоп и кистей, нарушения походки. Для токсической формы, связанной с прямым повреждающим действием этанола, характерны повреждение тонких волокон, хроническое прогрессирование. Это приводит к избирательной потере болевой или температурной чувствительности, парестезиям, дизестезиям, спонтанным болям при отсутствии парезов, нормальных сухожильных рефлексах. Развивается сенсорная или моторно-сенсорная нейропатия, сопровождающаяся болевым синдромом в 25–45% случаев [24].
При алиментарной форме, связанной с дефицитом тиамина, страдают тонкие и толстые волокна, что сопровождается острым или хроническим прогрессированием. Поражаются волокна глубокой чувствительности, что ведет к развитию сенситивной атаксии. Клинически определяются симметричная сенсорная или симметричная моторно-сенсорная нейропатия, боль наблюдается в 10–20% случаев [26].
Лечение полинейропатий
Лечение ДН и АП должно быть комплексным и предусматривать прежде всего воздействие на причину заболевания — коррекцию гликемии и отказ от употребления алкоголя. Так, по данным длительного проспективного мультицентрового исследования DCCT, коррекция гипергликемии позволяет снизить частоту ПН у больных СД 2–го типа на 60% [11].
Для коррекции осложнений ДН и АП применяется ряд дополнительных лекарственных препаратов. Применяют симптоматическую (антиконвульсанты, антидепрессанты из группы селективных ингибиторов захвата серотонина и норадреналина, трициклические антидепрессанты), патогенетическую (альфа-липоевая кислота, комплекс витаминов В) или комбинированную терапию [27]. Выбор эффективного и безопасного препарата для длительной терапии достаточно сложен.
Болевой синдром при ПН носит характер нейропатического, поэтому для его купирования широко используются антиконвульсанты. Высокой эффективностью отличается габапентин (Конвалис®). Конвалис® используют в качестве препарата первой линии симптоматической терапии, поскольку он эффективно снижает выраженную болевую симптоматику у большинства пациентов с нейропатической болью. Его отличает отсутствие лекарственных взаимодействий, гепатотоксичности и кардиотоксичности, он положительно влияет на качество жизни больных [28]. Адекватная титрация дозы позволяет улучшить переносимость препарата.
С целью нормализации метаболических процессов и воздействия на патогенетические механизмы развития заболевания при ДН и АП за рубежом и в нашей стране широко используются препараты α-липоевой (тиоктовой) кислоты (Октолипен®) [29]. Альфа-липоевая кислота улучшает энергетический метаболизм, нормализует аксональный транспорт, уменьшает окислительный стресс, ингибирует образование радикалов и восстанавливает мембрану нервной клетки, не оказывая при этом отрицательного воздействия на функцию печени. Кроме того, в экспериментах на животных показано, что α-липоевая кислота усиливает выделение фактора роста нерва, а также ускоряет рост нерва после его перерезки или сдавления [29]. Включение α-липоевой кислоты в лечение пациентов с ДН и АП способствует быстрому регрессу клинической симптоматики. Октолипен® показан при легкой и умеренной выраженности симптомов, также используется в комбинированной терапии при выраженном болевом синдроме.
В зависимости от клинических особенностей течения ПН α-липоевая кислота назначается либо парентерально, либо перорально. Эти лекарственные формы различаются по времени наступления эффекта и скорости снижения выраженности болевой симптоматики. Как правило, в клинической практике используют ступенчатую схему терапии – начинают с внутривенного введения в суточной дозе 600 мг на 2 нед., а в дальнейшем переходят на пероральную терапию – Октолипен® 300 мг по 2 капс./сут в течение 2 мес. Проведены многочисленные рандомизированные мультицентровые контролируемые исследования, показавшие высокую эффективность α-липоевой кислоты при лечении ДН, при этом отмечено значительное уменьшение степени выраженности таких симптомов сенсорной нейропатии, как боль, жжение, парестезии, онемение [30, 31].
В комплексной терапии ДН и АП используются витамины группы В (Комбилипен®). Роль препарата в лечении данной категории больных связана с прямым нейротропным действием [32, 33].
1. Витамин В1 воздействует на:
– проведение нервного импульса, обеспечение аксонального транспорта, определяющего регенерацию нервной ткани;
– модуляцию нервно-мышечной передачи;
– регуляцию «болевой» активности нерва;
– углеводный (в качестве главного коэнзима улучшает утилизацию глюкозы), белковый, липидный обмен.
2. Витамин В6 влияет на:
– обеспечение синаптической передачи (синтез нейромедиаторов дофамина, норадреналина, адреналина, гистамина);
– обеспечение процессов торможения в ЦНС (синтез гамма-аминомасляной кислоты).
3. Витамин В12 обеспечивает:
– синтез/восстановление миелиновой оболочки;
– анальгетический эффект (снижает синтез глутамата в ЦНС);
– гемо-/эритропоэз;
– синтез белка, углеводов, аминокислот, липидов.
Эффективность терапии АП комплексом витаминов группы В (В1, В6 и В12) была продемонстрирована в многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании: отмечались улучшение вибрационной чувствительности и функции проведения по чувствительным волокнам, уменьшение выраженности боли [34].
В систематическом обзоре Cochrane 2008 г., включившем 30 клинических исследований и 741 пациента с ДН и АП, опубликованы данные об эффективности применения витаминов группы В [32]. В одном исследовании продемонстрировано улучшение вибрационной чувствительности, другие работы показали, что высокие дозы комплекса витаминов группы В в сравнении с меньшими дозами приводят к значимому облегчению боли и уменьшению выраженности парестезий. Некоторые исследователи не наблюдали значимого влияния на боль. Был сделан вывод, что количество рандомизированных исследований эффективности терапии ДН и АП витаминами группы В ограниченно, недостаточно данных для того, чтобы сделать вывод об исключительно высокой эффективности этого препарата. Во всех работах отмечен факт хорошей переносимости пациентами с ДН и АП витаминов группы В [32, 34]. Отечественными авторами были предприняты исследования, показавшие эффективность комплекса витаминов В в лечении ДН и АП. Применение комплексных подходов к терапии ДН, в т. ч. включающих назначение витаминов группы В (к которым относится Комбилипен®), непосредственно влияющих на патогенез заболевания, позволяет не только уменьшить выраженность клинических проявлений СД, но и предотвратить развитие ряда диабетических осложнений и улучшить качество жизни пациентов, что подтверждается реальной клинической практикой. Так, в Москве в период с 1999 по 2011 г. количество случаев высоких ампутаций конечностей снизилось на 48%, ампутаций на уровне ниже бедра – на 16% [35]. Схема применения препарата Комбилипен® в клинической практике складывается из парентерального введения и перорального приема: вначале назначают внутримышечно по 2 мл 1 р./сут на 10 дней, затем переходят на таблетированную форму – Комбилипен® табс по 1 табл. 2 р./сут на 3 нед. В состав лечебного комплекса Комбилипен® табс входят витамины группы В (бенфотиамин, пиридоксин и цианокобаламин).
Заключение
Следует отметить, что распространенность ПН в настоящее время весьма высока. Наиболее часто встречаемые в практике формы ПН – диабетическая и алкогольная – стали не только медицинской, но и социальной проблемой. В связи с этим при формировании терапевтической стратегии нужно учитывать индивидуальные особенности пациента, выраженность основного заболевания, болевой симптоматики, степень неврологического дефицита, наличие сопутствующих заболеваний. Комплексное применение препаратов для симптоматической и патогенетической терапии повышает эффективность лечения и улучшает клиническое состояние пациентов [36].
Источник
