Аутоиммунный синдром код мкб
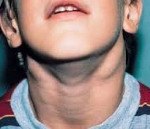
Аутоиммунный полиэндокринный синдром 1 типа
Аутоиммунный полиэндокринный синдром 1 типа (МКБ-10: E31.0) относится к группе заболеваний (аутоиммунные полиэндокринные синдромы), связанных с поражением нескольких эндокринных органов собственными клетками организма (аутоиммунный механизм). Клинические проявления зависят от того, какие органы преимущественно вовлечены в патологический процесс и каким образом нарушена секреция гормонов.
Аутоиммунный полиэндокринный синдром 1 типа имеет целый ряд других названий в литературе:
- Синдром кандидоза-энтеропатии;
- Синдром полигландулярной недостаточности 1 типа;
- APECED — Autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy/dysplasia;
- Синдром MEDAC = Multiple Endocrine Deficiency, Autoimmune, Candidiasis;
- Autoimmune polyendocrine syndrome type 1 или Autoimmune polyglandular syndrome type 1 (APS-1).
Классический APECED-синдром включает в себя сочетание трех основных патологий: поражения кожи и слизистых оболочек грибками рода Candida (кандидоз), недостаточность функции паращитовидных желез (гипопаратиреоз) и недостаточность функции надпочечников (болезнь Аддисона). В то же время в большинстве случаев встречается сочетание только двух синдромов из триады (например, кандидоз и надпочечниковая недостаточность). Могут встречаться и другие симптомы, связанные с аутоиммунным поражением различных органов и систем (сахарный диабет 1 типа, анемия, кератоконъюнктивит, нарушения всасывания в тонком кишечнике, недостаточность функции половых желез).
В 1849 г. английский врач Томас Аддисон (Thomas Addison) описал симптомы, обусловленные надпочечниковой недостаточностью, у пациентов, имевших также признаки пернициозной анемии (впоследствии хроническую недостаточность коры надпочечников назвали болезнью Аддисона). В 1929 г. его соотечественники Торп и Хендли (E. S. Thorpe, H. E. Handley) выявили случай сочетания эндокринной недостаточности и кандидоза слизистых оболочек и кожи у 4,5-летней девочки.
Сам синдром полигландулярной недостаточности 1 типа был впервые описан в 1960-1980-е гг. Р. Близзардом (R. M. Blizzard) и Мишелем Нойфельдом (Michel Neufeld), наблюдавшими проявления заболевания у детей раннего возраста.
Распространенность и тип наследования
Синдром APECED — очень редкое заболевание, оценить его частоту крайне сложно. В то же время известно, что заболеваемость выше в относительно изолированных популяциях. Так, распространенность APECED в Финляндии составляет 1 случай на 25 000 человек, на Сардинии – 1 случай на 14 000, среди иранских евреев – 1 случай на 9 000. Для сравнения: в США в настоящее время описано всего 16 случаев заболевания.
Соотношение женщин и мужчин при этом, по разным оценкам, составляет от 0,8:1 до 2,5:1.
Заболевание чаще проявляется у детей 3-5 лет или ранних подростков и связано с появлением признаков эндокринных заболеваний, кандидоза, нарушениями роста и развития.
Болезнь наследуется по аутосомно-рецессивному типу.
Основные проявления классического APECED-синдрома связаны с явлениями кандидозного поражения кожи и слизистых, проявлениями гипопаратиреоза (различные варианты судорог, энцефалопатия, отек зрительного нерва) и надпочечниковой недостаточности (слабость, утомляемость, анорексия, тошнота, рвота, диарея, снижение массы тела). Также могут наблюдаться симптомы, связанные с поражением других органов и систем.
Синдром APECED диагностируется на основании следующих данных:
- клинико-анамнестические данные;
- снижение уровня гормонов щитовидной железы, гормонов гипофиза, гормонов надпочечников и половых желез;
- наличие аутоантител к собственным антигенам эндокринных органов (отсутствие аутоантител не исключает диагноза APECED);
- метаболические нарушения (дисбаланс электролитов крови, глюкозы, альбумина);
- грибковое поражение кожи и слизистых оболочек;
- изменения в общем анализе крови, характерные для анемии.
В качестве дополнительных исследований могут проводиться ультразвуковое сканирование, магнитно-резонансная или компьютерная томография, эндоскопические исследования, гистологические исследования.
Генетическое тестирование может использоваться для подтверждения конкретной формы аутоиммунного полиэндокринного синдрома.
Терапия APECED зависит от того, какие системы органов и насколько вовлечены в патологический процесс. Поэтому основные направления лечения включают коррекцию гормональных нарушений, в том числе инсулинотерапию при сахарном диабете 1 типа, противогрибковую терапию. Для подавления аутоиммунного воспаления проводится иммуносупрессивная терапия. Помимо этого, пациентам назначают препараты, содержащие витамин D и кальций, для коррекции гипопаратиреоза. Также проводится нутритивная поддержка (обеспечение адекватного питания с помощью специальных методов), добавление витаминов и микроэлементов в рацион больного.
Поскольку заболевание является врожденным, первичная профилактика невозможна. В то же время, вторичная профилактика предполагает коррекцию текущего состояния и предотвращение обострений.
Основа синдрома полигландулярной недостаточности любого типа – развитие аутоиммунного воспаления, поражающего эндокринные железы. При этом могут вырабатываться аутоантитела (антитела, направленные против собственных антигенов организма):
- антитела к поверхностным рецепторам клеток;
- антитела к внутриклеточным ферментам;
- антитела к секретируемым белкам, в частности к гормонам.
В настоящее время не вполне ясен вклад каждого типа аутоантител в развитие заболевания. У пациентов с синдромом APECED также описано наличие аутоантител к цитокинам (регуляторные вещества пептидной природы), выделяемым Т-лимфоцитами. По-видимому, это связано с нарушением иммунного ответа против грибков рода Candida.
В настоящее время доказана зависимость APECED-синдрома от дефектов в гене AIRE, расположенном в 21-й хромосоме и кодирующем белок-аутоиммунный регулятор AIRE. Этот белок относится к группе транскрипционных факторов и синтезируется в основном в мозговом веществе тимуса. AIRE связан с механизмами удаления Т-лимфоцитов, которые могут быть активны против собственных клеток организма (аутореактивные Т-лимфоциты), и обеспечением иммунной толерантности. Мутации в гене AIRE приводят к нарушению иммунной регуляции и развитию аутоиммунных процессов.
Развитие APECED-синдрома в настоящее время связывают с мутациями в гене AIRE (21-я хромосома).
База данных OMIM содержит данные о 11 наиболее значимых мутациях в гене AIRE, база ClinVar описывает 240 вариантов этого гена, 92 из которых отнесены к патологическим.
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Классификация
- Симптомы
- Диагностика
- Лечение
- Прогноз
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Аутоиммунный лимфопролиферативный синдром.

Аутоиммунный лимфопролиферативный синдром
Описание
Аутоиммунный лимфопролиферативный синдром. Группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS — обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Дополнительные факты
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме. Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.
Аутоиммунный лимфопролиферативный синдром
Причины
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки. При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС. Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку. Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A. Вызвана мутацией гена TNFRSF6, расположенного на 10 — й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно — доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В. Обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m Ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2. Вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки — каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3. Мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4. Обусловлена мутацией гена NRAS, также кодирующего белки — передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Увеличение паховых лимфоузлов. Увеличение подмышечных лимфоузлов. Увеличение шейных лимфоузлов. Эозинофилия.
Диагностика
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия. Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие. При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
- Включены: дефекты в системе комплемента, иммунодефицитные расстройства, за исключением болезни, вызванной вирусом иммунодефицита человека ВИЧ, саркоидоз.
- Исключены: аутоиммунные болезни (системные) БДУ (M35.9), функциональные нарушения полиморфно-ядерных нейтрофилов (D71), болезнь, вызванная вирусом иммунодефицита человека [ВИЧ] (B20 — B24)
- D80 Иммунодефициты с преимущественной недостаточностью антител
- D80.0 Наследственная гипогаммаглобулинемия. Аутосомная рецессивная агаммаглобулинемия (швейцарский тип). Сцепленная с Х-хромосомой агаммаглобулинемия [Брутона], (с дефицитом гормона роста).
- D80.1 Несемейная гипогаммаглобулинемия. Агаммаглобулинемия с наличием В-лимфоцитов, несущих иммуноглобулины. Общая агаммаглобулинемия [CV Agamma]. Гипогаммаглобулинемия БДУ
- D80.2 Избирательный дефицит иммуноглобулина А IgA
- D80.3 Избирательный дефицит подклассов иммуноглобулина G IgG
- D80.4 Избирательный дефицит иммуноглобулина М IgM
- D80.5 Иммунодефицит с повышенным содержанием иммуноглобулина M (IgM)
- D80.6 Недостаточность антител с близким к норме уровнем иммуноглобулинов или с гипериммуноглобулинемией. Дефицит антител с гипериммуноглобулинемией.
- D80.7 Преходящая гипогаммаглобулинемия детей
- D80.8 Другие иммунодефициты с преимущественным дефектом антител. Дефицит каппа-лёгких цепей
- D80.9 Иммунодефицит с преимущественным дефектом антител неуточнённый
- D81 Комбинированные иммунодефициты.
- Исключена: аутосомная рецессивная агаммаглобулинемия (швейцарский тип) (D80.0)
- D80.0 Тяжёлый комбинированный иммунодефицит с ретикулярным дисгенезом
- D80.1 Тяжёлый комбинированный иммунодефицит с низким содержанием Т-и В-клеток
- D80.2 Тяжёлый комбинированный иммунодефицит с низким или нормальным содержанием В-клеток
- D80.3 Дефицит аденозиндезаминазы.
- D80.4 Синдром Незелофа
- D80.5 Дефицит пуриннуклеозидфосфорилазы
- D80.6 Дефицит молекул класса I главного комплекса гистосовместимости. Синдром «лысых лимфоцитов»
- D80.7 Дефицит молекул класса II главного комплекса гистосовместимости
- D80.8 Другие комбинированные иммунодефициты. Дефицит биотинзависимой карбоксилазы
- D80.9 Комбинированный иммунодефицит неуточнённый. Тяжёлое комбинированное иммунодефицитное расстройство БДУ
- D82 Иммунодефициты, связанные с другими значительными дефектами.
- Исключена: атаксия-телеангиэктазия (синдром Луи-Бар) (G11.3)
- D82.0 Синдром Вискотта-Олдрича (Wiscott-Aldrich syndrome). Иммунодефицит с тромбоцитопенией и экземой
- D82.1 Синдром Ди Георга (Di George syndrome). Синдром дивертикула глотки. Вилочковой железы: алимфоплазия, аплазия или гипоплазия с иммунной недостаточностью.
- D82.2 Иммунодефицит с карликовостью за счёт коротких конечностей
- D82.3 Иммунодефицит вследствие наследственного дефекта, вызванного вирусом Эпштейна-Барр. Сцепленная с Х-хромосомой лимфопролиферативная болезнь
- D82.4 Синдром гипериммуноглобулина Е IgE
- D82.8 Иммунодефицит, связанный с другими уточнёнными значительными дефектами
- D82.9 Иммунодефицит, связанный со значительным дефектом, неуточнённый
- D83 Обычный вариабельный иммунодефицит
- D83.0 Общий вариабельный иммунодефицит с преобладающими отклонениями в количестве и функциональной активности В-клеток
- D83.1 Общий вариабельный иммунодефицит с преобладанием нарушений иммунорегуляторных Т-клеток
- D83.2 Общий вариабельный иммунодефицит с аутоантителами к В- или Т-клеткам
- D83.8 Другие общие вариабельные иммунодефициты.
- D83.9 Общий вариабельный иммунодефицит неуточнённый
- D84 Другие иммунодефициты
- D84.0 Дефект функционального антигена-1 лимфоцитов [LFA-1]
- D84.1 Дефект в системе комплемента. Дефицит Cl ингибитора эстеразы (C1-INH)
- D84.8 Другие уточнённые иммунодефицитные нарушения
- D84.9 Иммунодефицит неуточнённый
- D86 Саркоидоз
- D86.0 Саркоидоз лёгких
- D86.1 Саркоидоз лимфатических узлов
- D86.2 Саркоидоз лёгких с саркоидозом лимфатических узлов
- D86.3 Саркоидоз кожи
- D86.8 Саркоидоз других уточнённых и комбинированных локализаций. Иридоциклит при саркоидозе (H22.l), Множественные параличи черепных нервов при саркоидозе (G53.2), Саркоидная(ый): артропатия (M14.8), миокардит (I41.8), миозит (M63.3). Увеопаротитная лихорадка болезнь Герфордта
- D86.9 Саркоидоз неуточнённый
- D89 Другие нарушения с вовлечением иммунного механизма, не классифицированные в других рубриках.
- Исключены: гиперглобулинемия БДУ (R77.1), моноклональная гаммапатия (D47.2) неприживление и отторжение трансплантата (T86.-)
- D89.0 Поликлональная гипергаммаглобулинемия. Гипергаммаглобулинемическая пурпура. Поликлональная гаммапатия БДУ
- D89.1 Криоглобулинемия. Криоглобулинемия: эссенциальная, идиопатическая, смешанная, первичная, вторичная, Криоглобулинемическая(ий): пурпура, васкулит
- D89.2 Гипергаммаглобулинемия неуточнённая
- D89.8 Другие уточнённые нарушения с вовлечением иммунного механизма, не классифцированные в других рубриках
- D89.9 Нарушение, вовлекающее иммунный механизм, неуточнённое. Иммунная болезнь БДУ
Источник
