Аутоиммунный гепатит код мкб
Рубрика МКБ-10: K75.4
МКБ-10 / K00-K93 КЛАСС XI Болезни органов пищеварения / K70-K77 Болезни печени / K75 Другие воспалительные болезни печени
Определение и общие сведения[править]
Аутоиммунный гепатит
Аутоиммунный гепатит (АИГ) — это хроническое воспалительно-некротическое заболевание печени невыясненной этиологии с аутоиммунным патогенезом и прогрессирующим течением, с исходом в криптогенный цирроз печени и исключением вирусных, алкогольных и лекарственных поражений печени, а также аутоиммунных холестатических заболеваний (первичный билиарный цирроз — ПБЦ и первичный склерозирующий холангит — ПСХ), гепатоцеребральной дистрофии (болезнь Вильсона) и поражения печени при гемохроматозе и врожденном дефиците а1-антитрипсина.
АИГ протекает только как хроническое заболевание, поэтому, согласно Международной классификации хронических гепатитов (Лос-Анджелес, 1994), его обозначают как «аутоиммунный гепатит» без определения «хронический».
По мнению авторитетного гепатолога A.J. Czaja, «АИГ — это неразрешившийся воспалительный процесс в печени неизвестной этиологии».
Распространенность
АИГ — сравнительно редкое заболевание. Частота выявления АИГ варьирует в широких пределах: от 2,2 до 17 случаев на 100 тыс. населения в год. Среди больных АИГ существенно преобладают женщины (до 80%). АИГ впервые диагностируют в любом возрасте, но наблюдаются два возрастных «пика» заболевания: в 20-30 и 50-70 лет.
Этиология и патогенез[править]
Этиология АИГ до сих пор не выяснена.
Патогенез
Патогенез АИГ связан с процессами аутоиммунизации. Аутоиммунизация обусловлена реакцией иммунной системы на тканевые антигены. Она проявляется синтезом аутоантител и появлением сенсибилизированных иммунокомпетентных клеток — лимфоцитов.
Синонимами термина «аутоиммунизация» являются:
• «аутосенсибилизация»;
• «аутоагрессия»;
• «аутоаллергия».
При АИГ существует напряженное равновесие между аутоагрессией и толерантностью.
Клинические проявления[править]
Общие клинические симптомы: быстрая утомляемость; мышечные и суставные боли (миалгии, артралгии); снижение работоспособности; иногда — субфебрилитет.
Дополнительные симптомы АИГ: неприятные ощущения (дискомфорт) в правом подреберье и эпигастрии; снижение аппетита; тошнота; аменорея (у женщин).
Объективные данные: гепато- и спленомегалия; телеангиэктазии; пальмарная эритема; на определенном этапе — желтуха.
Специфических для АИГ клинических симптомов не существует.
Выделяют 3 типа АИГ:
• АИГ 1-го типа — это «классический» вариант болезни; страдают преимущественно молодые женщины. Встречается в 70-80% всех случаев АИГ. Отмечается высокий эффект иммуносупрессивной терапии. Через 3 года развитие ЦП наблюдается не чаще, чем у 40-43% больных АИГ. Для 1-го варианта АИГ характерны: гипер- γ -глобулинемия, высокая СОЭ, наличие в крови антинуклеарных (ANA) и антигладкомышечных SМА) антител. Основным аутоантигеном при АИГ 1-го типа является специфический печеночный протеин (liver specific protein — LSP), — именно он становится мишенью для аутоиммунных реакций.
• АИГ 2-го типа развивается чаще всего в детстве (второй «пик» заболеваемости встречается в 35-65 лет). Чаще болеют девочки (60%). Болезнь, как правило, протекает неблагоприятно, с высокой активностью патологического процесса в печени. Нередко наблюдается фульминантное течение АИГ с быстрым формированием ЦП: через 3 года у 82% больных. Иммуносупрессивная терапия часто недостаточно эффективна. В крови у больных в 100% случаев обнаруживают аутоантитела к микросомам печени и почек 1-го типа (liver-kidney microsomes — LKM1).
• АИГ 3-го типа в последнее время рассматривают как несамостоятельную форму болезни. Возможно, это — атипичный вариант АИГ 1-го типа. Болеют в основном молодые женщины. В крови у больных определяют присутствие аутоантител типа SLA/LP, однако в 84% случаев обнаруживают также аутоантитела ANA и SМА, характерные для АИГ 1-го типа.
Считаем необходимым еще раз отметить, что образование аутоантител при АИГ не относится к проявлениям иммунной реактивности. Их следует рассматривать не как патогенетический фактор поражения печени при АИГ, а как его следствие. Определение аутоантител к структурным элементам печени имеет в основном не патогенетическое, а сугубо диагностическое значение.
При морфологическом исследовании ткани печени (биопсия) у больных АИГ выявляют:
• густую мононуклеарную (лимфоплазмоцитарную) воспалительную инфильтрацию перипортальных полей с нарушением границ печеночных долек и целостности пограничной пластинки;
• проникновение клеточных воспалительных инфильтратов в дольки печени с образованием ступенчатых, лобулярных и мостовидных некрозов.
При этом основную массу клеточных инфильтратов составляют Т-лимфоциты (главным образом СД4+-хелперы-индукторы и в меньшей степени — СД8+-супрессоры, обладающие цитотоксическим эффектом), но эти изменения нельзя назвать строго специфичными для АИГ.
Аутоиммунный гепатит: Диагностика[править]
Лабораторные данные. В крови у больных АИГ определяют: повышенный уровень аминотрансфераз (АлАТ, АсАТ): в 5-10 раз; гипер- γ -глобулинемию: в 1,5-2 раза; повышенное содержание иммуноглобулинов, особенно IgG; высокую СОЭ (до 40-60 мм/ч). Иногда (при холестатическом варианте АИГ) умеренно повышается содержание ЩФ (щелочная фосфатаза ) и у-ГТП (гамма-глутамилтранспептидаза).
В терминальной стадии АИГ развивается криптогенный цирроз печени (ЦП) с явлениями портальной гипертензии, отечно-асцитическим синдромом, варикозным расширением вен пищевода и желудка и кровотечением из них; печеночной энцефалопатией и комой.
В диагностике АИГ необходимо повторное (обязательно!) обнаружение в крови аутоантител к тканям печени в высоких концентрациях (более 1:80) с одновременным повышением (в 5-10 раз) уровня аминотрансфераз (АлАТ, АсАТ). При этом определяют наличие аутоантител:
• к микросомам печени и почек 1-го типа (LKM1);
• к ядрам гепатоцитов (ANA);
• к гладкомышечным элементам печени (SMA);
• к растворимому печеночному антигену (SLA/LP);
• к печеночному специфическому протеину (LSP) и др.
Типичными маркерами АИГ являются также антигены гистосовместимости системы HLA: В8, DR3 и DR4, особенно среди населения европейских стран (иммуногенетический фактор).
В последнее время установлено высокое диагностическое значение при АИГ обнаружения в крови антинейтрофильных цитоплазматических антител Р-типа (атипичных-p-ANCА), выявляемых методом непрямой иммунофлуоресцентной микроскопии, — их определяют у больных АИГ в 81% случаев [27].
Для выявления в крови циркулирующих аутоантител используют реакции: преципитации; пассивной гемагглютинации; связывания комплемента и флуоресценции.
Наличие клеточной сенсибилизации определяют реакцией бласт-трансформации лимфоцитов (рБТЛ) и ингибиции миграции лейкоцитов (ИМЛ).
Диагноз АИГ — это диагноз исключения.
Международная группа по изучению АИГ разработала балльную систему оценки диагностических критериев, облегчающую распознавание АИГ. Критерии диагностики АИГ включают следующие пункты, оцениваемые в баллах:
• пол (преимущественно женский);
• биохимический иммуновоспалительный синдром (повышенный уровень иммуноглобулинов, особенно IgG; повышенная реакция БТЛ на ФГА и др.);
• гистологические изменения (воспалительные инфильтраты; ступенчатые некрозы и др.);
• высокий титр противопеченочных аутоантител (ANA, SМА, LKM1 и др.: более 1:80);
• гипер- γ -глобулинемию;
• наличие характерных для АИГ гаплотипов системы HLA (B8, DR3, DR4);
• эффект иммуносупрессивной терапии.
При достоверном диагнозе АИГ количество баллов превышает 17; при вероятном АИГ — варьирует от 12 до 17.
В части случаев АИГ может сочетаться с другими заболеваниями аутоиммунной природы: с первичным билиарным циррозом (ПБЦ) или с первичным склерозирующим холангитом (ПСХ), что получило наименование «перекрестный синдром» (overlap syndrome)
Дифференциальный диагноз[править]
При предполагаемом диагнозе АИГ необходимо доказать:
• отсутствие маркеров вирусных гепатитов (В, С и D);
• отсутствие (в анамнезе) указаний на переливание крови;
• отсутствие хронического злоупотребления алкоголем (для выявления больных, скрывающих злоупотребление алкоголем, используют опросники CAGE, FAST и др.);
• отсутствие указаний на длительный прием гепатотропных лекарств (НПВС; парацетамол; тетрациклин, антиметаболиты; изониазид, галотан и др.).
Аутоиммунный гепатит: Лечение[править]
При всех типах АИГ основой лечения является иммуносупрессивная терапия. Цель лечения: достижение полной клинической и биохимической ремиссии.
Важно подчеркнуть: АИГ нужно лечить! — это продлевает жизнь и улучшает качество жизни больных. По существу, это — терапия спасения и сохранения жизни.
Прежде всего для лечения АИГ используют препараты глюкокортикостероидов: преднизолон, метилпреднизолон, будесонид.
Преднизолон назначают в первоначальной дозе 1мг/кг массы тела в сутки с постепенным, но относительно быстрым снижением дозы. Начинают обычно с дозы 60-80 мг/сут с последующим ее уменьшением на 10 мг/нед — до 30 мг/сут, а затем дозу преднизолона снижают на 5 мг/нед — до поддерживающей: 5-10 мг/сут, которую продолжают принимать непрерывно в течение 2-4 лет.
При сомнительном («вероятном») диагнозе АИГ рекомендуется «пробный курс лечения» преднизолоном в дозе 60 мг/сут в течение 7 дней. При наличии положительного клинического эффекта и снижении лабораторных показателей активности иммуновоспалительного процесса (отчетливое уменьшение уровня аминотрансфераз — АсАТ, АлАТ, гипер- γ -глобулинемии и т.п.) предполагаемый диагноз АИГ подтверждается (диагноз ex juvantibus).
В случаях, когда вскоре после окончания курса глюкокортикоидной терапии наблюдается повторное повышение уровня аминотрансфераз (АсАТ, АлАТ), рекомендуется назначение (дополнительно к преднизолону) цитостатика азатиоприна (производное 6-меркаптопурина) в дозе 1 мг/кг массы тела в сут. Азатиоприн обладает антипролиферативной активностью. Оба препарата (преднизолон и азатиоприн) потенцируют действие друг друга. Вместе с тем большинство авторов считает, что не следует использовать азатиоприн в качестве монотерапии АИГ. Побочные эффекты азатиоприна: лейкопения; риск развития злокачественных опухолей.
При сочетанном лечении АИГ 1-го типа преднизолоном и азатиоприном клинико-лабораторная ремиссия достигается в 90% случаев.
Метилпреднизолон используется как альтернатива преднизолону; его применение предпочтительнее, так как сопровождается меньшим количеством побочных эффектов в связи с отсутствием у метипреда минералкортикоидной активности. При расчете дозы учитывают, что 24 мг метипреда соответствует 30 мг преднизолона.
Новый глюкокортикоидный препарат будесонид назначают при АИГ в дозе 6-9 мг/сут внутрь. Поддерживающая доза составляет 2-6 мг/сут; курс лечения — 3 мес.
При длительном лечении АИГ преднизолоном и азатиоприном в адекватных дозах (20 и более лет) удается в ряде случаев достичь продолжительной клинико-лабораторной ремиссии, способствующей сохранению нормального образа жизни при минимальных побочных эффектах, а также избежать или надолго отсрочить операцию трансплантации печени.
Вместе с тем при недостаточно обоснованном прекращении курса лечения АИГ иммуносупрессорами уже через 6 мес возникает рецидив у 50% больных, а через 3 года — у 80%.
Помимо иммуносупрессивной терапии, в лечении АИГ используют ряд вспомогательных фармакологических средств.
Циклоспорин А — высокоактивный ингибитор фосфатазной активности кальцийнейрина. Являясь селективным блокатором Т-клеточного звена иммунного ответа, циклоспорин А подавляет активность цитокинового «каскада», но дает много побочных эффектов (хроническая почечная недостаточность; артериальная гипертензия; повышенный риск злокачественных опухолей). Доза циклоспорина А подбирается индивидуально: внутрь по 75-500 мг 2 раза в день; внутривенно капельно — по 150-350 мг/сут.
Такролимус — ингибитор рецептора ИЛ-2. Часть авторов считают такролимус «золотым стандартом» в лечении АИГ, так как он нарушает цикл клеточной пролиферации, прежде всего цитотоксических Т-лимфоцитов. При назначении такролимуса наблюдается отчетливое снижение уровня аминотрансфераз (АсАТ, АлАТ), улучшается гистологическая картина печеночной ткани (биопсия).
Особенно высокий эффект лечения АИГ такролимусом отмечен при его назначении после отмены глюкокортикоидов. Доза: 2 мг 2 раза в день в течение 12 мес. Побочные эффекты не описаны.
Циклофосфамид (из группы цитостатиков) используется в основном для поддерживающей терапии АИГ в дозе 50 мг/сут (через день) в сочетании с преднизолоном 5-10 мг/сут длительно.
Значительный интерес представляет новый препарат микофенолата мофетин, являющийся мощным иммуносупрессором. Кроме того, он подавляет пролиферацию лимфоцитов за счет нарушения синтеза пуриновых нуклеотидов. Рекомендуется при резистентных к иммуносупрессивной терапии формах АИГ. По эффективности превосходит такролимус. Применяется в дозе 1 мг/кг 2 раза в день длительно, только вместе с преднизолоном.
Препараты урсодезоксихолевой кислоты используют в основном при АИГ, протекающем с признаками внутрипеченочного холестаза (гипербилирубинемия, кожный зуд, желтуха, повышенный уровень холестатических ферментов — ЩФ (щелочная фосфатаза ), у-ГТП (гамма-глутамилтранспептидаза), ЛАП (лейцинаминопептидаза).
Адеметионин играет в лечении АИГ вспомогательную роль. Адеметионин синтезируется из метионина и аденозина; участвует в процессах трансметилирования и транссульфатирования; обладает детоксицирующим, антиоксидантным и антихолестатическим эффектами; уменьшает проявления астенического синдрома; снижает выраженность биохимических сдвигов при АИГ.
Начинают лечение с внутримышечного или внутривенного (очень медленно!) введения в дозе 400-800 мг, 2-3 нед с последующим переходом на прием внутрь: 800-1600 мг/день в течение 1,5-2 мес.
При отсутствии эффекта иммуносупрессивной терапии, обычно в терминальной стадии АИГ и формировании ЦП (цироз печени), возникает необходимость в трансплантации печени.
По данным Европейского регистра трансплантации печени (1997), выживаемость больных АИГ после трансплантации печени: до 1 года — 75%, до 5 лет — 66% .
У 10-20% больных АИГ трансплантация печени — это единственный способ продления жизни.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Гастроэнтерология [Электронный ресурс] : руководство / Я. С. Циммерман. — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2015. — https://old.rosmedlib.ru/book/ISBN9785970432730.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
Содержание
- Синонимы диагноза
- Описание
- Причины
- Патогенез
- Симптомы
- Диагностика
- Лечение
Другие названия и синонимы
Люпоидный гепатит.
Названия
Аутоиммунный гепатит.

Особенности лечения аутоиммунного гепатита
Синонимы диагноза
Люпоидный гепатит.
Описание
Аутоиммунный гепатит (АИГ) представляет собой хроническое иммунно-опосредованное заболевание печени, характеризующееся развитием воспаления, фиброза, цирроза , в ряде случаев печеночной недостаточности.
Выделение АИГ в группе хронических заболеваний печени обусловлено существованием хронического гепатита с яркой системностью поражения и выработкой широкого спектра сывороточных аутоантител. Первое описание АИГ относится к 1950 году. У 6 молодых женщин отмечались “сосудистые звездочки”, высокие показатели СОЭ, хороший эффект от лечения гормональными препараты. В конце 60-х годов -начале 70-х годов проведены ряд исследований, показывающих высокую эффективность терапии гормонами и азатиоприном при АИГ.
Причины
Этиология данного заболевания неизвестна.
Распространенность. АИГ относится к редким заболеваниям: в Европе и Северной Америке заболеваемость составляет от 50 до 200 случаев на 1 млн населения. По данным европейской и североамериканской статик, больные аутоиммунным гепатитом составляют до 20 % всех больныххроническим гепатитом. В Японии АИГ диагностируется в 85 % всехслучаев хронического гепатита.
Патогенез
Болеют преимущественно женщины в молодом возрасте. Соотношение женщин и мужчин среди заболевших 8:1. Для аутоиммунного гепатита характерна тесная связь с рядом антигенов главного комплекса гистосовместимости (МНС; HLA у человека), участвующих в иммунорегуляторных процессах. В частности, ассоциированы аллели HLA DR3, Al, В8, DR4, DQ2, В14, C4AQ0. Имеются доказательства о значении дефекта транскрипционного фактора (AIRE-1) в развитии аутоиммунного гепатита (предполагается его роль в формировании и поддержании иммунологической толерантности). В связи с тем, что аутоиммунный гепатит развивается не у всех носителей указанных ваше аллелей, обсуждается роль дополнительных триггерных (пусковых) факторов, запускающих аутоиммунный процесс, среди которых вирусы гепатита А, В, С, герпеса (HHV-6 и HSV-1), Эпштейна-Барр, реактивные метаболиты лекарственных препаратов и Сущность патологического процесса сводится к дефициту иммунорегуляции. У больных, как правило, наблюдается снижение Т-супрессорной субпопуляции лимфоцитов, позже в крови и тканях появляются антиядерные антитела к гладким мышцам, к специфическому липопротеиду печени. Частое обнаружение LE-клеточного феномена с наличием выраженных системных (внепеченочных) поражений, свойственных системной красной волчанке, дало основание J. Mackay назвать это заболевание «люпоидным гепатитом».
Симптомы
Проявления АИГ варьируют от тяжелого острого гепатита, хронического гепатита различной степени тяжести и выраженности воспалительной активности в печени до атипично протекающих наблюдений. У 50% выявляются лишь лабораторные признаки хронического гепатита, у 30% больных при первом обследовании выявляется цирроз печени, а у 20-40% внепеченочные проявления.
Начало заболевания, как правило, с неспецифических симптомов: слабости, тошноты, желтухи, болей в животе, болей в суставах. 30-40% больных демонстрируют острое начало заболевания по типу острого вирусного или токсического гепатита с выраженной желтухой, при несвоевременном лечении может развиться печеночная недостаточность с необходимостью неотложной пересадки печени.
Гипербилирубинемия. Горький привкус во рту. Жажда. Истощение. Кал желтого цвета. Кал серовато-белого цвета. Недомогание. Отсутствие аппетита. Постоянная жажда. Привкус во рту. Слабость. Тошнота. Увеличение СОЭ.
Диагностика
В диагностике аутоиммунного гепатита имеет значение определение таких маркеров, как антинуклеарные антитела (ANA), антитела к микросомам печени и почек (анти-LKM), антитела к гладкомышечным клеткам (SMA), растворимым печеночным (SLA) и печеночно-панкреатическим (LP) антигенам, асиало-гликопротеин к рецепторам (печеночному лектину) и антигенам плазматической мембраны гепатоцитов (LM).
Международная группа по изучению аутоиммунного гепатита (1993) опубликовала диагностические критерии этого заболевания, выделив диагнозы определенного и вероятного аутоиммунного гепатита.
Для постановки определенного диагноза необходимо отсутствие в анамнезе гемотрансфузий, приема гепатотоксических лекарств, злоупотребления алкоголем; отсутствие сывороточных маркеров активной вирусной инфекции; уровни у-глобулинов и IgG, более чем в 1,5 раза превышающие нормальные; титры ANA, SMA и LKM-1 1:88 для взрослых и выше 1: 20 для детей; значительное повышение активности АсАТ, АлАТ и менее выраженное повышение щелочной фосфатазы.
Как известно, у 95 % больных ПБЦ определение AM А представляет собой главный серологический диагностический маркер заболевания. У оставшейся части больных с характерными клинико-биохимическими и гистологическими признаками ПБЦ АМА не выявляются. При этом, по данным ряда авторов, нередко обнаруживаются ANA (до 71 %), SMA (до 37 %) и другие аутоантитела. До настоящего времени не сформировалось единого мнения, которое позволило бы отнести эту патологию к той или иной нозологической форме. Наиболее часто данный синдром обозначают как аутоиммунный холангит, течение которого лишено специфических черт, что дает основания для предположения о возможной секреции АМА в допороговой концентрации.
Истинный перекрестный синдром или АИГ/ПБЦ характеризуется смешанной картиной обоих заболеваний и наблюдается у 9 % от общего числа больных ПБЦ. У больного с доказанным ПБЦ диагноз перекрестного синдрома устанавливают при наличии не менее двух из четырех следующих критериев:
АлАТ не менее 5 норм,.
IgG не менее 2 норм.
SMA в диагностическом титре (> 1: 40).
Перипортальные ступенчатые некрозы в биоптате,.
Имеется четкая ассоциация синдрома АИГ/ПБЦ с HLA В8, DR3 и DR4. В сыворотке определяются разнообразные аутоантитела с наиболее типичной комбинацией в виде АМА, ANA и SMA. Частота выявления АМА у больных АИГ, по данным некоторых авторов, составляет 25 %, однако их титр обычно не достигает диагностического значения. Кроме того, АМА при АИГ, как правило, не обладают специфичностью для ПБЦ, хотя в 8 % случаев наблюдается выработка типичных антител к антигену внутренней мембраны митохондрий М2. Следует отметить возможность ложнопозитивного результата анализа на АМА при применении метода непрямой иммуиофлюоресценции ввиду сходной флюоресцентной картины с анти-LKM-l.
В то время как комбинация АИГ и ПБЦ встречается в основном У взрослых пациентов, перекрестный синдром (АИГ/ПСХ) наблюдается преимущественно в педиатрической практике, хотя описаны случаи заболевания и у взрослых. Начало АИГ/ПСХ обычно проявляется клинико-биохимическими признаками АИГ с последующим присоединением симптомов ПСХ. Спектр сывороточных аутоантител практически аналогичен АИГ-1. В развернутой стадии наряду с серологическими и гистологическими признаками АИГ выявляют биохимический синдром холестаза и фиброзные изменения желчных протоков в биоптате печени. Для данного состояния характерна ассоциация с воспалительными заболеваниями кишечника, обнаруживаемая, однако, относительно редко к моменту установления диагноза. Как и в случае изолированного ПСХ, важнейшим методом диагностики служит хонгиография (эндоскопическая ретроградная, чрескожная чреспечечная или магнитно-резонансная), позволяющая обнаружить мультифокальные кольцевидные стриктуры внутри- и внепеченочных желчных протоков. В то же время нормальная холангиографическая картина должна в случае изолированного поражения мелких протоков. В этой ситуации решающее диагностическое значение принадлежит биопсии печени. Изменения мелких внутрипеченочных протоков на ранней стадии представлены пролиферацией и отеком в одних портальных трактах и исчезновением их в других, часто в сочетании с фиброзирующщ, перихолангитом. Наряду с этим выявляется картина перипортального гепатита со ступенчатыми или мостовидными некрозами и массивной лимфомакрофагальной инфильтрацией портальной и перипортальной областей.
К диагностическим критериям перекрестного синдрома АИГ/ПСХ относят следующие:
Ассоциация с язвенным колитом реже, чем при ПСХ;
Ассоциация с болезнью Крона очень редка;
Повышение ЩФ, АлАТ, АсАТ;
ЩФ у 50 % в пределах нормы;
Высокая концентрация IgG;
Выявление ANA, SMA, pANCA в сыворотке;
Холангиографическая картина ПСХ;
Гистологическая картина ПСХ, АИГ (реже) или комбинация признаков.
При аутоиммунном гепатите при гистологическом исследовании в ткани печени обычно выявляется картина хронического гепатита с выраженной активностью. Типичны мостовидные некрозы паренхимы, большое количество плазматических клеток в воспалительном инфильтрате в портальных трактах и участках некроза гепатоцитов. Лимфоциты инфильтрата нередко образуют лимфоидные фолликулы в портальных трактах, а перипортальные гепатоциты создают так называемые гландулярные (железистоподобные) структуры. Массивная лимфоидная инфильтрация отмечается и в центрах долек с обширными некрозами гепатоцитов. Нередко встречается воспаление мелких желчных протоков и холангиол портальных трактов при сохранности междольковых и септальных протоков. Изменения гепатоцитов проявляются гидропической или жировой дистрофией.
При истинном перекрестном синдроме гистологически выявляют ступенчатые некрозы в сочетании с перидуктулярной инфильтрацией портальных трактов и деструкцией желчных протоков. СинДРоА АИГ/ПБЦ прогрессирует быстрее, чем типичный ПБЦ, при этом скорость прогрессировать коррелирует с выраженностью воспалительно некротических изменений паренхимы печени.
Иногда в качестве отдельного перекрестного синдрома выделяют также сочетание АИГ с аутоиммунным холангитом, протекавшее аналогично синдрому АИГ/ПБЦ, но в отсутствие сывороточных АМА.
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции и наблюдается у 40-65 % больных. Спектр аутоантител достаточно широк и включает ANA (до 28 %), SMA (до 11 %), анти-LKM-l (до 7%), антифосфолипидные (до 25 %), антитиреоидные (до 12,5 %), pANCA (5-12 %), ревматоидный фактор, АМА, антитела к асиалогликопротеиновому рецептору (анти-ASGP-R) и Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии. У 89 % больных титры ANA и SMA не превышают 1 : 80. Серопозитивность одновременно по ANA и SMA отмечается не более чем в 4 % случаев. Кроме того, нередко аутоантитела при HCV-инфекции оказываются поликлональными, в то время как при аутоиммунных заболеваниях они реагируют со строго определенными эпитопами.
Исследование антител к HCV должно осуществляться с помощью иммуноферментного анализа (ИФА), как минимум, второго поколения, желательно с последующим подтверждением результатов рекомбинантным иммуноблоттингом. В начале 90-х гг. , на заре изучения гепатита С, в литературе появились сообщения о том, что до 40 % больных АИГ-1 и до 80 % больных АИГ-2 позитивны по анти-HCV. Впоследствии, однако, выяснилось, что применение ИФА первого поколения у большинства больных дало ложноположительный результат, обусловленный неспецифической реакцией на фоне выраженной гипер-гаммаглобулинемии.
Вместе с тем у 11 % больных, которые соответствуют критериям Международной группы по изучению АИГ и не отвечают на иммуно-супрессивную терапию или у которых развивается рецидив после отмены кортикостероидов, наблюдается положительный результат полимеразной цепной реакции на HCV РНК, что дает основание рассматривать их как больных вирусным гепатитом С с аутоиммунными проявлениями.
Лечение
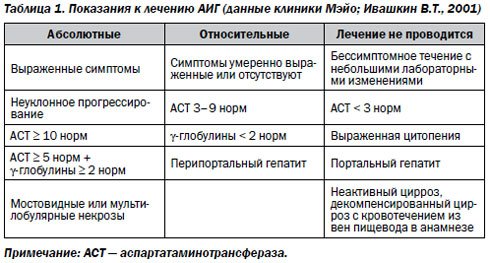
Абсолютными ползаниями к лечению аутоиммунного гепатита являются:
- клинические симптомы;
- прогрессирование патологического процесса;
- АлАТ > норм;
- АсАТ > 5 норм;
- у-глобулины > 2 норм;
- гистологически в ткани печени обнаруживаются мостовидные или мультилобулярные некрозы.
Относительными показаниями служат:
Отсутствие и умеренно выраженная симптоматика заболевания;
- АсАТ от 3 до 9 норм;
- у-глобулины < 2 норм;
- морфологически-перипортальный гепатит.
Лечение не проводится в случае бессимптомного течения заболевания декомпенсированного цирроза с кровотечением из вен пищевода в анамнезе, при АсАТ < 3 норм, выраженной цитопении, наличии гистологических признаков портального гепатита, неактивного цирроза.
В качестве патогенетической терапии чаще используют глюкокортикостероиды. Препараты данной группы снижают активность патологического процесса в печени, что обусловлено иммуносупрессивным влиянием на К-клетки, повышением активности Т-супрессоров, значительным снижением интенсивности аутоиммунных реакций, направленных против гепатоцитов.
Препаратами выбора служат преднизолон или метилпреднизолон. Начальная суточная доза преднизолона составляет 60 мг (реже 50 мг) в течение 1-й недели, 40 мг — в течение 2-й недели, на протяжении 3-й и 4-й недель — 30 мг, поддерживающая доза — 20 мг. Суточную дозу препарата уменьшают медленно (под контролем клинического течения заболевания, показателей активности процесса), на 2,5 мг каждые 1-2 нед, до поддерживающей, которую больной принимает до достижения полной клинико-лабораторной и гистологической ремиссии. Лечение поддерживающими дозами преднизолона проводится длительно: от 6 мес до 2 лет, а у ряда больных — в течение всей жизни.
При достижении поддерживающей дозы во избежание угнетения надпочечников целесообразно проводить альтернирующую терапию преднизолоном, т. Е. Принимать препарат в двойной дозе через день. Перспективным представляется использование кортикостероида нового поколения будесонида, обладающего высокой аффинностью к корти-костероидным рецепторам и минимальными местными побочными эффектами.
Относительными противопоказаниями к приему глюкокортикосте-роидов являются диабет, артериальная гипертензия, остеопороз, постменопауза, кушингоидный синдром.
Терапию делагилом начинают вместе с преднизолоном.
Длительность курса лечения делагилом — от 1,5 до 6 мес, у отдельных вольных — до 1,5-2 лет. Прием указанных препаратов провидится по следующей схеме: преднизолон в течение 1-й недели используется в дозе 30 мг, 2-й недели — 20 мг, 3-й и 4-й недель — 15 мг. Поддерживающая доза составляет 10 мг. Азатиоприн применяется по 5№ мг постоянно после первой недели. Противопоказаниями являются злокачественные новообразования, беременность, цитопения, непереносимость азатиоприна. При недостаточной эффективности схемы целесообразно повышение дозы азатиоприна до 150 мг в сутки. Поддерживающая доза предиизолона составляет 5-10 мг, азатиоирбина — 25-50 мг.
Показаниями к трансплантации печени служат неэффективность первичного курса лечения в течение 4 лет, множественные рецидивы, побочные эффекты стероидной и цитостатической терапии МПрогноз трансплантации, как правило, благоприятный, 5-летняя выживаемость превышает 90 %. Риск рецидива выше у больных АИГ типа 1, особенно HLA DRS-позитивных, возрастающих по мере увеличения срока после трансплантации. В настоящее время имеются экспериментальные схемы лечения АИГ, включающие такие препараты, как циклоспорин, такролимус, микофенолата мофетил, будесониац и Однако их применение не вышло за рамки клинических испытаний.
У многих больных с истинным перекрестным синдромом АИГ/ПКп эффективны кортикостероиды, что при неясности диагноза позволяе рекомендовать пробное назначение преднизолона в дозах, применяв мых для лечения АИГ, на срок 3-6 мес. Большинство авторов указы вают на высокую эффективность комбинации преднизолона с УДХК которая приводит к полной ремиссии у большинства пациентов после индукции ремиссии пациенты должны получать поддерживающую терапию преднизолоном (10-15 мг) и УДХК (10-15 мг/ki в сутки) неопределенно длительное время. Вопрос об отмене препаратов, как и в случае изолированного АИГ, можно ставить при полном исчезновении биохимических, серологических и гистологических признаков заболевания.
Недостаточная эффективность преднизолона или тяжелые побочные эффекты при его назначении служат основанием для подключения к терапии азатиоприна.
Сведения об эффективности иммуносупрессоров при синдроме АИГ/ПСХ противоречивы. В то время как одни исследователи указывают на резистентность к кортикостероидной терапии большинства больных, другие приводят противоположные данные о хорошем ответе на монотерапию преднизолоном или его комбинацию с азатиоприном. Недавно опубликованные статистические данные свидетельствуют о том, что на фоне лечения иммуносупрессорами умирают или подвергаются трансплантации печени более 30 % пациентов (при изолированном АИГ только 8 %). Следует принимать во внимание, что больные ПСХ относятся к категории лиц с повышенным риском остеопороза и билиарного сепсиса, что существенно ограничивает возможности применения у них кортикостероидов и азатиоприна.
УДХК (урсосан) в дозе не менее 15-20 мг/кг, по-видимому, может рассматриваться в качестве препарата выбора при синдроме АИГ/ПСХ. Представляется целесообразным проведение пробной терапии УДХК в комбинации с преднизолоном, учитывая предварительные положительные результаты клинических исследований. При отсутствии значимого эффекта преднизолон следует отменить во избежание развития побочного действия pi продолжить лечение повышенными дозами УДХК.
Лечение верифицированной HCV-инфекции с выраженным аутоиммунным компонентом представляет особые трудности.
Назначение ИФН-сс, который сам по себе является индуктором аутоиммунных процессов, может привести к ухудшению клинического течения заболевания вплоть до развития прогрессирующей печеночной недостаточно описаны случаи фульминантной печеночной недостаточности.
На фоне применения ИФН-а у больных ХГС с наличием маркеров утоиммунизации, при этом важным серологическим признаком было нарастание титра антител к ASGP-R. Анти-ASGP-R не только характерны для АИГ-1, но и, вероятно, играют роль в патогенезе повреждения печени при этом заболевании. В то же время кортикостероиды при вирусном гепатите способствуют усилению репликации вируса за счет подавления механизмов естественной противовирусной резистентности.
Клиника Мейо предлагает применение кортикостероидов при титрах ANA или SMA более 1 : 320, в случае же меньшей выраженности аутоиммунного компонента и выявления сывороточной HCV РНК рекомендуется назначение ИФН-а. Другие авторы предпочитают не придерживаться столь строгих критериев, указывая на хороший эффект иммуносупрессоров (преднизолона и азатиоприна) при HCV-инфекции с выраженным аутоиммунным компонентом.
Таким образом, возможные варианты тактики лечения больных HCV-инфекцией с аутоиммунным компонентом предусматривают ориентацию на титры аутоантител, проведение иммуносупрессивной терапии, подавление иммуносупрессорами аутоиммунного компонента с последующим применением ИФН-а.
В случае принятия решения о начале интерферонотерапии больные из групп риска подлежат тщательному мониторингу на протяжении всего курса лечения. Следует отметить, что терапия ИФН-а даже У больных без исходного аутоиммунного компонента может приводить к появлению разнообразных аутоиммунных синдромов. Их выраженность варьирует от бессимптомного образования аутоантител до развернутой клинической картины классического аутоиммунного заболевания. По крайней мере один вид аутоантител появляется на фоне интерферонотерапии у 33-87 % больных хроническим гепатитом С. Аиболее частым из аутоиммунных синдромов является нарушение Функции щитовидной железы в форме гипо- или гипертиреоидизма, Развивающееся у 2,5-20 % пациентов.
Источник
