Атриовентрикулярная коммуникация код мкб
- Описание
- Причины
- Симптомы (признаки)
- Диагностика
- Лечение
Краткое описание
Открытый атриовентрикулярный канал (АВК) — группа врождённых аномалий, характеризующаяся наличием сливающихся между собой ДМЖП и дефекта межпредсердной перегородки (ДМПП) и нарушением развития АВ — клапанного аппарата. Статистические данные • 5% всех ВПС в возрасте до 1 года • 2–6% всех ВПС, из них 70% — частично открытый АВК, 30% — полная и промежуточные формы открытого АВК • В 25–30% сочетается с синдромом Дауна.
Код по международной классификации болезней МКБ-10:
- Q21.2 Дефект предсердно-желудочковой перегородки
Причины
Этиология: причины, вызывающие ВПС (см. Тетрада Фалло).
Патогенез. Полная форма (общий ОАВК) характеризуется первичным ДМПП, сливающимся с дефектом мембранозной части межжелудочковой перегородки, и высоко расположенным ДМЖП, АВ — клапаны имеют общие створки для левого и правого предсердно — желудочковых отверстий. Частично открытый АВК — сочетание первичного ДМПП с расщеплением передней створки митрального и/или створки трёхстворчатого клапана. Промежуточные формы (косые каналы, или дефекты Гербоде) характеризуются потоком крови из левого желудочка в правое предсердие, что приводит к перегрузке правого желудочка, расширению ствола лёгочной артерии. Нарушения гемодинамики складываются из сочетания таковых при ДМЖП и ДМПП (см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки).
Симптомы (признаки)
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки, Недостаточность митрального клапана.
• Объективно • Бледность кожных покровов •• Выраженный цианоз у детей старше 4 лет при полной форме открытого АВК •• Границы сердца расширены влево и вправо •• Усиленный верхушечный толчок •• Толчок правого желудочка •• Систолическое дрожание •• Усиление I тона над верхушкой сердца и II тона над лёгочной артерией (при частично открытом АВК отсутствует) •• Пансистолический шум над всей областью сердца с максимумом в третьем и/или четвёртом межрёберных промежутках, проводящийся в межлопаточную и подкрыльцовую области (при полной и промежуточных формах) •• Для неполной формы характерен систолический шум во втором межрёберном промежутке слева (шум ДМПП) в сочетании с шумом митральной недостаточности на верхушке сердца.
Диагностика
Инструментальная диагностика • ЭКГ: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • ЭхоКГ: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • Рентгенография органов грудной клетки: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • Катетеризация полостей сердца: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • Левые и правые атриография и вентрикулография, коронарная ангиография: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана.
Медикаментозное лечение: профилактика инфекционного эндокардита и терапия сердечной недостаточности.
Лечение
Хирургическое лечение • Показания •• В раннем возрасте — рефрактерные к консервативному лечению варианты порока, сопровождающиеся клинической симптоматикой •• Общий открытый АВК •• В дошкольном возрасте —открытый АВК, независимо от наличия клинических симптомов (в связи с высоким риском инфекционного эндокардита и большой частотой прогрессирования сердечной недостаточности в школьном возрасте) • Противопоказания: см. Дефект межпредсердной перегородки • Методы оперативного лечения •• При неполном открытом АВК — пластика митрального клапана, пластика ДМПП заплатой из аутоперикарда или синтетического материала •• При необходимости экстренной коррекции общего открытого АВК у детей с массой тела менее 3 кг, сопутствующих пороках сердца и при малом опыте клиники по радикальной коррекции порока в раннем возрасте — сужение лёгочного ствола •• В остальных случаях — одномоментная пластика ДМЖП, ДМПП, митрального и трёхстворчатого клапанов •• При промежуточных формах открытого АВК — пластика ДМЖП, при необходимости — аннулопластика трёхстворчатого клапана.
Специфические послеоперационные осложнения • Неадекватная коррекция порока (чаще всего митральной недостаточности) • АВ — блокады • Инфекционный эндокардит.
Прогноз • Тяжёлые формы проявляют себя в первые месяцы жизни, при лёгких формах общее состояние не нарушено • Средняя продолжительность жизни — 15 лет • При неполном открытом АВК средняя продолжительность жизни неоперированных больных — 20 лет • Хирургическая летальность — менее 6,7% • При общем открытом АВК и естественном течении порока 95% больных погибают к 5 — летнему возрасту • Послеоперационная летальность — до 32% • Пациенты с промежуточными формами открытого АВК имеют относительно благоприятный прогноз, однако всем необходимо хирургическое лечение.
Синонимы: Дефекты эндокардиальных валиков; Предсердно — желудочковое сообщение; Персистирующее общее предсердно — желудочковое отверстие.
Сокращения. АВК — атриовентрикулярный канал.
МКБ-10. Q21.2 Дефект предсердно — желудочковой перегородки
Источник
Содержание
- Описание
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Открытый атриовентрикулярный канал.

Атриовентрикулярный дефект межпредсердной перегородки
Описание
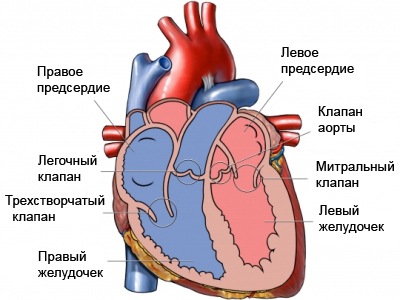
Открытый атриовентрикулярный канал (АВК) характеризуется недоразвитием перегородок, прилежащих к атриовентрикулярным клапанам, и аномалиями самих клапанов. Таким образом, в патологию входят первичный дефект межпредсердной перегородки, дефект приточной части межжелудочковой перегородки и дефекты формирования левого и правого атриовентрикулярного клапанов. Так как степень нарушения развития данных структур может быть различной, существует целый спектр отклонений, из которого выделяют частичную (неполную) форму, промежуточную и полную форму атриовентрикулярного канала.
Частота порока составляет 0,25 на 1000 живорожденных, около 4% среди всех ВПС и 6% среди критических ВПС.
В период новорожденности гемодинамические проблемы развиваются, как правило, у детей с полной формой атриовентрикулярного канала, которая и рассматривается в настоящем разделе.
Порок включает первичный дефект межпредсердной перегородки, дефект межжелудочковой перегородки сразу под атриовентрикулярными клапанами и общее кольцо атриовентрикулярных клапанов. Примерно у 50% больных имеется синдром Дауна. В 13— 18% случаев АВК комбинируется с другой патологией сердца (тетрада Фалло, атрезия или стеноз легочной артерии, коарктация аорты, предсердный изомеризм ).
Анатомия. При данном пороке возможно сообщение между собой всех четырех камер сердца, так как предсердия соединяются с желудочками общим отверстием. Общий клапан в большинстве случаев имеет пять створок: переднюю мостовидную, заднюю мостовидную, правую и левую муральные створки и правую передневерхнюю створку. В некоторых наблюдениях отверстие общего клапана впадает преимущественно в один желудочек (доминантность левого или правого желудочков), второй желудочек в таких вариантах бывает гипоплазирован. Папиллярные мышцы левого желудочка могут располагаться аномально близко друг к другу или быть представлены единственной мышцей.
Симптомы
Частично открытый АВК почти в 3 ра за чаще встречается у лиц женского пола. Клинические проявления порока зависят как от величины ДМПП, так и от степени выраженности недостаточности митрального клапана. При умеренной степени недостаточности. Митрального клапана течение заболевания приближается к таковому при изолированном ДМПП, тогда как при значительной регургитацин с первых дней и месяцев жизни состояние больных тяжелое, отмечаются отставание в физическом и моторном развитии, повторные ОРВИ, признаки сердечной недостаточности как по лево-, так и по правожелудочковому типу с застойными влажными хрипами в легких, рано развивается сердечный горб.
При пальпации верхушечный толчок усилен, на верхушке слева у / t больных определяется систолическое дрожание, при аус-культации выслушиваются два разных по тембру и локализации шума: на верхушке — систолический шум недостаточности мит рального клапана с проводимостью в левую аксиллярную область; во втором и третьем межреберье слева — систолический шум ДМПП. Если из-за особенностей расщепления митрального клапана сброс крови направлен больше в правое, чем в левое, предсердие, систолический шум недостаточности митрального клапана иррадиирует преимущественно на основание сердца. Систолический шум недостаточности трехстворчатого клапана, связанный с расщеплением его створки, или меэодиастоличе-ский шум относительного его теноза (увеличенный кровоток) нередко не определяются, так как перекрываются другими более интенсивными шумами. II тон над легочной артерией расщеплен; единый II тон, как признак высокой легочной гипертензии, встречается редко.
ЭКГ значительно помогает в установлении диагноза АВК. В первую очередь это касается отклонения электрической оси сердца влево, которое отмечается у 60—70 % больных с неполной формой АВК и связано с аномалией проводящей системы сердца; jLoAQRS от —20 до —60°, реже до —130°. Сочетание митральной недостаточности с такой левограммой указывает на наличие открытого АВК. В редких случаях электрическая ось отклонена вправо. Другой особенностью является перегрузка правого желудочка, что выражается увеличением амплитуды зубцов /?С, формой QRS в виде rSR , rR возможны признаки перегрузки левого предсердия, левого желудочка (у больных с преобладающей недостаточностью митрального клапана без легочной гипертензии); удлинение интервала PR. При легочной гипертензии на ЭКГ появляются признаки систолической перегрузки правого желудочка. У взрослых больных возможны приступы пароксизмальной тахикардии.
На ФКГ II тон над легочной артерией расщеплен (0,03— 0,06 с), легочный компонент его усилен, фиксируются III и IV гоны сердца. Во втором и третьем межреберье определяется ромбовидный или веретенообразный систолический шум, занимающий 2/з или всю систолу (шум ДМПП); на верхушке — систолический шум недостаточности митрального клапана, связанный с I тоном (убывающий или лентообразный). У половины больных на верхушке сердца регистрируются мезодиастолический или пресистолический шум небольшой амплитуды.
На рентгенограмме при частично открытом АВК легочный рисунок усилен как по артериальному, так и по венозному руслу (признак левожелудочковой недостаточности при значительной митральной регургитацин). Дуга легочнойартерии умеренно выбухает. Форма сердца может быть различной в зависимости от размера дефекта и выраженности митральной недостаточности. При небольшом ДМПП преобладают проявления митральной недостаточности, отмечается увеличение левого предсердия, левого желудочка, в связи с чем верхушка сердца погружена в диафрагму, возможна кардиомегалия (форма сердца напоминает таковую при дилатационной кардиомиопатии). Для большого ДМПП характерно увеличение правого предсердия.
При эхокардиографическом исследовании у детей с частично открытым АВК обнаруживаются признаки первичного ДМПП (перерыв эхосигнала от перегородки); аномалии митрального клапана (сближение фиброзного кольца клапана и межжелудочковой перегородки, эхо от передней створки прослеживается до передней стенки аорты, дополнительные эхосигналы от аномально прикрепленных к межжелудочковой перегородке хорд расщепленной передней митральной створки, характерная форма движения передней створки — во время диастолы она как бы прилипает к межжелудочковой перегородке); признаки изменения трикуспидального клапана (начало систолического сегмента кривой клапана непосредственно над межжелудочковой перегородкой); признаки объемной перегрузки правого желудочка. Дополнительными признаками порока являются сужение выводного тракта левого желудочка, дилатация правых отделов сердца, парадоксальное движение межжелудочковой перегородки. При двухмерном эхокардиографическом исследовании в проекции 4 камер с верхушки выявляется первичный дефект межпредсердной перегородки, межжелудочковая перегородка и трикуспидальный клапан не изменены. В коротком сечении левого желудочка на уровне клапана определяется расщепление передней митральной створки.
При введении катетера в правый желудочек во время зондирования полостей сердца он легко проходит из правого предсёр дня через ДМПП в левое предсердие и левый желудочек. Повышенное насыщение крови кислородом отмечается на уровне правого предсердия и увеличивается дальше в правом желудочке и легочной артерии (признак сброса на двух уровнях). При частичном открытом АВК показатели давления в легочной артерии и общелегочного сопротивления нормальные или умеренно повышены, обнаруживается градиент давления между легочной артерией и правым желудочком, как при ДМПП (функциональный легочный стеноз).
Особое диагностическое значение имеет левосторонняя вент-рикулография, выявляющая типичный признак открытого АВК — сужение и деформацию путей оттока из левого желудочка (симптом гусиной шеи), свидетельствующий о расщеплении створки митрального клапана. Из левого желудочка контрастное вещество поступает в правое и левое предсердия.
Боль в груди слева. Одышка. Отсутствие аппетита.
Причины
Данный синдром является пороком развития, развивающийся внутриутробно при закладке органов сердечно-сосудистой системе.
Лечение
Естественное течение порока определяется размерами ДМПП и выраженностью митральной недостаточности. Тяжелые формы проявляют себя в первые месяцы и годы жизни и требуют ранней хирургической коррекции. При легких формах порока жалобы могут отсутствовать, а заболевание проявляться только аускультативной симптоматикой; больные доживают до взрослого возраста и сохраняют работоспособность аналогична тому, как это наблюдается при вторичных ДМПП Описаны единичные случаи, когда больные доживали до 60 и более лет. Однако большинство больных без операции умирают до 20—30-летнего возраста от сердечной недостаточности, легочной гнпертензии, бактериального эндокардита, нарушений сердечного ритма.
Показания к операции. В связи с тем что легочная гнпертспзня при частично открытом АВК наблюдается редко. Корригирующую операцию целесообразно проводить в 6—10 лет, когда можно получить оптимальные результаты функционального состояния митрального клапана в отдаленные сроки. Противопоказанием к операции является острый бактериальный эндокардит.
Операция заключается в восстановлении целостности передней створки митрального клапана, что достигается наложением отдельных швов; первичный ДМПП закрывается заплатой. При необходимости может быть выполнена пластическая операция и на трикуспидальном клапане. Потребность в протезировании митрального клапана возникает довольно редко и обусловлена чаще всего сопутствующей патологией — двойным митральным клапаном.
Хирургическая летальность колеблется от 3,7 до 6,7 % при изолированной форме порока [Бухарин В. А. , Подзолков В. П. , 1982; Фальковский Г. Э. , Бузинова Л. А. , 1986; Бураковскнй В. И. И , 1989] и 14 % при сочетании с другими ВПС | Studer M. Et al. , 1982]. Летальные исходы чаще отмечаются у детей раннего возраста с малой массой тела, имеющих тяжелую митральную недостаточность и кардиомегалию. Среди осложнений, ведущих к летальному исходу, можно выделить сердечную недостаточность из-за неадекватной коррекции митрального клапана, сужения в субаортальном тракте, полную атриовентрикулярную блокаду, протезирование клапана у младенцев, нарушения сердечного ритма.
Отдаленные результаты операции при частично открытом АВК, несмотря на сохранение у многих больных остаточного шума недостаточности митрального клапана, как правило, хорошие. Выживаемость больных через 20 лет после операции составляет 94 %, и лишь 5 % из них требуют повторного пмешатель ства на митральном клапане.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
По данным ВОЗ, ежегодно 4–5 % новорожденных появляются на свет с врожденной или наследственной патологией. Из них около 2 % имеют тяжелые аномалии, несовместимые с жизнью, и, прежде всего, это врожденные пороки сердца (ВПС). Почти 40 % ранней детской смертности частично или полностью обусловлено наследственными заболеваниями, половину из которых составляет патология сердечно-сосудистой системы [1, 2, 4].
ВПС являются одним из клинических симптомов многочисленных синдромов, связанных с известными хромосомными нарушениями. Ярким примером является синдром Дауна (СД) – частая форма слабоумия, комбинирующаяся с характерными соматическими признаками. Этот синдром описан в 1866 г. J. Down, его частота в популяции составляет – 1:700 новорожденных.
Необходимо отметить, что 50 % больных с СД имеют ВПС, при этом более чем у 40 % пациентов диагностируют атриовентрикулярную коммуникацию (АВК). В то же время в общей популяции частота этого порока составляет 4,7–6,5 % [2–4]. Как объяснение такой неслучайной ассоциации исследователи предполагают, что участок 21-й хромосомы может быть задействован в развитии сердца вообще и эндокардиальных подушечек в частности, дефект которых и лежит в основе АВК. Кроме того, у больных с СД выявляют дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток, тетраду Фалло и др.
АВК – сложный многокомпонентный ВПС, при котором существует аномальное сообщение между желудочками и предсердиями через общий атриовентрикулярный канал, возникновение которого обусловлено дефектом развития эндокардиальных валиков (подушечек). В процессе эмбриогенеза эндокардиальные подушечки, срастаясь между собой, формируют два атриовентрикулярных клапана и участвуют в конечной фазе формирования атриовентрикулярной перегородки, поэтому нарушение эмбриогенеза, вызванное различными причинами, приводит к недоразвитию атриовентрикулярной перегородки и нарушению дифференциации единого атриовентрикулярного канала на митральную и трикуспидальную части. Нарушается развитие межпредсердной и межжелудочковой перегородок, створок митрального и трикуспидального клапанов, а предсердия и желудочки соединяются между собой общим атриовентрикулярным каналом, состоящим из единого атриовентрикулярного отверстия и сложного единого аномального створчатого аппарата [2, 5, 6].
В зависимости от степени недоразвития эндокардиальных валиков выделяют две формы порока: неполную и полную.
Полная АВК – это ВПС, включающий сливающиеся между собой низкий (первичный большой) ДМПП, высокий (мембранозный) ДМЖП, аномальное единое центрально расположенное большое атриовентрикулярное отверстие, расщепление створок – чаще митрального (переднемедиальная) или трикуспидального (септальная) клапанов. Общее центральное атриовентрикулярное отверстие при этом прикрывается клапаном, состоящим из передней и задней створок, связанных с остатками перегородок, и двух латеральных створок, прикрепляющихся к боковым стенкам каждого из желудочков.
Порок относится к группе ВПС с гиперволемией малого круга кровообращения, обусловленной артериовенозным сбросом крови через общий атриовентрикулярный септальный дефект в правые отделы сердца и в систему легочной артерии (ЛА). Сброс происходит на уровне предсердий и желудочков. При этом кровь из левого желудочка (ЛЖ) может поступать одновременно через ДМЖП в правый желудочек (ПЖ), через ДМПП в правое предсердие (ПП) и через дефектный атриовентрикулярный клапан в левое предсердие (ЛП), то есть имеет место гемодинамическая ситуация, обусловленная сочетанием трех дефектов: ДМЖП, ДМПП и недостаточности атриовентрикулярного клапана. В результате циркуляции балластного объема крови практически через все отделы сердца возникают объемная перегрузка и дилатация ЛП, ПП и ПЖ, а также гиперволемия и нарастающая спастическая гипертензия малого круга кровообращения. Из-за того что ДМЖП и ДМПП большие, давление между правыми и левыми камерами сердца быстро выравнивается и объем сброса слева направо на уровне предсердий определяется большей растяжимостью ПП, а на уровне желудочков (в основном) – мощностью сокращений ЛЖ и величиной градиента давления между аортой и ЛА. В результате выраженной объемной перегрузки правых камер сердца быстро формируется кардиомегалия и расширяется ЛА. Особенно выражена перегрузка ПП, поскольку в него кровь сбрасывается не только из ЛП, но и из ЛЖ. Легочная гипертензия (ЛГ) развивается быстро, что добавляет к диастолической перегрузке и систолическую перегрузку правых отделов сердца и вызывает их гипертрофию. С нарастанием ЛГ появляются признаки синдрома Эйзенменгера и перекрестного, а затем и стойкого венозно-артериального шунта с хронической артериальной гипоксемией, обусловленной сбросом венозной крови в аорту [4, 6, 7].
Представляем два клинических случая сочетания СД и полной АВК у детей, находившихся под наблюдением в городском специализированном доме ребенка г. Донецка.
Первое клиническое наблюдение.
Ребенок Д., 5 лет 8 мес. Девочка поступила в дом ребенка в возрасте 7 мес 28 дней. Родилась от 15-й беременности, протекавшей с анемией, фетоплацентарной недостаточностью, хронической внутриутробной гипоксией плода, маловодием. Роды вторые, срочные. Масса при рождении 3050 г, длина тела 54 см, оценка по шкале Апгар 6–7 баллов. В родах имела место кефалогематома. После рождения отмечали следующий характерный внешний вид ребенка: косой разрез глаз, уплощенный нос, большой язык, маленький рот, уплощенный затылок, кожная складка на короткой и широкой шее, диспластичные ушные раковины, мышечная гипотония, «бедный» рефлекс Моро, короткие пальцы рук, обезьянья (поперечная) складка на коротких и широких ладонях и стопах. Заподозрен СД. Ребенок обследован в Донецком межобластном медико-генетическом центре, в котором диагноз был подтвержден. У ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Шум иррадиировал в правую и левую аксиллярную области, на спину. Диагностирован ВПС (полная АВК). Ребенка консультировал кардиохирург.
У девочки неоднократно, особенно на первом году жизни, отмечали пневмонии, пиелонефрит. Девочка развивалась с резким отставанием в физическом и нервно-психическом развитии. В возрасте 5 лет 8 мес масса тела составила 15 800 г, рост – 103 см, что по таблице сигмальных отклонений соответствует физическому развитию ниже среднего. Обращают внимание проявления атопического дерматита. У ребенка рано развились признаки хронической сердечной недостаточности (ХСН) IIА стадии, проявившейся тахикардией, одышкой в покое, периоральным цианозом, акроцианозом, увеличением печени, пастозностью стоп. Вследствие хронической гипоксемии у ребенка сформировались признаки хронической гипоксии тканей: пальцы в виде «барабанных палочек», ногти по типу «часовых стекол». Девочка самостоятельно ходит, говорит несколько элементарных слов, ест из ложки, пьет из чашки.
Приводим результаты обследования ребенка в 5 лет 8 мес.
Клинический анализ крови: эритроциты – 5,0·1012/л, гемоглобин – 160 г/л, цветной показатель – 0,95, гематокрит – 46 %, лейкоциты – 8,2·109/л, базофилы – 1 %, эозинофилы – 2 %, нейтрофилы палочкоядерные – 4 %, нейтрофилы сегментоядерные – 48 %, лимфоциты – 39 %, моноциты – 6 %, ретикулоциты – 8 ‰, тромбоциты – 182 Г/л, СОЭ – 6 мм/ч.
Биохимические исследования крови: общий белок – 83 г/л, кальций – 2,3 ммоль/л. IgG к токсоплазме, цитомегаловирусу, вирусу простого герпеса, вирусам гепатита В, С, ВИЧ не обнаружены.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка всех отделов сердца.
Эхокардиография: полная АВК. Тотальная гипертрофия миокарда. Признаки ЛГ (давление в ЛА 86–91 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 78 %. Полости не расширены.
Ребенку установлен диагноз: СД, трисомия 21, мейотическое нерасхождение. ВПС (полная АВК), ЛГ, ХСН ІІА стадии. Задержка физического развития. Умеренная умственная отсталость. Атопический дерматит, период неполной ремиссии.
Получает с 7-месячного возраста дигоксин, каптоприл, верошпирон по показаниям. Периодически получает курсы лечения ноотропами, кардиотрофическими, антигистаминными препаратами, ферментами.
Анализируя возможные пути оказания медицинской помощи ребенку, необходимо отметить следующее. Известно, что основное лечение АВК оперативное. Хирургическая коррекция данного вида ВПС является одной из сложнейших кардиохирургических операций и сопровождается высокой летальностью. Если же не проводить оперативного вмешательства, то порок будет иметь злокачественное прогредиентное течение с развитием тяжелой, рефрактерной к терапии ХСН, присоединением пневмонии, прогрессированием ЛГ и необратимостью поражения сосудов легких. Так, в течение первых 4–6 мес жизни без оперативной коррекции погибает до 50 % детей, в 1–2-ой годы жизни – до 87 % больных, к 5 годам – до 96 % пациентов [2, 4, 8]. ЛГ достигает высокой степени уже к концу первого года жизни, причем это касается, прежде всего, детей с СД, а к концу второго года у этого контингента пациентов часто возникают необратимые морфологические изменения в легочных сосудах. Операцию проводят с применением искусственного кровообращения и регулируемой гипотермии тела до 20–22 °С. Радикальная коррекция порока включает закрытие ДМЖП и ДМПП заплатой с одновременным разделением атриовентрикулярного кольца на правое и левое, устранение недостаточности предсердно-желудочковых клапанов.
Изучение литературы по оперативной коррекции полной АВК у детей с СД [2, 4, 8, 9] свидетельствует, что такие пациенты могут быть успешно прооперированы на первом году жизни, что позволяет устранить проблемы, связанные с прогрессирующей ХСН и ЛГ. Ранняя хирургическая коррекция у пациентов с СД до увеличения легочного сосудистого сопротивления и деформации атриовентрикулярного клапана имеет благоприятную перспективу. Данный подход позволяет снизить раннюю смертность, обеспечивает хорошие показатели выживаемости в отдаленный период и более надежную защиту от последующей дегенерации клапана.
Оперативная коррекция полной АВК у детей с СД в возрасте старше одного года, как правило, связана с более высоким риском операционной смертности и меньшей надеждой на улучшение гемодинамики по сравнению с детьми без СД. Кроме того, дети с СД имеют предрасположенность к развитию тяжелых послеоперационных инфекционных осложнений, прежде всего со стороны респираторного тракта, что требует более продолжительной искусственной вентиляции легких, длительного пребывания в отделении интенсивной терапии, удлиняющих сроки госпитализации [2, 8, 10].
Особенностью представленного случая явилось то, что, несмотря на высокую летальность при данном пороке без операции, девочка жива к 5 годам 8 мес. Состояние больной в настоящее время стабильное, однако ХСН и ЛГ прогрессируют. Высокие показатели ЛГ уже на первом году жизни не позволили провести оперативную коррекцию ребенку.
Второе клиническое наблюдение.
Ребенок У., 27.07.2008 г. рождения. Умерла 11.11. 2008 г. в возрасте 3 мес 15 дней.
Девочка рождена от 3-й беременности (1-я беременность в 1997 г. – искусственные роды в 30 нед по социальным показаниям, 2-я беременность в 2000 г. – медицинский аборт). Настоящая беременность наступила в результате стимуляции яичников матери по поводу вторичного бесплодия. Беременность протекала на фоне миомы матки, хронического сальпингоофорита, эрозии шейки матки, интенсивного табакокурения. В сроке гестации 21–22 нед обследована в Донецком межобластном медико-генетическом центре, где был установлен высокий риск рождения ребенка с СД. Вместе с тем, женщина продолжала донашивать настоящую беременность. Роды первые, преждевременные, в сроке 31– 32 нед. Масса при рождении 1700 г. Состояние девочки после рождения тяжелое, обусловленное недоношенностью, внутриутробной пневмонией. В родильном доме выявлены стигмы даунизма. Диагноз СД подтвержден в Донецком межобластном медико-генетическом центре. Кроме того, у ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Установлен ВПС (полная АВК). Ребенка консультировал кардиохирург. После выписки из родильного дома ребенок находился на лечении в ЦГКБ № 3, реанимационном отделении ГДКБ № 1 г. Донецка.
Приводим результаты обследования девочки в возрасте 3 мес 12 дней.
Клинический анализ крови: эритроциты – 2,9·1012/л, гемоглобин – 79 г/л, цветной показатель – 0,82, гематокрит – 28 %, лейкоциты – 20,0·109/л, плазменные клетки – 1 %, метамиелоциты – 3 %, базофилы – 1 %, эозинофилы – 1 %, нейтрофилы палочкоядерные – 15 %, нейтрофилы сегментоядерные – 57 %, лимфоциты – 17 %, моноциты – 5 %, тромбоциты – 115 Г/л, СОЭ – 5 мм/ч.
Биохимические исследования крови: общий белок – 48 г/л, кальций – 1,98 ммоль/л, сахар – 10,0 ммоль/л, протромбиновый индекс – 83 %, фибриноген – 4,83 г/л.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка левых отделов сердца.
Рентгенограмма органов грудной клетки: двусторонняя пневмония. Смещение левой границы сердца влево.
Эхокардиография: полная АВК. Дилатация левых отделов сердца. Признаки ЛГ (давление в ЛА 40 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 72 %.
У ребенка рано развились признаки ХСН, по поводу которой были назначены дигоксин, каптоприл, фуросемид, калия и магния аспарагинат. В связи с присоединением пневмонии девочка получала комбинированную антибактериальную терапию, инфузионно-трансфузионную терапию. Кроме того, проводились курсы лечения нейрометаболическими препаратами.
Несмотря на проводимое лечение, состояние девочки прогрессивно ухудшалось, нарастали явления сердечно-легочной недостаточности. Отмечали одышечно-цианотические приступы, по поводу которых проводили оксигенотерапию. Однако продолжали нарастать проявления сердечной недостаточности (одышка, цианоз кожных покровов). Ребенку 11.11.2008 г. в 7.00 в реанимационном отделении ГДКБ № 1 начата искусственная вентиляция легких с помощью аппарата «Малятко». Состояние продолжало ухудшаться. 11.11.2008 г. в 8.15 зафиксирована остановка кровообращения. Реанимационные мероприятия в течение 30 мин не имели эффекта и в 8.45 – констатирована смерть.
Основной клинический диагноз: врожденный порок сердца (полная АВК), ЛГ. СД.
Осложнения: двусторонняя пневмония. Гипотрофия. Отек-набухание головного мозга. Отек легких. Острая сердечно-сосудистая недостаточность.
Сопутствующий диагноз: перинатальное поражение ЦНС.
Основной патологоанатомический диагноз: болезнь Дауна (кариотип 47 ХХ+21 от 01.08.2008 г.) со сложным пороком сердца (открытый общий предсердно-желудочковый канал, коарктация перешейка аорты). Состояние после катетеризации правой подключичной вены, иску?
