Антидепрессанты при хроническом болевом синдроме
Главная
SAPF
- О сайте
- О фонде
Центры
- Российские
- Зарубежные
Организации
- IASP
Материалы
Болевые синдромы
- Обзоры
- Головные боли
- Мигрень
- Боли в спине
- Нейрогенные боли
- Абдоминальные боли
- Лицевые боли
Лечение
- Этика боли
Информация
- Конференции, конгрессы, семинары
- Библиография
- Ссылки
- Арт-галерея
Гостевая книга
Обратная связь
С.С. Павленко. Областной противоболевой центр. Новосибирск
I. Представление об острой, хронической и патологической боли. Патофизиологические и клинические
особенности хронической боли. Основные виды хронических болевых синдромов. Нейрохимия хронической
боли.
Обычно, острая боль представляет собой симптом какой-либо внезапно возникшей патологии или повреждения
тканей. Острую боль можно назвать физиологической, поскольку она выполняет определённую защитную
функцию и, сигнализируя о развитии патологических процессов в тканях, способствует развитию в
организме адаптационных комплексных реакций. Лечение острой боли обычно направлено на устранение
причины, вызвавшей эту боль, либо на минимизацию её алгогенного действия (блокады).
Хроническая или рецидивирующая боль имеет многокомпонентное происхождение, в основе которого лежат
не только патофизиологические, но и тесно взаимодействующие психологические и социальные факторы.
Хроническую боль называют также патологической болью, так как она имеет патогенное значение для
организма, и, вызывая расстройство функций ЦНС, психические и эмоциональные нарушения, ведёт к
повреждению внутренних органов.
Хроническая (патологическая) боль считается самостоятельным заболеванием с первичным патологическим
процессом в соматической сфере и вторичной дисфункцией периферической и центральной нервной системе.
Её главными отличиями являются длительность (не менее 3 — 6 мес.), повышение устойчивости пациента
к проводимой терапии, отсутствие прямой зависимости от выявления и устранении вызвавшей её причины.
Хроническая боль может быть трёх типов:
- Боль в результате непрекращающегося длительного воздействия (грыжа межпозвонкового диска).
- Боль после острой травмы, но продолжающаяся значительно дольше нормального периода заживления
(каузалгия, регионарный болевой синдром, фантомная боль). - Боль без определённой, видимой, заметной причины (головные боли мышечного напряжения, мигрень).
- Хроническая боль — самостоятельное заболевание, в патогенезе которого ведущее значение имеют
психо-эмоциональные и социальные факторы. При хронической боли может отсутствовать прямая связь
между болью и вызвавшей её причиной. - В механизмах развития хронической боли и депрессии лежат общие медиаторные системы.
- Согласно эпидемиологическим исследованиям существует тесная связь между депрессией и хронической
болью.
Существуют различные классификации хронической боли. В основе большинства из них лежит локализация
болевого синдрома: головные боли, боли в шее и спине, лицевые боли, боли в конечностях, боли в
груди, боли в животе, боли в области таза.
Различают также боли соматического происхождения, нейрогенные и психогенные боли.
В механизмах развития хронической боли, независимо от её локализации и происхождения, важное значение
отводится медиаторным системам головного и спинного мозга:
- Серотонинергической
- Норадренергической
- Дофаминергической
- ГАМК-ергической
- Пептидергической (опиоидно и неопиоидной).
В результате многочисленных клинических и экспериментальных исследований установлено следующее:
- Интратекальное введение серотонина вызывает анальгезию и угнетает активность нейронов дорзальных
рогов спинного мозга, вызванных болевой стимуляцией. - При введении в определённые зоны головного мозга (большое ядро шва) ингибиторов обратного
захвата серотонина, что способствует высвобождению серотонина из синаптических терминалей, развивается
анальгетический эффект. - Избирательное разрушение нисходящих серотонинергических путей усиливает болевую реакцию.
Подобные же результаты получены и при исследовании влияния адренергической медиаторной системы.
Оказалось, что норадреналин модулирует болевые сигналы как на супрасегментарном, так и на спинальном
уровнях. Поэтому блокаторы адренергических рецепторов повышают болевую чувствительность, а агонисты
(клофелин) тормозят активность ноцицептивных нейронов в ответ на болевое раздражение.
II. Хроническая боль и депрессия.
Многочисленные клинико — эпидемиологические исследования установили, что существует тесная связь
между хронической болью и депрессией. Данные по распространению депрессии среди пациентов с хронической
болью колеблются от 30 до 87%.
Некоторые исследователи считают депрессию ведущим фактором в снижении трудоспособности у больных
с хронической болью, либо наиболее значимой мотивацией при обращении за медицинской помощью.
Однако связь депрессивных расстройств и хронической боли не представляется однозначной, и существsуют
различные альтернативные варианты их причинно-следственных отношений:
- Хроническая боль — причина депрессии.
- Пациенты с депрессией более склонны к восприятию болей.
- Хроническая боль и депрессия опосредованно связаны другими промежуточными факторами (потеря
дееспособности).
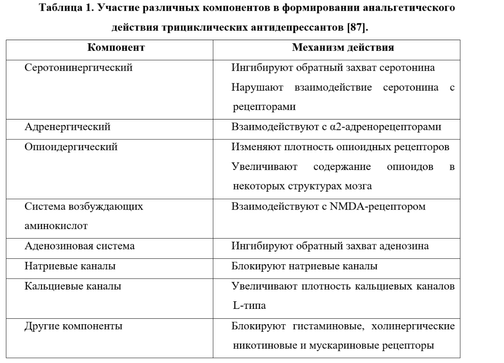
III. Фармакотерапия хронической боли. Адъювантная терапия. Использование антидепрессантов
в лечении хронической боли.
В медикаментозной терапии хронических болевых синдромов используется две основные группы препаратов:
- Анальгетики (опиоидные и неопиоидные)
- Адъювантные анальгетики.
Адъювантные анальгетики, или “коанальгетики”, представляют собой гетерогенную группу лекарственных
средств, которые обеспечивают анальгезию либо при специфических болевых синдромах, либо нейтрализуют
побочные действия опиоидов, что позволяет продлить их анальгетический эффект. К ним относят лекарственные
средства, не обладающие прямыми анальгезирующими свойствами, но приобретающими их при определённых
обстоятельствах (антигистаминные средства, транквилизаторы, антиконвульсанты и др.).
Хроническая (патологическая) боль представляет собой именно те условия, при которых применение
в большей степени адъювантных средств ведёт к положительному эффекту. Среди последних значительное
место принадлежит антидепрессантам.
К сожалению, в широкой клинической практике назначение антидепрессантов врачами мотивируется только
желанием вызвать седативный эффект и, тем самым, создать благоприятный фон для основной терапии
(анальгетиками). Между тем известно, что применение антидепрессантов оказывает положительный эффект
у 50-60% больных с ХБС. Данные более 60 клинических трайлов показывают анальгетическое действие
антидепрессантов при лечении большинства ХБС.
Считается, что антидепрессанты оказывают анальгетический эффект по трём основным механизмам:
- Уменьшают депрессию.
- Потенцируют действие анальгетиков или эндогенных опиатных пептидов.
- Обладают собственными анальгезирующими свойствами, которые заключаются в длительной пролонгации
синаптической активности норадреналина и серотонина.
ХБС — общее показание для применения антидепрессантов, однако некоторые болевые синдромы являются
облигатным показанием для их назначения. К ним относятся нейрогенные болевые синдромы (диабетическая
невропатия, герпетическая невропатия, каузалгия и др.), некоторые виды первичных головных болей
(головная боль мышечного напряжения, мигрень, абузусная головная боль и др.).
IV. Фармакотерапия антидепрессантами ХБС.
В таблице представлены различные группы антидепрессантов, различающихся по механизму своего действия.
В лечении ХБС применяются антидепрессанты — ингибиторы нейронального захвата нейромедиаторов:
неизбирательные и избирательные.
К первой группе относятся трициклические и четырёхциклические антидепрессанты.
1. Трициклические антидепрессанты (амитриптилин, имипрамин, кломипрамин).
Их фармакологическое действие заключается в ингибировании обратного захвата норадреналина и серотонина,
что ведёт к накоплению данных нейромедиаторов в области рецепторов.
Начальная доза трициклических антидепрессантов составляет от 10 до 25 мг вечером, перед сном,
с последующим увеличением суточной дозы на 10-25 мг каждые 3-7 дней до максимальной, составляющей
от 75 мг (мигрень, головные боли напряжения) до 150 мг (нейропатические боли). К концу первой
недели возможен анальгетический эффект, на 2-3 неделе наступает психотропный эффект — улучшается
настроение, повышается трудоспособность, исчезает тревожное ожидание боли. Терапия проводится
несколько месяцев с постепенной отменой.
Побочные эффекты:
- Холинергические: сухость во рту, неясность и затуманивание зрения, запоры, задержка мочеиспускания,
синусовая тахикардия, головокружение. - Гистаминергические: сонливость, увеличение веса.
- Адренергические: ортостатическая гипотензия, кардиотоксичность.
2. Четырёхциклические антидепрессанты (мапротилин-лудиомил, миансерин-леривон).
Отличаются преимущественным действием на норадренергическую трансмиттерную систему. Имеются данные
об эффективности Миансерина (Леривона) при лечении головных болей мышечного напряжения. Кроме
того, препарат удобен при необходимости получения седативного эффекта. В нашей практике Миансерин
с хорошим эффектом применялся при болях в нижней части спины в дозе от 10 до 30 мг в сутки.
Препараты этой группы отличаются минимальными побочными эффектами, к которым можно отнести: сонливость,
увеличение веса и ортостатическую гипотензию.
Селективные ингибиторы обратного захвата серотонина (флуоксетин-прозак, венфлаксин, нефазодон,
сертралин-золофт, пароксетин-паксил).
Роль селективных ингибиторов в лечении хронической боли противоречива и пока существует немного
клинических трайлов, доказывающих их эффективность при нейрогенных болях.
Наибольшую известность получил флуоксетин (прозак) при лечении головных болей: мигрени и, особенно,
хронических головных болей напряжения. Назначается по 1 капсуле (20 мг) 1 раз в сутки в течение
6-8 недель. Значительный эффект по данным отечественных авторов (А.М. Вейн, Т.Г. Вознесенская
и др.) получен у 65% пациентов. Доказано, что флуоксетин вызывает статистически достоверное уменьшение
частоты приступов и их продолжительности.
Селективные ингибиторы обладают минимальной антихолинергической и a-адренергической блокирующей
активностью и тем самым минимальными побочными эффектами (тошнота, рвота, тревожность и беспокойство,
сексуальная дисфункция, головные боли, возбуждение).
V. Оценка эффективности использования антидепрессантов в лечении ХБС.
Согласно последним обзорам применения антидепрессантов с целью анальгезии (Onghena, Van Houdenhove,
1992) в плацебо — контролируемых исследованиях:
- В среднем, среди популяции больных с ХБС, получающих антидепрессанты, эффект встречается у
74%. - Величина анальгетического эффекта при использовании антидепрессантов не зависима от преимущественно
органической или психологической основы боли. - Величина анальгетического эффекта не зависит от антидепрессивной активности препарата, наличия
маскированной депрессии, а также применения антидепрессантов в качестве седативных средств.
Поэтому антидепрессанты с более выраженным седативным эффектом должны быть использованы у пациентов
с нарушениями сна для снижения риска привыкания к гипнотикам. - Не существует очевидных преимуществ в выборе антидепрессантов селективного действия (серотонина
или норадреналина). Однако, антидепрессанты, обладающие низкой селективностью в ингибировании
обратного захвата моноаминов, обладают большим анальгезирующим эффектом.
ОСНОВНЫЕ ТИПЫ ХРОНИЧЕСКОЙ БОЛИ
- Боль в результате непрекращающегося длительного воздействия (грыжа межпозвонкового диска).
- Боль после острой травмы, но продолжающаяся значительно дольше нормального периода заживления
(каузалгия, регионарный болевой синдром, фантомная боль). - Боль без определённой, видимой, заметной причины (головные боли мышечного напряжения,
мигрень).
- Хроническая боль — самостоятельное заболевание, в патогенезе которого ведущее значение
имеют психо-эмоциональные и социальные факторы. При хронической боли может отсутствовать
прямая связь между болью и вызвавшей её причиной. - В механизмах развития хронической боли и депрессии лежат общие медиаторные системы.
- Согласно эпидемиологическим исследованиям существует тесная связь между депрессией и
хронической болью.
Антидепрессанты
(тимоаналептики, тимолептики)
А. Ингибиторы моноаминооксидазы (МАО) а) необратимые ингибиторы МАО: Nialamid, Phenelsine |
Б. Ингибиторы нейронального захвата:
|
В. Антидепрессанты разных групп: Cephedrinum, Citalopram, Tryptophan. |
Г. Препараты других фармакологических групп с антидепрессивным действием: |
ТРИЦИКЛИЧЕСКИЕ АНТИДЕПРЕССАНТЫ
Начальная доза от 10 до 25 мг вечером, перед сном, с последующим увеличением суточной
дозы на 10-25 мг каждые 3-7 дней до максимальной, составляющей от 75 мг (мигрень, головные боли
напряжения) до 150 мг (нейропатические боли).
К концу первой недели возможен анальгетический эффект, на 2-3 неделе наступает
психотропный эффект. Продолжительность лечения несколько месяцев с постепенной отменой.
Побочные эффекты:
1.Холинергические: сухость во рту, неясность и затуманивание зрения, запоры,
задержка мочеиспускания, синусовая тахикардия, головокружение.
2.Гистаминергические: сонливость, увеличение веса.
3.Адренергические: ортостатическая гипотензия, кардиотоксичность.
Соотношение эффективности и осложнений, вызываемых антидепрессантами (McQuay
et al. 1996)
| Хронические болевые синдромы | NNT (number needed to treat) ЧБНЛ — число больных, которых необходимо лечить, чтобы достичь определённого эффекта) | ||
| Уменьшение боли (>50%) | Малые побочные эффекты | Большие побочные эффекты | |
Диабетическая нейропатия | 3 | 2,8 | 19,6 |
Постгерпетическая невралгия | 2,3 | 6 | 19,6 |
Атипичные лицевые боли | 2,8 | — | — |
Центральные боли | 1,7 | 2 | — |
Имипрамин | 3,7 | — | — |
Дезипрамин | 3,2 | — | — |
Комбинированные ТЦА | 3,2 | — | — |
Пароксетин | 5 | — | — |
Флуоксетин | 15,3 | — | — |
Миансерин | — | — | — |
Источник
3.1. Постгерпетическая невралгия (ПГН)
В исследованиях [49,55,97-100] показано, что амитриптилин, нортриптилин и дезипрамин эффективны при лечении боли, связанной с ПГН. Амитриптилин уменьшал боль более чем у 65% пациентов с ПГН [99], однако в другом исследовании процент таких пациентов равен 47 [55]. При сравнении амитриптилина с ТеЦА мапротилином отмечено, что при применении амитриптилина анальгетический эффект был выше. При увеличении дозы амитриптилина наблюдается прямая корреляция между её увеличением и частотой и выраженностью побочных эффектов [98]. При сравнении нортриптилина с амитриптилином показано, что анальгетический эффект данных препаратов одинаковый, однако при приеме нортриптилина чаще наблюдались побочные эффекты [100]. В исследовании [49] установлена эффективность дезипрамина при ПГН.
Рекомендации Европейской Федерации Неврологических Обществ (European Federation of Neurological Societies, EFNS) по фармакологическому лечению невропатической боли. Лечение постгерпетической невралгии: препараты первой линии — ТЦА, прегабалин/габапентин, лидокаин (у пожилых), уровень А; препараты второй линии — опиоиды, капсаицин (крем), уровень А.
3.2. Болевая форма диабетической полиневропатии (БДП)
Установлена эффективность ТЦА – амитриптилина, имипрамина, кломипрамина, дезипрамина, нортриптилина – при БДП [41,53,54,82,83].
При сравнении дезипрамина и амитриптилина показано, что оба препарата оказывают сходное по эффективности действие [54]. Кломипрамин превосходит дезипрамин по эффективности [82]. В отличие от дезипрамина при увеличении дозы имипрамина или кломипрамина анальгетический эффект возрастает [83].
В исследовании [61] показано, что эффективность амитриптилина и габапентина при БДП одинакова.
При сравнении ТЦА и СИОЗС установлена меньшая эффективность последних при БДП [85]. Так, пароксетин уступал в этом отношении имипрамину, вызывая при этом меньше побочных эффектов [54]. При сравнении ряда антидепрессантов оказалось, что около 70% пациентов отмечали значительное уменьшение боли при приеме амитриптилина, 61% — дезимпрамина, 48% — флуоксетина, 41% — плацебо. Циталопрам проявил умеренный эффект при незначительном побочном действии [84].
Дулоксетин оказался высокоэффективным средством при БДП с хорошим профилем безопасности [3,68,69,88]. При этом процент выбывания пациентов из исследования составил 12 [68]. В процессе лечения дулоксетином у некоторых больных диабетом отмечались колебания уровня глюкозы в крови, что не коррелировало с анальгетическим эффектом [45].
Анальгетический эффект дулоксетина превышал таковой у плацебо при использовании препарата в диапазоне доз 60-120 мг/сутки. При этом увеличение дозы не сопровождалось повышением анальгезии, но количество и выраженность побочных эффектов возрастали.
В систематическом обзоре [38], содержащим результаты 6 исследований (460 пациентов с невропатической болью), показано, что в 4-х из них венлафаксин статистически достоверно уменьшал болевой синдром.
Рекомендации EFNS по фармакологическому лечению невропатической боли. Лечение болевой полиневропатии: препараты первой линии — габапентин, прегабалин, ТЦА, СИОЗСН (дулоксетин, венлафаксин), уровень А.
3.3. Центральная невропатическая боль
В исследовании [23] изучали пациентов с болью в результате повреждения спинного мозга. Пациенты были случайно распределены в две группы, одна из которых получала амитриптилин, а другая активное плацебо (плацебо, которое повторяет побочные эффекты исследуемого лекарственного средства, но не то специфическое терапевтическое действие, которым предположительно это средство обладает). При оценке боли до и после лечения выявлена эффективность амитриптилина по сравнению с плацебо. В то же время в литературе встречаются противоположные сведения об эффективности ТЦА при болевых синдромах вследствие повреждения спинного мозга, однако эти сведения основаны на описаниях случаев, а не слепых плацебо-контролируемых исследованиях [29,35]. Показано, что амитриптилин оказывает выраженный анальгетический эффект у пациентов с центральной постинсультной болью [51].
Рекомендации EFNS по фармакологическому лечению невропатической боли. Лечение центральной невропатической боли: препараты первой линии – габапентин, прегабалин уровень А; амитриптилин, уровень В/А.
3.4. Фибромиалгия (ФМ)
ФМ является комплексным заболеванием с большим спектром симптомов, поэтому рассмотрение эффективности лекарственных средств с позиции доказательной медицины достаточно сложно. В связи с этим в литературных источниках можно встретить исследования, в которых эффективность антидепрессантов у пациентов с ФМ не доказана [71], и, напротив, исследования, результаты которых говорят об эффективности антидепрессантов [64].
В исследовании [15] показано, что ТЦА улучшают качество сна, уменьшают тревогу, но не влияют на напряженность и болезненность триггерных точек. В исследовании [24] после 1 месяца лечения ФМ улучшение отмечали 21% пациентов (0% получавших плацебо). После 6 месяцев лечения количество пациентов, отмечающих улучшение, увеличилось до 36 и 19%, соответственно.
В многочисленных исследованиях показано, что СИОЗС вызывают незначительный анальгетический эффект при ФМ. Так, в одном из таких исследований обследовали 22 пациента и сравнили эффект циталопрама и плацебо [63]. После 8 недель лечения (4 недели лечения плацебо, 4 недели — циталопрамом), не обнаружено различий при измерении боли различными шкалами, а также при использовании шкал депрессии.
Применение СИОЗС при ФМ может вызвать парадоксальную реакцию в виде усиления симптомов ФМ. В исследовании [13] показано, что у пациентов с ФМ, которые получали флуоксетин (45 мг/день или более), нарастали такие симптомы, как боль, тревога и депрессия при опросе пациентов с помощью шкалы тяжести ФМ (FIQ). Существует гипотеза, что СИОЗС в больших дозах могут ингибировать обратный нейрональный захват норадреналина, что в свою очередь может косвенно усиливать анальгетический эффект [62].
В систематическом обзоре [27] показано, что пациенты с ФМ, получавшие милнаципран, отмечали больший обезболивающий эффект, чем в контрольной группе.
Традиционно для лечения ФМ используют ТЦА, однако, их побочные эффекты снижают у пациентов приверженность лечению. Напротив, СИОЗС имеют меньше побочных эффектов, но обладают малой эффективностью при данном заболевании. СИОЗСН сочетают низкий риск развития побочных эффектов и обладают достаточной эффективностью. При применении венлафаксина в дозе менее 150 мг/сутки он проявляет свойства СИОЗС, а в дозах более 150 мг/сутки — свойства СИОЗСН. Таким образом, при лечении болевых синдромов данный препарат следует назначать в дозе более 150 мг/сутки.
Дулоксетин проявил эффективность не только в отношении боли, но и других симптомов, сопровождающих ФМ. В исследовании [14] показано, что дулоксетин значительно уменьшает боль, количество триггерных точек и увеличивает болевой порог этих точек по сравнению с плацебо. Показано, что при приеме антидепрессантов, в частности, дулоксетина, значительно улучшается качество жизни пациентов с ФМ, а анальгетические свойства дулоксетина не зависят от его влияния на депрессивное настроение [16].
Подобные сведения об эффективности лечения ФМ получены при использовании милнаципрана [95] и венлафаксина [75].
Рекомендации Техасского университета (США) по лечению фибромиалгии у взрослых (дано в сокращении – представлена только фармакотерапия) [93]. Антидепрессанты: ТЦА – амитриптилин, уровень А; СИОЗСН – дулоксетин, милнаципран, уровень А; венлафаксин, уровень С; СИОЗС – флуоксетин, пароксетин, уровень В; циталопрам, уровень D.
3.5. Другие заболевания
Исторически анальгетический эффект антидепрессантов был впервые описан у пациентов с суставной болью [50]. В отдельных исследованиях показано, что ТЦА уменьшают боль при остеоартрите [21].
Диагноз боли в нижней части спины весьма распространен, он включает широкий спектр различных проблем, что делает его важным для врачей различных специальностей. В единственном отчете о рандомизированном контролируемом исследовании применения доксепина у пациентов с болью в нижней части спины показано, что препарат может оказать умеренный анальгетический эффект и уменьшить симптомы депрессии [43]. В систематическом обзоре 10 исследований [94] не установлено различий между плацебо и антидепрессантами при лечении хронической неспецифической боли в спине. Однако механизм противоболевого действия антидепрессантов основан не только на редукции депрессии (уменьшение выраженности депрессии уменьшает болевой синдром), но и на усилении действия экзогенных (НПВП) и эндогенных анальгезирующих веществ (эндорфины, энкефалины). Поэтому антидепрессанты могут играть важную роль в комплексной терапии боли в спине [1].
Применение амитриптилина у больных с онкологическими заболеваниями и невропатической болью не дало желаемого результата, при этом исследование включало небольшое количество (16) пациентов [58].
Антидепрессанты не проявили эффективности при лечении ВИЧ-ассоциированной сенсорной невропатии [48].
4. Безопасность и побочные эффекты антидепрессантов
Безопасность антидепрессантов неодинакова при их применении в неврологической и психиатрической практике. Для лечения болевых синдромов обычно используют небольшие дозы антидепрессантов (в 2 и более раз меньше), чем при лечении депрессии.
При применении современных антидепрессантов частота возникновения и выраженность побочных эффектов ниже, чем при приеме ТЦА. В мета-анализе [17] исследовали переносимость ТЦА и СИОЗС, используемых для лечения депрессии; был вычислен NNtH – number needed to harm (в данном случае этот показатель показывает количество пациентов, получающих лекарство, из которых один вынужден прекратить прием данного препарата из-за побочных эффектов). Для ТЦА этот показатель составил от 5 до 11 и от 21 до 94 для СИОЗС.
У пациентов с тяжелой депрессией (с бредовыми идеями самообвинения и самоуничижения, суицидальными мыслями) повышен риск суицида, поэтому необходимо участие психиатра в лечении такого пациента [2].
При приеме антидепрессантов часто отмечается увеличение массы тела. При использовании данных препаратов для лечения депрессии улучшение настроения оказывало положительное влияние на аппетит. ТЦА чаще, чем СИОЗС вызывают увеличение массы тела пациентов, что отрицательно сказывается на приверженности пациентов к лечению [33].
При приеме ТЦА часто наблюдаются побочные эффекты, связанные с действием на холинергическую систему: как сухость во рту, седация, затруднение мочеиспускания, запоры.
В исследовании [36] изучали группу из более 2200 пациентов с переломом бедра; 70% принимали лекарственную терапию до момента перелома. При сравнении с группой контроля оказалось, что эти пациенты принимали ТЦА или СИОЗС в два раза чаще, что свидетельствует об увеличении риска падений при приеме антидепрессантов.
При назначении любых препаратов беременным следует соблюдать особую осторожность. Показано, что ни ТЦА, ни СИОЗС не могут быть применены во время беременности, так как это сопряжено с высоким риском развития врожденных пороков развития [31].
С осторожностью следует назначать любые препараты с седативным эффектом пациентам, которые водят автотранспорт. В исследовании [67] обследовали пациентов после однократного приема (без титрования дозы) антидепрессанта с седативным эффектом (амитриптилин, имипрамин, доксепин, миансерин) и тестировали их на способность управлять автомобилем. Полученные данные были сопоставимы, как если бы пациенты приняли алкоголь в дозе, эквивалентной 0,8 мг/мл. При дальнейшем приеме антидепрессантов в течение недели способность управлять автомобилем была такой же, как и в контрольной группе (получавшей плацебо). Исключение составили пациенты, получавшие миансерин – их способность управлять автомобилем осталась нарушенной. Отмечено, что одновременный прием бензодиазепинов с антидепрессантами значительно нарушает способность управлять автомобилем. При приеме СИОЗС не отмечено влияния на способность управлять автомобилем. Во время приема ТЦА пациенты должны быть предупреждены, что необходимо избегать управления автомобилем во время титрования препарата. Также пациентов следует предупреждать о взаимодействии ТЦА с другими препаратами, обладающими седативными свойствами.
Установлено, что для флуоксетина характерен повышенный риск развития пептических язв, чем для других СИОЗС [20]. В крупном исследовании обследовали более 15000 пациентов, которые впервые начали систематически принимать НПВП с антидепрессантами или только НПВП. Подсчитывали количество первых случаев описания пептических язв (при приеме НПВП и без них), на второй день при приеме НПВП и на 10-й день при приеме антидепрессантов. 619 пациентов получали ТЦА (без НПВП) – инцидентность пептических язв составила 0,051. В группе, получавших только СИОЗС (1181 пациент), инцидентность — 0,06. При одновременном приеме СИОЗС и НПВП (86 пациентов) инцидентность — 0,634, а в группе, получавшей ТЦА и НПВП – 0,127. Полученные данные позволяют сделать вывод, что при назначении СИОЗС и НПВП следует соблюдать осторожность в отношении развития пептических язв [26].
5. Заключение
Многочисленные исследования, в том числе выполненные с соблюдением принципов доказательной медицины, свидетельствуют о том, что антидепрессанты являются эффективными средствами в лечении ряда болевых синдромов. Клинические и экспериментальные данные подтверждают предположение о том, что анальгетические свойства этой группы веществ имеют самостоятельный характер и не являются вторичными по отношению к их основному – антидепрессивному – эффекту.
Однако стоит иметь в виду, что антидепрессанты оказывают действие на болевой синдром опосредованно, поэтому их целесообразно использовать в комбинации с другими методами лечения (лекарственными и нелекарственными). В настоящее время не существует универсального алгоритма выбора антидепрессанта для лечения болевого синдрома, так как у каждого пациента существует различный вклад дисфункционального компонента в общую картину заболевания. Поэтому для лечения пациентов с хроническими болевыми синдромами необходим мультидисциплинарный подход (с участием врача-психиатра и других специалистов) для определения и реализации индивидуального плана лечения.
Источник
