Аллотропия код по мкб


Аллотропия – что это?
Явление аллотропии подразумевает возможность создания из одного и того же элемента определенного количества различных веществ. Например, кислород и озон в своем составе содержат только лишь оксиген. Вопрос о том, как это вообще возможно, на протяжении длительного периода времени интересовал многих людей. На сегодняшний момент ученые легко могут объяснить все особенности этого процесса.
Определение понятия
Под аллотропией подразумевается существование нескольких простых веществ, в основе которых присутствует один и тот же единственный химический элемент. Впервые такое явление описал известный шведский химик и минеролог Йенс Берцелиус.
Аллотропия по своей сути имеет довольно много общего с кристаллическим полиморфизмом. В связи с этим у ученых на протяжении длительного периода времена существовали достаточно серьезные споры. Это связанно с тем, что часть специалистов считали, что аллотропия и кристаллический полиморфизм – это одно и то же явление.
В настоящее же время от этой теории большинство ученых отошло. Мировое научное сообщество пришло к выводу о том, что кристаллический полиморфизм может касаться только лишь твердых тел, тогда как аллотропия – газов и жидкостей.
Причины возникновения аллотропии
Далеко не все элементы способны образовывать несколько разных простых веществ. Такая способность напрямую зависит от структуры молекул. Чаще всего подобное явление наблюдается у элементов, которые имеют переменные окислительные степени. Это касается таких групп, как:
- неметаллы;
- полуметаллы;
- благородные газы;
- галогены.
Причины аллотропии могут быть нескольких типов. К наиболее вероятным из них ученые относят такие факторы, как:
- Различное количество атомов, необходимых для образования одной молекулы.
- Отличающийся порядок сопряжения атомов в одну молекулу.
- Параллели между спинами электронов.
- Разновидность кристаллической решетки.
Для того чтобы наглядно понять, каким образом может существовать явление аллотропии, необходимо рассмотреть несколько наиболее примечательных примеров, широко встречающихся в природе.
Кислород и озон
Аллотропия кислорода и озона – это вариант того, как различное количество атомов может существенно влиять не только на физические, но и на химические свойства простых веществ. Для того чтобы понять это, необходимо разобраться в особенностях каждого из этих газов:
- Кислород. Он не имеет вкуса и запаха. Масса этого газа в 1,5 раза легче массы озона. Кислород неплохо растворяется в воде. Чем ниже температура окружающей среды, тем быстрее происходит этот процесс. Используется данный газ для осуществления дыхания живыми организмами. Вследствие этого кислород считается жизненно важным химическим веществом для жизнедеятельности на планете.
- Озон. Это газообразное вещество имеет голубоватый цвет. Характерный запах озона легко можно почувствовать на улице после прошедшего дождя. В сравнении с кислородом этот газ более активный. Это связанно с тем, что при его распаде появляется молекула кислорода и один атом оксигена. Последний в свою очередь вступает в связь с другими атомами, образуя, таким образом, новые вещества.
Аллотропия оксигена была исследована из-за своего распространения одной из первых.
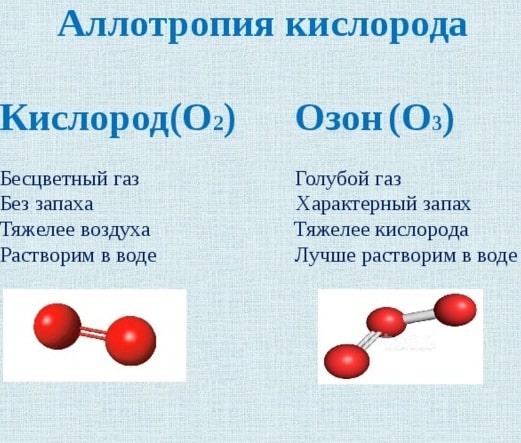
Алмаз и графит
Молекула углерода отличается тем, что она имеет постоянное количество атомов. При этом из последних могут образовываться самые разнообразные простые вещества. Это касается, к примеру, алмаза и графита. Их отличия заключаются в следующем:
- Алмаз. Это вещество признано учеными одним из наиболее твердых на Земле. Это связанно с тем, что атомы в нем имеют достаточно прочные ковалентные связи во всех направлениях кристаллической решетки. Таким образом, создается объемная система тетраэрдов.
- Графит. В этом веществе прочные связи в кристаллической решетке образовываются только лишь в горизонтальном направлении. Вследствие этого разломать стержень из графита вдоль очень сложно.
Аллотропия алмаза и графита – один из примеров того, как из одного и того же химического элемента из-за разной кристаллической решетки образуются существенно отличающиеся друг от друга простые вещества.
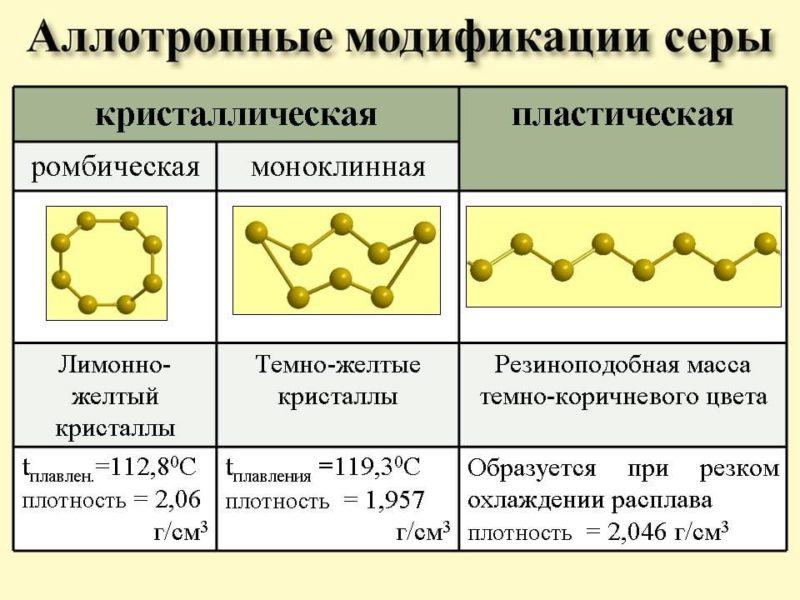
Сера
Внутренняя структура молекул серы может быть различной. Вследствие этого происходит образование различных простых веществ, среди которых стоит выделить такие:
- Сера с ромбической структурой молекул. Она считается наиболее устойчивой. В ее состав входит 8 атомов, которые образовывают твердое вещество желтоватого оттенка. Оно неспособно растворяться в воде. К тому же, последняя его даже не смачивает. При этом показатели проводимости тепла и тока у такой серы находятся на низком уровне.
- Сера с моноклинной структурой. Ее атомы образовывают параллелепипеды со скошенными углами. Таким образом, создается вещество, похожее на иглу темно-желтого цвета.
- Сера с пластической структурой. Ее создают посредством расплавления других типов этого вещества и помещения их в воду. Таким образом, у них рушится структура, вследствие чего возникают полимерные цепи разной длины. Они в свою очередь создают резиноподобную пасту светло-коричневого оттенка.
Аллотропия серы – еще один пример влияния внутренней структуры молекул на создание разных по своим свойствам простых веществ.
Фосфор
На сегодняшний момент известно около 11 видов фосфора. Это обусловлено аллотропией, причина которой связана с кристаллической решеткой молекул этого химического элемента. Для того чтобы изменить внутреннее строение, необходимо создать определенные условия.
К примеру, белый фосфор может быть выделен посредством испарения мочи. Такое вещество будет очень активным, вследствие чего при повышении температурных показателей окружающей среды до 40 градусов по Цельсию оно воспламенится из-за реакции с кислородом.
Для получения красного фосфора достаточно всего лишь увеличить давление и температуру в атмосфере двуокиси углерода. Это вещество отличается средней активностью. Вследствие этого оно не светится в темноте. При нагревании красный фосфор преобразовывается в пар. Это можно наблюдать при зажигании спичек.
Аллотропия – это образование нескольких отличающихся друг от друга веществ из одного и того же химического элемента. Наблюдать такое явление можно преимущественно у неметаллов. Его основные причины заключаются, как в разном количестве атомов, что образовывают молекулу, так и в изменениях кристаллической решетки.
Поделитесь статьёй в социальных сетях:
Источник
Из нашей статьи вы узнаете, что такое аллотропия. Это понятие широко распространено в природе. К примеру, кислород и озон — это вещества, состоящие только из химического элемента оксигена. Как это возможно? Давайте разбираться вместе.
Определение понятия
Аллотропией называют явление существования одного химического элемента в виде двух или более простых веществ. Его открывателем по праву считается химик и минеролог из Швеции Йенс Берцелиус. Аллотропия — это явление, которое имеет много общего с полиморфизмом кристаллов. Это вызвало долгие споры среди ученых. В настоящее время они пришли к мнению, что полиморфизм характерен только для твердых простых веществ.
Причины аллотропии
Образовывать несколько простых веществ могут не все химические элементы. Способность к аллотропии обусловлена строением атома. Чаще всего она встречается у элементов, имеющих переменное значение степени окисления. К ним относятся полу- и неметаллы, инертные газы и галогены.
Аллотропия может быть обусловлена несколькими причинами. К ним относится разное количество атомов, порядок их соединения в молекулу, параллельность спинов электронов, тип кристаллической решетки. Рассмотрим данные виды аллотропии на конкретных примерах.
Кислород и озон
Данный вид аллотропии — пример того, как разное количество атомов одного химического элемента определяет физические и химические свойства вещества. Это касается и физиологического влияния на живые организмы. Так, кислород состоит из двух атомов оксигена, озон — из трех.
В чем же отличия этих веществ? Оба они газообразны. Кислород не имеет цвета, вкуса и запаха, он в полтора раза легче озона. Это вещество хорошо растворяется в воде, причем с понижением температуры скорость этого процесса только увеличивается. Кислород необходим всем организмам для дыхания. Поэтому это вещество является жизненно важным.
Озон имеет голубой цвет. Его характерный запах ощущал каждый из нас после дождя. Он резкий, но довольно приятный. По сравнению с кислородом, озон более химически активен. В чем же причина? При разложении озона образуется молекула кислорода и свободный атом оксигена. Он тут же вступает в реакции соединения, образуя новые вещества.
Удивительные свойства углерода
А вот количество атомов в молекуле углерода всегда остается неизменным. При этом он образует абсолютно разные вещества. Самыми распространенными модификациями углерода являются алмаз и графит. Первое вещество считается самым твердым на планете. Это свойство обусловлено тем, что атомы в алмазе связаны прочными ковалентными связями по всем направлениям. В совокупности они образуют трехмерную сеть из тетраэдров.

У графита прочные связи формируются только между атомами, расположенными в горизонтальной плоскости. По этой причине разломать графитовый стержень вдоль практически невозможно. А вот связи, которые соединяют горизонтальные слои углерода между собой, очень слабые. Поэтому каждый раз, когда мы проводим простым карандашом по бумаге, на ней остается серый след. Это и есть слой углерода.
Аллотропия серы
Причина модификаций серы также заключается в особенностях внутренней структуры молекул. Самой устойчивой формой является ромбическая. Кристаллы этого вида аллотропии серы называют ромбоидальными. Каждый из них образован коронообразными молекулами, в состав каждой из которой входит 8 атомов. По физическим свойствам ромбическая сера является твердым веществом желтого цвета. Она не только не растворяется в воде, но даже не смачивается ею. Показатели тепло- и электропроводности очень низкие.

Структура моноклинной серы представлена параллелепипедом со скошенными углами. Визуально это вещество напоминает иглы темно-желтого цвета. Если серу расплавить, а потом поместить в холодную воду, образуется ее новая модификация. Ее первоначальная структура разрушится до полимерных цепей разной длины. Так получают пластическую серу — резиноподобную массу коричневого цвета.
Модификации фосфора
Ученые насчитывают 11 видов фосфора. Его аллотропия была открыта практически случайно, как и само это вещество. В поисках философского камня алхимик Бранд получил светящуюся сухую субстанцию в результате выпаривания мочи. Это был белый фосфор. Данное вещество характеризуется большой химической активностью. Достаточно повышения температуры до 40 градусов, чтобы белый фосфор вступил в реакцию с кислородом и воспламенился.

Для фосфора причина аллотропии — это изменение в структуре кристаллической решетки. Изменить ее можно только при определенных условиях. Так, увеличив давление и температуру в атмосфере углекислого газа, получают красный фосфор. Химически он менее активен, поэтому для него не характерно свечение. При нагревании он превращается в пар. Мы наблюдаем это каждый раз, зажигая обычные спички. Терочная поверхность как раз содержит красный фосфор.
Итак, аллотропия — это существование одного химического элемента в виде нескольких простых веществ. Чаще всего встречается среди неметаллов. Основными причинами этого явления считаются разное количество атомов, образующих молекулу вещества, а также изменение конфигурации кристаллической решетки.
Источник
Углерод — химический элемент № (6). Он расположен в IVА группе Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления (–4), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: ( +2) или (+4).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ. В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления ((3700) °С).
Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
- Взаимодействие с металлами.
Углерод реагирует с металлами при высокой температуре с образованием карбидов:
4Al0+3C0=tAl+34C−43.
В этой реакции углерод выступает как окислитель.
- Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0+2H02=tC−4H+14.
- Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0+O02=tC+4O−22.
- Взаимодействие с оксидами металлов.
Углерод способен восстанавливать металлы из их оксидов:
2Cu+2O+C0=t2Cu0+C+4O2.
Применение простых веществ
Алмаз применяется:
- для обработки твёрдых поверхностей;
- для резки стекла;
- для изготовления буров и свёрл;
- для изготовления ювелирных украшений.
Графит используется:
- при изготовлении карандашей;
- как твёрдая смазка в подшипниках;
- для изготовления электродов;
- в качестве замедлителя нейтронов в ядерных реакторах;
- для получения искусственных алмазов.
Сажа:
- входит в состав типографской краски, крема для обуви;
- используется как наполнитель для производства резины.
Уголь используется:
- в противогазах, промышленных и бытовых фильтрах;
- для очистки сахарного сиропа, спирта и т. д.;
- в медицине.
Кокс применяется в металлургической промышленности.
Источник
В предыдущей главе было сказано, что образовывать связи друг с другом могут не только атомы одного химического элемента, но также атомы разных элементов. Вещества, образованные атомами одного химического элемента, называют простыми веществами, а вещества, образованные атомами разных химических элементов, — сложными. Некоторые простые вещества имеют молекулярное строение, т.е. состоят из молекул. Например, молекулярное строение имеют такие вещества, как кислород, азот, водород, фтор, хлор, бром, йод. Каждое из этих веществ образовано двухатомными молекулами, поэтому их формулы можно записать как O2, N2, H2, F2, Cl2, Br2 и I2 соответственно. Как можно заметить, простые вещества могут иметь одинаковое название с элементами, их образующими. Поэтому следует четко различать ситуации, когда речь идет о химическом элементе, а когда о простом веществе.
Нередко простые вещества имеют не молекулярное, а атомное строение. В таких веществах атомы могут образовывать друг с другом связи различных типов, которые подробно будут рассмотрены чуть позже. Веществами подобного строения являются все металлы, например, железо, медь, никель, а также некоторые неметаллы — алмаз, кремний, графит и т.д. Для данных веществ обычно характерно не только совпадение названия химического элемента с названием им образованного вещества, но также идентичны запись формулы вещества и обозначения химического элемента. Например, химические элементы железо, медь и кремний, имеющие обозначения Fe, Cu и Si, образуют простые вещества, формулы которых Fe, Cu и Si соответственно. Существует также небольшая группа простых веществ, состоящих из разрозненных атомов, никак не связанных между собой. Такие вещества являются газами, которые называют, ввиду их крайне низкой химической активности, благородными. К ним относятся гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn).
Поскольку только известных простых веществ насчитывается около 500, то логично вытекает вывод о том, что для многих химических элементов характерно явление, называемое аллотропией.
Аллотропия – явление, когда один химический элемент может образовывать несколько простых веществ. Разные химические вещества, образованные одним химическим элементом, называют аллотропными модификациями или аллотропами.
Так, например, химический элемент кислород может образовывать два простых вещества, одно и которых имеет название химического элемента – кислород. Кислород как вещество состоит из двухатомных молекул, т.е. формула его O2. Именно данное соединение входит в состав жизненно необходимого нам воздуха. Другой аллотропной модификацией кислорода является трехатомный газ озон, формула которого O3. Несмотря на то что и озон, и кислород образованы одним химическим элементом, их химическое поведение весьма различно: озон отличается намного большей активностью по сравнению с кислородом в реакциях с теми же веществами. Кроме того, данные вещества отличаются друг от друга по физическим свойствам уже как минимум из-за того, что молекулярная масса озона больше, чем у кислорода в 1,5 раза. Это приводит к тому, что его плотность в газообразном состоянии также больше в 1,5 раза.
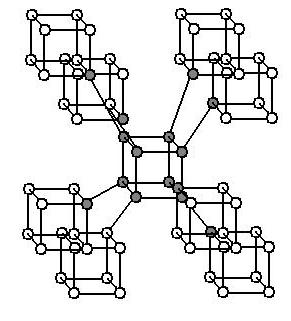
Многие химические элементы склонны образовывать аллотропные модификации, отличающиеся друг от друга особенностями строения кристаллической решетки. Так, например, на рисунке 5, вы можете видеть схематичные изображения фрагментов кристаллических решеток алмаза и графита, которые являются аллотропными модификациями углерода.

Рисунок 5. Фрагменты кристаллических решеток алмаза (а) и графита (б)
Кроме того, углерод может иметь и молекулярное строение: такая структура наблюдается у такого типа веществ, как фуллерены. Вещества данного типа образованы молекулами углерода сферической формы. На рисунке 6 представлены 3D модели молекулы фуллерена с60 и футбольного мяча для сравнения. Обратите внимание на их интересное сходство.

Рисунок 6. Молекула фуллерена С60 (а) и футбольный мяч (б)
Сложные вещества — это вещества, которые состоят из атомов разных элементов. Они так же, как и простые вещества, могут иметь молекулярное и немолекулярное строение. Немолекулярный тип строения сложных веществ может быть более разнообразен, нежели у простых. Любые сложные химические вещества могут быть получены либо прямым взаимодействием простых веществ, либо последовательностью их взаимодействий друг с другом. Важно осознавать один факт, который заключается в том, что свойства сложных вещества как физические, так и химические сильно отличаются от свойств простых веществ, из которых они получены. Например, поваренная соль, имеющая форуму NaCl и представляющая собой бесцветные прозрачные кристаллы, может быть получена взаимодействием натрия, являющегося металлом с характерными для металлов свойствами (блеск и электропроводность), с хлором Cl2 — газом желто-зеленого цвета.
Серная кислота H2SO4 может быть образована серией последовательных превращений из простых веществ — водорода H2, серы S и кислорода O2. Водород — газ легче воздуха, образующий с воздухом взрывчатые смеси, сера — твердое вещество желтого цвета, способное гореть, и кислород — газ чуть тяжелее воздуха, в котором могут гореть многие вещества. Серная кислота, которая может быть получена из данных простых веществ, представляет собой тяжелую маслянистую жидкость, обладающая сильными водоотнимающими свойствами, из-за которых обугливает многие вещества органического происхождения.
Очевидно, что помимо индивидуальных химических веществ, бывают также и их смеси. Преимущественно именно смесями различных веществ образован мир вокруг нас: сплавы металлов, продукты питания, напитки, различные материалы, из которых состоят окружающие нас предметы.
Например, воздух, которым мы дышим, состоит в основном из азота N2 (78%), жизненно необходимого нам кислорода (21%), оставшийся же 1% приходится на примеси других газов (углекислый газ, благородные газы и др.).
Смеси веществ разделяют на гомогенные и гетерогенные. Гомогенными смесями называют такие смеси, у которых нет границ раздела фаз. Гомогенными смесями являются смесь спирта и воды, сплавы металлов, раствор соли и сахара в воде, смеси газов и т.д. Гетерогенными смесями называют такие смеси, у которых имеется граница раздела фаз. К смесям такого типа можно отнести смесь песка и воды, сахара и соли, смесь масла и воды и др.
Вещества, из которых состоят смеси, называют компонентами.
Смеси простых веществ в отличие от химических соединений, которые могут быть получены из этих простых веществ, сохраняют свойства каждого компонента.
Источник
