Абдоминальный компартмент синдром способы декомпрессии

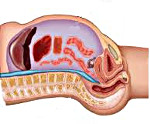
Абдоминальный компартмент-синдром – это комплекс патологических изменений, которые возникают на фоне стойкого повышения внутрибрюшного давления (ВБД) и вызывают развитие полиорганной недостаточности. Наблюдается после операций, при тяжелых повреждениях и заболеваниях органов брюшной полости, забрюшинного пространства, реже – при экстраабдоминальной патологии. Проявляется сердечной, почечной, дыхательной недостаточностью, нарушениями работы печени и ЖКТ. Основу ранней диагностики составляют повторные измерения ВБД, дополнительно используются данные инструментальных и лабораторных исследований. Лечение – срочная оперативная декомпрессия, инфузионная терапия, ИВЛ.
Общие сведения
Абдоминальный компартмент-синдром (АКС) – грозное осложнение, встречающееся при тяжелых заболеваниях, травматических повреждениях и хирургических вмешательствах. Первые сообщения об отрицательном влиянии увеличенного интраабдоминального давления на состояние больных появились в конце XIX века, но патогенез АКС и значение синдрома как причины смертности были установлены только в 80-х годах прошлого века.
По разным данным, патология диагностируется у 2-30% больных, прооперированных по поводу травм живота. Среди пациентов, находящихся на момент поступления в критическом состоянии и нуждающихся в проведении реанимационных мероприятий, значимое повышение внутрибрюшного давления обнаруживается более чем в 50% случаев, клинические признаки АКС выявляются примерно в 4% случаев. Без лечения летальность составляет 100%.
Абдоминальный компартмент-синдром
Причины
Брюшная полость представляет собой замкнутое пространство, ограниченное костными и мягкотканными структурами. В норме давление в ней близко к нулю. При ожирении и в период беременности данный показатель повышается, однако из-за медленного развития изменений организм больного постепенно приспосабливается к этому состоянию. При быстром увеличении ВБД организм пациента не успевает адаптироваться к изменениям, что влечет за собой нарушения деятельности различных органов. Вероятность формирования АКС возрастает при наличии следующих факторов:
- Уменьшение растяжимости брюшной стенки. Обнаруживается при обширных грубых рубцах, интенсивных абдоминальных болях, мышечном спазме, после пластики крупных грыж, при плевропневмонии, в период проведения ИВЛ, особенно – на фоне некорректных настроек параметров искусственного дыхания.
- Увеличение объема содержимого брюшной полости. Отмечается при крупных новообразованиях, кишечной непроходимости, больших гематомах в области забрюшинной клетчатки, аневризмах брюшной аорты.
- Скопление жидкости либо газа. Причиной скопления жидкости может стать перитонит, гемоперитонеум при травмах, асцит при опухолях, циррозе печени и других заболеваниях. Значимый пневмоперитонеум обычно возникает при торакоабдоминальных повреждениях с нарушением целостности легкого и диафрагмы. Определенную роль может играть нагнетание воздуха в брюшную полость при эндоскопических вмешательствах.
- Синдром капиллярной утечки. Характеризуется повышением проницаемости капилляров и выходом жидкости в ткани из сосудистого русла. Наблюдается при сепсисе, обширных ожогах, ацидозе, коагулопатии, переохлаждении, массивном переливании крови и кровезаменителей, растворов для внутривенных инфузий.
Разнородность провоцирующих факторов является причиной возникновения компартмент-синдрома при широком круге заболеваний и состояний, в том числе, не связанных с абдоминальной патологией. Наиболее частыми причинами АКС становятся тяжелые травмы живота, внутрибрюшные кровотечения различного генеза, пересадка печени, перитонит, острый деструктивный панкреатит, множественные переломы тазовых костей, обширные ожоги, инфузионная терапия шоковых состояний. Реже синдром наблюдается при кишечной непроходимости, после пластики грыжи, при проведении перитонеального диализа.
Патогенез
При повышении интраабдоминального давления нарушается кровоток в брюшной полости, это провоцирует повреждение слизистой желудка и кишечника вплоть до формирования участков некроза, прободения полого органа и развития перитонита. Расстройства кровообращения в сосудах печени становятся причиной омертвения более чем 10% гепатоцитов и соответствующих изменений печеночных проб.
Страдает барьерная функция кишечника, что проявляется контактным, лимфогенным и гематогенным распространением бактериальных агентов. Увеличивается вероятность возникновения инфекционных осложнений. Сдавление прооперированных органов потенцирует несостоятельность анастомозов.
Диафрагма смещается кверху, это вызывает повышение давления в плевральной полости и расстройства воздухообмена. Возникает дыхательный, а в последующем – метаболический ацидоз. Формируется респираторный дистресс-синдром. Нарушается снабжение миокарда кислородом. Из-за сдавления крупных венозных стволов повышается центральное венозное давление, уменьшается венозный возврат к сердцу, развивается внутричерепная гипертензия, обусловленная затруднением оттока крови из головного мозга.
Вследствие сдавления почек ухудшается кровообращение в почечной паренхиме, нарушается клубочковая фильтрация, образуются очаги некроза. Поражение почечной ткани провоцирует повышение содержания гормонов, участвующих в регуляции функции почек. У части больных наблюдается острая почечная недостаточность с олигурией или анурией.
Классификация
Устойчивое повышение ВБД носит название интрабрюшной гипертензии. Для определения тактики лечения используют классификацию Берча с соавторами, в которой выделяется четыре степени этого состояния: 12-15, 16-20, 21-25 и более 25 мм рт. ст. АКС ассоциируется с интраабдоминальным давлением, составляющим 20 мм рт. ст. или более, точные показатели, при которых наступают жизнеугрожающие изменения, пока не установлены. С учетом этиологического фактора различают три варианта абдоминального компартмент-синдрома:
- Первичный. Провоцируется патологическими процессами в полости живота и забрюшинном пространстве. Обнаруживается при травмах, перитоните, панкреатите, разрыве аневризмы брюшной аорты, обширных абдоминальных операциях, крупных гематомах забрюшинной клетчатки.
- Вторичный. Формируется при экстраабдоминальных патологических процессах. Диагностируется при тяжелых ожогах, сепсисе, массивных инфузиях.
- Третичный. Характеризуется повторным возникновением симптоматики у больных, перенесших первичный либо вторичный варианты синдрома. Причиной обычно становится изменение факторов, влияющих на ВБД, например, ушивание лапаростомы. Показатели смертности выше, чем при других формах.
Симптомы АКС
Клинические проявления патологии неспецифичны, включают нарушения со стороны разных органов и систем, свидетельствующие о развитии и прогрессировании полиорганной недостаточности. Данные о первых симптомах разнятся. Одни исследователи указывают, что синдром манифестирует напряжением брюшных мышц, увеличением объема живота, которые сочетаются с дыхательными расстройствами, уменьшением диуреза. Другие специалисты полагают, что дыхательные нарушения и олигурия опережают абдоминальную симптоматику.
Дыхание частое, поверхностное. Олигурия сменяется анурией. Отмечается учащение сердцебиения, снижение артериального давления при неизмененном либо повышенном ЦВД. Явления дыхательной, сердечной и почечной недостаточности быстро нарастают, при самостоятельном дыхании возникает необходимость перевода пациента на ИВЛ, требуется стимуляция диуреза, но использование диуретиков нередко не обеспечивает желаемого результата. При отсутствии декомпрессии наступает смерть от прогрессирующего нарушения деятельности жизненно важных органов.
Осложнения
Характерными осложнениями компартмент-синдрома, возникшего после хирургических вмешательств, являются несостоятельность швов и анастомозов, нагноение ран. Возрастает вероятность образования внутрибрюшных абсцессов, перитонита, сепсиса. После проведения декомпрессионной лапаротомии у 90% больных формируются грыжи и кишечные свищи, у 22% образуются множественные лигатурные свищи.
Из-за нарушения функции легких повышается риск пневмонии. У некоторых пациентов с явлениями ОПН в отдаленном периоде развивается хроническая почечная недостаточность. Увеличивается продолжительность лечения основных заболеваний, отмечаются худшие функциональные исходы при травмах.
Диагностика
Из-за неспецифичности проявлений и других возможных причин полиорганной недостаточности диагностика данного состояния на основании клинических симптомов вызывает существенные затруднения. С учетом тяжести патологии и ее угрозы для жизни больного оптимальным вариантом считается периодическое профилактическое измерение ВБД у лиц с риском развития компартмент-синдрома.
В случае наличия лапоростомы, дренирования брюшной полости, выполнения перитонеального диализа либо лапароскопии возможны прямые измерения показателя, но из-за сложности и инвазивности эти методы применяются редко. Обычно используются следующие диагностические процедуры:
- Измерение давления в мочевом пузыре. Является наиболее распространенным исследованием. Производится путем катетеризации после выведения мочи и введения 20-25 мл теплого раствора.
- Другие варианты измерения ВБД. Для оценки показателя используется желудок (через назогастральный зонд) и нижняя полая вена. Показатели измерений могут несколько расходиться с реальным ВБД, однако корректно проведенные повторные процедуры позволяют получить достаточно точную картину изменения внутрибрюшного давления.
- Лабораторные исследования. При анализе газов артериальной крови определяется острый дыхательный алкалоз. В крови обнаруживается повышение уровня лактата, мочевины, креатинина, аланинаминотрансферазы, щелочной фосфатазы, снижение pH крови. В анализах мочи выявляется протеинурия, эритроцитурия, цилиндрурия.
- Рентгенография грудной клетки. На рентгенограммах отмечается подъем куполов диафрагмы.
Лечение абдоминального компартмент-синдрома
Основным методом лечения АКС считается хирургическая декомпрессия, но показания к вмешательству пока точно не определены. В клинической практике часто используется алгоритм, согласно которому при 1 и 2 степени интраабдоминальной гипертензии рекомендуется наблюдение и коррекция инфузионной терапии, при 3 – декомпрессивная лапаротомия на фоне интенсивной терапии, при 4 – неотложная оперативная декомпрессия и реанимационные мероприятия.
При наличии асцита на начальном этапе возможно проведение пункции брюшной полости, лапароцентеза либо лапароскопии с последующим дренированием. Хирургическую декомпрессию выполняют в условиях операционной или отделения интенсивной терапии. Применяют поперечный или срединный разрез. В дальнейшем осуществляют ведение методом «открытого живота». При нормализации ВБД, отсутствии отека внутренних органов и окружающих тканей рану ушивают на 1-8 сутки. В остальных случаях производят отсроченное закрытие лапаростомы. Для снижения риска развития грыж устанавливают сетчатые трансплантаты.
Оперативные мероприятия осуществляют на фоне контроля жизненных показателей, ИВЛ, стимуляции диуреза, коррекции обменных расстройств, предупреждения сердечно-сосудистого коллапса вследствие снижения периферического сосудистого сопротивления, профилактики сердечных нарушений, обусловленных поступлением лактата и калия в кровоток после устранения ишемии.
Прогноз и профилактика
Прогноз при абдоминальном компартмент-синдроме определяется своевременностью проведения лечебных мероприятий. При оперативной декомпрессии в течение первых 6 часов после появления признаков АКС (до формирования развернутой картины полиорганной недостаточности) выживаемость составляет 80%. При поздних вмешательствах погибает 43-65% пациентов. При отсутствии мероприятий по декомпрессии летальность достигает 100%.
Профилактика включает врачебную настороженность при поступлении больных с риском формирования АКС, регулярное измерение ВГД, адекватную респираторную поддержку, корректную инфузионную терапию. Некоторые авторы предлагают не накладывать швы на апоневроз при тяжелых травмах живота и других патологиях, провоцирующих АКС, однако эта мера не всегда оказывается эффективной.
Источник
Абдоминальным компартмент-синдромом (АКС) называют внезапное повышение давления в брюшной полости, которая представляет собой замкнутое пространство, в результате чего возникают глубокие нарушения функций дыхательной и сердечно-сосудистой систем, а также снижается перфузия печени, кишечника, почек и головного мозга [1, 10, 18].
Негативное влияние повышенного внутрибрюшного давления (ВБД) на различные органы и системы организма человека известно уже на протяжении почти 100 лет. Впервые связь между повышенным давлением в брюшной полости и нарушением функции сердечно-сосудистой системы с летальным исходом описал Эмерсон в 1911 г. [4]. Однако понимание того, что брюшная полость является замкнутым пространством, и стройная концепция внутрибрюшной гипертензии, которая может реализоваться в АКС, впервые появились в 80-х годах XX века [19]. Лишь через 10 лет после выявления патофизиологических закономерностей развития данного состояния стали внедряться хирургические методы его коррекции.
В норме ВБД близко к нулю. После лапаротомии оно может подниматься до 10 мм рт.ст., а изменения функции внутренних органов появляются при быстром подъеме давления в брюшной полости выше 15 мм. Таким образом, под термином «внутрибрюшная гипертензия» (ВБГ) понимается увеличение ВБД выше 15 мм рт.ст., что сопровождается начальными явлениями физиологических нарушений в организме [20].
В свою очередь о возникновении АКС можно говорить в том случае, когда ВБГ сопровождается недостаточностью функции одного или нескольких органов [18].
Выделяют 4 степени повышения ВБД: при I давление в брюшной полости составляет 10-15 мм рт.ст., при II — 16-25 мм, при II — 26-35 мм и при IV превышает 35 мм рт.ст., компартмент-синдром чаще возникает при II и IV степенях ВБГ [3, 17, 18].
Для измерения ВБД предложены прямые и непрямые методы. В настоящее время наиболее простым и распространенным является способ непрямой оценки давления в брюшной полости по уровню давления в мочевом пузыре. Метод не требует специальной аппаратуры и позволяет осуществлять мониторинг на протяжении любого необходимого промежутка времени. В группе больных с высоким риском развития ВБГ измерение внутрибрюшного давления проводят каждые 12 ч, а при необходимости и чаще [11, 13]. При этом необходимо обратить внимание на то, что величина давления в мочевом пузыре должна оцениваться только в совокупности с клинико-лабораторными показателями в связи с тем, что существует так называемая хроническая ВБГ. Основными причинами, приводящими к подобному состоянию, являются беременность, асцит, ожирение, крупные опухоли брюшной полости и забрюшинные опухоли. Кардинальное отличие острой ВБГ от хронической заключается в том, что последняя, развиваясь постепенно, не приводит к полиорганной недостаточности (ПОН), т.е. к АКС; у этих пациентов прямой зависимости между ВБД и функцией внутренних органов нет.
Системное влияние ВБГ на организм человека складывается из следующих составляющих: угнетение сердечной и дыхательной функций преимущественно за счет механических факторов (высокое стояние диафрагмы, уменьшение возврата венозной крови к сердцу на фоне компрессии нижней полой вены), снижение диуреза вплоть до анурии вследствие сдавления почечных вен, нарушение барьерной функции кишечника на фоне его гипоксии, что приводит к транслокации микроорганизмов через неповрежденную стенку кишки в воротный кровоток, лимфатические сосуды и брюшную полость с возможным ранним развитием сепсиса при отсутствии очевидного в общепринятом смысле его источника. Кроме того, увеличение объема внутренних органов, связанное с их отеком в условиях сдавления воротной вены, реализуется в дальнейшем повышении ВБД, замыкая таким образом порочный патофизиологический круг [1, 18].
Среди причин, приводящих к острому повышению ВБД и, как следствие, к АКС, выделяют спонтанные, послеоперационные, посттравматические и ятрогенные (см. таблицу).
Причина ВБГ может локализоваться в забрюшинном пространстве в виде отека и воспаления забрюшинной клетчатки или ретроперитонеальной гематомы либо в брюшной полости при непроходимости или парезе кишечника вследствие различных заболеваний, избыточном пневмоперитонеуме, широком тампонировании брюшной полости или ушивании ее с натяжением, например при аутопластическом закрытии дефекта брюшной стенки при больших вентральных грыжах [15, 18].
При остром деструктивном панкреатите (ОДП) наибольшее влияние на уровень ВБД оказывает массивная секвестрация жидкости в забрюшинную клетчатку, что значительно уменьшает объем брюшной полости, вследствие чего давление в ней возрастает; парез кишечника и асцит в этом случае играют значительно меньшую роль. Развитие ВБГ приходится на первую — стерильную — фазу заболевания, точнее — на первые 3-4 сут его течения, когда происходит быстрое накопление экссудата в парапанкреатическом, параколическом, реже в паранефральном клетчаточных пространствах. С учетом морфологической концепции развития панкреонекроза становится ясным, что более обширная деструкция поджелудочной железы (ПЖ) и забрюшинной жировой клетчатки значительно чаще может приводить к развитию ВБГ и соответственно АКС.
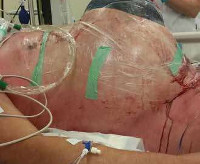
Летальность при возникновении АКС даже при своевременном проведении надлежащих лечебных мероприятий весьма высока и достигает 42-68%, а отсутствие адекватной коррекции или ее задержка всего на несколько часов неминуемо приводит к смерти больного [12]. Лечение данного состояния заключается в немедленном снижении ВБД путем декомпрессии брюшной полости, для чего обычно выполняют тотальную срединную лапаротомию (релапаротомию), устраняют причину ВБГ и увеличивают объем брюшной полости различными способами, чаще всего путем подшивания к апоневрозу по периметру раны заплаты из синтетического материала [6, 16, 21], подкожную клетчатку при этом тампонируют, швы на кожу не накладывают (рис. 1). Рисунок 1. Увеличение объема брюшной полости при АКС на фоне перитонита.
Рисунок 1. Увеличение объема брюшной полости при АКС на фоне перитонита.
Если возникают показания к релапаротомии (например, запланированные санации брюшной полости при распространенном перитоните), последнюю выполняют путем рассечения заплаты, операцию завершают наложением швов на рассеченные края. После стихания проявлений основного заболевания, снижения ВБД и купирования ПОН заплату удаляют, а целостность брюшной стенки восстанавливают окончательно, включая ушивание апоневроза.
Сложность декомпрессии брюшной полости при АКС, возникшем на фоне ОДП, заключается в том, что лапаротомия в первой фазе его течения является крайне нежелательной и даже вредной манипуляцией в связи с практически неизбежным инфицированием еще не подвергшихся секвестрации некротизированных зон, что значительно усугубляет прогноз [9]. Кроме того, в развитии ПОН при панкреонекрозе, кроме АКС, важную роль играет цитокиновая агрессия, быстро устранить которую как хирургическим, так и неоперативным путем невозможно. Это означает, что снижение ВБГ при ОДП ликвидирует лишь одно из звеньев патогенеза ПОН, но не излечивает ее полностью.
На основании этих предпосылок мы пришли к мнению, что при выборе наиболее предпочтительного способа декомпрессии брюшной полости при АКС, возникшем у пациентов с ОДП, необходимо придерживаться следующих критериев:
1) операция должна приводить к максимальному увеличению объема брюшной полости;
2) обязательно сохранение полной герметичности париетальной брюшины;
3) вмешательство по возможности должно быть минимально травматичным.
Всем перечисленным условиям удовлетворяет так называемая фасциотомия, т.е. широкое рассечение апоневроза по белой линии живота. Объем брюшной полости при этой манипуляции увеличивается за счет расхождения прямых мышц живота и растяжения кожи и брюшины, герметичность брюшной полости сохраняется. При этом операция производится из небольших (2-3 см) кожных разрезов.
Нами разработан и впервые применен в клинической практике способ фасциотомии для лечения АКС при ОДП с благоприятным результатом[1].
Методика (рис. 2). Рисунок 2. Схема фасциотомии. Под эндотрахеальным наркозом по средней линии живота производим два кожных разреза длиной 2-3 см. Один разрез располагается на середине расстояния между мечевидным отростком и пупком, другой — ниже пупка. Обнажаем апоневроз, осуществляем тщательный гемостаз. Тупым путем производим тоннелизацию подкожно-жировой клетчатки из обоих разрезов кверху и книзу. Затем, приподнимая края кожи крючками, ножницами рассекаем апоневроз на всем протяжении, строго придерживаясь при этом хода белой линии, достигая вверху мечевидного отростка, внизу лонного сочленения. Особое внимание уделяем сохранению целостности брюшины. Убедившись в отсутствии кровотечения, разрезы кожи ушиваем наглухо отдельными швами, накладываем стерильную повязку. Через 30 мин после окончания вмешательства измеряем ВБД. В дальнейшем рану ведем по общехирургическим принципам, осуществляя ежедневные перевязки. Швы с кожи снимаем на 8-10-е сутки после операции.
Рисунок 2. Схема фасциотомии. Под эндотрахеальным наркозом по средней линии живота производим два кожных разреза длиной 2-3 см. Один разрез располагается на середине расстояния между мечевидным отростком и пупком, другой — ниже пупка. Обнажаем апоневроз, осуществляем тщательный гемостаз. Тупым путем производим тоннелизацию подкожно-жировой клетчатки из обоих разрезов кверху и книзу. Затем, приподнимая края кожи крючками, ножницами рассекаем апоневроз на всем протяжении, строго придерживаясь при этом хода белой линии, достигая вверху мечевидного отростка, внизу лонного сочленения. Особое внимание уделяем сохранению целостности брюшины. Убедившись в отсутствии кровотечения, разрезы кожи ушиваем наглухо отдельными швами, накладываем стерильную повязку. Через 30 мин после окончания вмешательства измеряем ВБД. В дальнейшем рану ведем по общехирургическим принципам, осуществляя ежедневные перевязки. Швы с кожи снимаем на 8-10-е сутки после операции.
Влияние фасциотомии на течение АКС было ранее изучено в эксперименте на свиньях. Оказалось, что в результате операции у наблюдавшихся животных произошло быстрое снижение ВБД и усиление мезентериального кровотока [7].
В литературе удалось найти немногочисленные описания единичных клинических наблюдений фасциотомии, выполненной с целью лечения АКС, в том числе при остром панкреатите [8, 14] и при политравме [5]. Авторы руководствовались схожими предпосылками, однако технические аспекты описанной операции отличаются от разработанных нами, при этом нет указаний на выздоровление больных после ликвидации у них АКС.
Приводим собственное наблюдение.
Больной Б., 32 лет, поступил в клинику через 8 ч после появления симптомов острого панкреатита, которые возникли после употребления большого количества алкоголя. Состояние при поступлении было расценено как тяжелое: бледные кожные покровы с «мраморным» оттенком, тахикардия до 140 ударов в 1 мин, склонность к гипотензии (АД 100/60 мм рт.ст.), гиповолемия с уровнем Нb 192 г/л. Госпитализирован в отделение реанимации, где начата комплексная интенсивная терапия, исходный уровень ВБД был равен 8 мм рт.ст. При УЗИ обнаружены острый панкреатит, небольшое количество свободной жидкости в сальниковой сумке, признаки параколита слева.
Выполнена ЭГДС (выявлен эрозивный гастродуоденит), установлен назоеюнальный зонд, через который осуществляли энтеральное питание и селективную деконтаминацию кишечника.
На 2-е сутки заболевания и лечения на фоне относительно стабильного состояния у пациента отметили увеличение живота в объеме, при этом уровень ВБД составил 14 мм рт.ст. Диагностирована ВБГ I степени, лечение продолжено.
К началу 3-х суток развилась дыхательная недостаточность и энцефалопатия, что потребовало применения искусственной вентиляции легких и медикаментозной седации, в это же время обнаружили двустороннее геморрагическое пропитывание подкожной клетчатки в поясничных областях с переходом на бедра, что явилось свидетельством обширного тяжелого деструктивного процесса.
Выполнена КТ с внутривенным контрастным усилением (рис. 3, а), Рисунок 3. Компьютерные томограммы больного Б. а — при поступлении. Субтотальный некроз ПЖ, параколит слева. при которой диагностирован полный некроз тела и хвоста ПЖ с сохранением жизнеспособности только ее головки, парапанкреатит, левосторонний параколит, распространяющийся до подвздошной области.
Рисунок 3. Компьютерные томограммы больного Б. а — при поступлении. Субтотальный некроз ПЖ, параколит слева. при которой диагностирован полный некроз тела и хвоста ПЖ с сохранением жизнеспособности только ее головки, парапанкреатит, левосторонний параколит, распространяющийся до подвздошной области.
К середине этих же суток на фоне быстрого повышения ВБД до 28 мм рт.ст., что сопровождалось еще более значительным увеличением объема живота, возникли анурия и гипотензия с АД 75/40 мм рт.ст. Начато внутривенное введение дофамина в увеличивающихся дозах, максимально 12 мкг на 1 кг массы тела в 1 мин — без эффекта, затем — адреналина в дозе 0,15 мг на 1 кг массы тела в 1 мин, чем удалось стабилизировать АД на уровне 125/75 мм рт.ст. Проявления дыхательной недостаточности значительно усугубились — на фоне принудительной исскуственной вентиляции легких 100% кислородом индекс оксигенации снизился до критического уровня, составив 115 (нижняя граница нормы 350). Уровни мочевины и креатинина в сыворотке крови в это же время повысились до 32 ммоль/л и 298 мкмоль/л соответственно. Таким образом, на 3-и сутки заболевания и лечения у больного с субтотальным некрозом ПЖ и обширным некрозом забрюшинной жировой клетчатки отмечена развернутая картина прогрессирующей ПОН с недостаточностью функции четырех органов или систем (легких, почек, головного мозга, сердца и сосудов), что произошло на фоне ВБГ III степени. Диагностирован АКС, в связи с чем пациенту экстренно выполнили фасциотомию путем рассечения апоневроза по белой линии живота от мечевидного отростка до лонного сочленения без вскрытия брюшины из двух небольших кожных разрезов длиной по 3 см. Через 30 мин после операции ВБД снизилось с 28 до 19 мм рт.ст., а через 4 ч — до 14 мм рт.ст., после чего восстановился нормальный темп диуреза, показатели гемодинамики позволили прекратить инфузию адреналина, была уменьшена дыхательная поддержка. На 2-е сутки после операции ВБД снизилось до 8 мм рт.ст., на 3-и сутки — до 5 мм рт.ст. и впоследствии не повышалось. Суточный диурез составлял 2-2,5 л, показатели мочевины и креатинина крови к 5-м суткам после декомпрессии брюшной полости снизились до нормы. Постепенно индекс оксигенации повысился до нормальной величины, на 6-е сутки после операции больной был переведен на режим вспомогательной вентиляции, а через 10 сут после фасциотомии — на самостоятельное дыхание. Швы с ран сняты в срок, зажили первичным натяжением. Фазу инфекционных осложнений ОДП удалось миновать путем комплексной профилактики, включающей внутривенное введение тиенама в дозе 3 г в сутки, энтеральное зондовое питание и селективную деконтаминацию желудочно-кишечного тракта. На 14-е сутки лечения больной переведен в хирургическое отделение. Необходимости выполнения чрескожных диагностических и лечебных вмешательств под контролем УЗИ, а также хирургической некрсеквестрэктомии не возникло. В области некротизированных тела и хвоста ПЖ образовалась острая псевдокиста размером 17×7×7 см, параколит регрессировал (см. рис. 3, б). Рисунок 3. Компьютерные томограммы больного Б. б -перед выпиской. Через 29 сут лечения больной был выписан.
Рисунок 3. Компьютерные томограммы больного Б. б -перед выпиской. Через 29 сут лечения больной был выписан.
Госпитализирован через 3 мес в плановом порядке (рис. 4). Рисунок 4. Вид передней брюшной стенки того же больного перед грыжесечением. При компьютерной томографии (рис. 5)
Рисунок 4. Вид передней брюшной стенки того же больного перед грыжесечением. При компьютерной томографии (рис. 5) Рисунок 5. Компьютерная томограмма того же больного перед грыжесечением. киста уменьшилась в размерах до 12×5×4 см, начинает замещаться рубцовой тканью, клинические проявления ее отсутствуют, признаков сахарного диабета и экскреторной недостаточности ПЖ нет.
Рисунок 5. Компьютерная томограмма того же больного перед грыжесечением. киста уменьшилась в размерах до 12×5×4 см, начинает замещаться рубцовой тканью, клинические проявления ее отсутствуют, признаков сахарного диабета и экскреторной недостаточности ПЖ нет.
Выполнено грыжесечение с пластикой дефекта в апоневрозе синтетическим аллотрансплантатом, послеоперационный период протекал без осложнений (рис. 6). Рисунок 6. Вид передней брюшной стенки того же больного после грыжесечения.
Рисунок 6. Вид передней брюшной стенки того же больного после грыжесечения.
Представленное наблюдение демонстрирует, с одной стороны, важную роль внутрибрюшной гипертензии в развитии и стремительном прогрессировании полиорганной недостаточности при тяжелом деструктивном панкреатите, с другой — достоинства своевременно выполненного оригинального способа декомпрессии брюшной полости, осуществленного без вскрытия брюшины. Вовремя сделанная фасциотомия и использование современного комплекса интенсивной терапии позволили добиться излечения больного, находившегося в крайне тяжелом состоянии, без выполнения миниинвазивных вмешательств и травматичной некрсеквестрэктомии.
Литература
- Абакумов М.М., Смоляр А.Н. Значение синдрома высокого внутрибрюшного давления в хирургической практике (обзор литературы). Хирургия 2003; 12: 87-95.
- Мыльников А.Г., Паньков А.Г., Чурадзе Б.Т., Шабрин А.В., Шаповальянц С.Г. Лечение абдоминального компартмент-синдрома при деструктивном панкреатите. Материалы 2-го съезда хирургов Южного федерального округа. Пятигорск 2009; 184.
- Brush J.M., Moore E.E., Moore F.A., Franciose R. The Abdominal Compartment Syndrome. Surg Clin North Am 1996; 76: 833-842.
- Cheatham M.L. Abdominal compartment syndrome, case and lecture. www.orlandoregional.org/for_physicians/med_ed/surgical
- Cheatham M.L., Fowler J., Pappas P. Subcutaneous linea alba fasciotomy: a less morbid treatment for abdominal compartment syndrome. Am Surg 2008; 74: 8: 746-749.
- Cuthbertson S.J. Nursing care for raised intra-abdominal pressure and abdominal decompression in the critically ill. Intens Crit Care Nurs 2000; 16: 3: 175-180.
- Dakin J.F., Nahouraii R., Gentileschi P. et al. Subcutaneous endoscopic fasciotomy in a porcine model of abdominal compartment syndrome: a feasibility study. J Laparoendosc Adv Surg Tech A 2004; 14: 339-344.
- Dambrauskas Z., Paršeliūnas A., Maleckas A. et al. Interventional and surgical management of abdominal compartment syndrome in severe acute pancreatitis. Medicina (Kaunas) 2010; 46: 4: 249-255.
- De Waele J.J., Hoste E., Blot S.I. et al. Intra-abdominal hypertension in patients with severe acute pancreatitis. Crit Care 2005; 9(4): 452-457.
- Hong J.J., Cohn S.M., Perez J.M. et al. Prospective study of the incidence and outcome of intraabdominal hypertension and the abdominal compartment syndrome. Br J Surg 2002; 89: 5: 591-596.
- Joynt G.M., Ramsay S.J., Buckley T.A. Intra-abdominal hypertension — implications for the intensive care physician. Ann Acad Med Singapure 2001; 30: 3: 310-319.
- Kirkpatrick A.W., Brenneman F.D., McLean R.F. et al. Is clinical examination an accurate indicator of raised intra-abdominal pressure in critically injured patients? Can J Surg 2000; 53: 207-211.
- Kron I.L., Harman P.K., Nolan S.P. The measurements of intraabdominal pressure as a criterion for abdominal re-exploration. Ann Surg 1984; 199: 28-30.
- Leppäniemi A.K., Hienonen P.A., Siren J.E. et al. Treatment of abdominal compartment syndrome with subcutaneous anterior abdominal fasciotomy in severe acute pancreatitis. World J Surg 2006; 30: 10: 1922-1924.
- Malbrain V.L.N.G. Abdominal pressure in the critically ill. Curr Opin Crit Care 2000; 6: 17-29.
- Mayberry J.C., Mullins R.J., Crass R.A., Trunkey D.D. Prevention of abdominal compartment syndrome by absorbable mesh prothesis closure. Arch Surg 1997; 132: 9: 957-961.
- Meldrum D.R., Moore F.A., Moore E.E. et al. Prospective characterization and selective management of the abdominal compartment syndrome. Am J Surg 1997; 174: 6: 667-672.
- Mohapatra B. Abdominal compartment syndrome. Indian J Crit Care Med 2004; 8: 1: 26-32.
- Nathens A.B., Brenneman F.D., Boulanger B.R. The Abdominal Compartment Syndrome. Can J Surg 1997; 4: 254.
- Rotondo M.F., Cheatham M.L., Moore F.A., Reilly P.M. Abdominal Compartment Syndrome-Symposium. Contemporary Surgery 2003; 59: 260-270.
- Tons C., Schachtrupp A., Hoer J. et al. Abdominal compartment syndrome: prevention and treatment. Chirurgia 2000; 71: 8: 918-926.
Источник
